Введение
Печень выполняет множество функций, включая синтетическую, дезинтоксикационную, барьерно-защитную, кроветворную, эндокринную, участвует в регуляции метаболического, антигенного и температурного гомеостаза организма. Она обладает большими резервными возможностями, клинические признаки нарушения функций печени проявляются при потере значительной части ее клеточной массы, когда наступившие изменения становятся, как правило, необратимыми. В связи с этим для клинической практики необходимы скрининговые тесты для оценки функционального состояния печени.
Наиболее частыми причинами хронических заболеваний печени (ХЗП) являются вирусы гепатита В и С, злоупотребление алкоголем, нарушение жирового обмена и сахарный диабет, приводящие к развитию неалкогольной жировой болезни печени (НАЖБП). Нередко эти факторы присутствуют у одного и того же больного, что ускоряет прогрессирование болезни.
В мире насчитывают более 2 млрд носителей различных вирусов гепатита. Из них около 400 млн человек страдают хроническим гепатитом В и около 170–200 млн – хроническим гепатитом С [43]. У четверти пациентов со стеатозом печени развивается фиброз печени (ФП) [1]. В ряде исследований показано, что в 10% случаев в течение примерно 10 лет стеатоз печени прогрессирует в неалкогольный стеатогепатит (НАСГ). В 5–25% случаев НАСГ трансформируется в цирроз печени (ЦП). Установлено, что 60–80% всех криптогенных ЦП являются исходами НАЖБП [17], а направление на трансплантацию печени в 10% случаев обусловлено цирротической стадией НАСГ. Следует отметить, что пациенты с НАЖБП и другими ХЗБ – группа риска развития гепатоцеллюлярной карциномы [20, 25]. Развитие последней наблюдается приблизительно у 10% пациентов с цирротической стадией НАСГ в течение 10 лет [30].
ХЗБ чаще страдают люди трудоспособного возраста, и они приводят к длительным периодам временной трудоспособности и инвалидизации. Поэтому эффективные профилактика и лечение ХЗБ – важнейшая задача здравоохранения как в России, так и за рубежом. При этом существует проблема ранней диагностики нарушения функций печени, решение которой может способствовать более своевременному и успешному лечению пациентов с ХЗБ. Ни один из современных методов диагностики не дает информации о функциональном состоянии (резерве) печени.
Современные методы диагностики заболеваний печени
На сегодняшний день в клинической практике при ХЗП используются следующие методы исследования:
- Лабораторные тесты (биохимический анализ крови с оценкой «печеночных проб»).
- Инструментальные методы: ультразвуковое исследование органов брюшной полости, гастроскопия, компьютерная томография, магнитно-резонансная томография.
- Методы оценки стадии ФП: пункционная биопсия печени (ПБП), фибротесты, фиброэластометрия.
- Расчетные прогностические индексы: APRI, FIB–4, MELD, FibroFast, FibroIndex, FibroMeter, Hepascor.
Наиболее востребованными в клинике с точки зрения прогноза, а также выбора тактики лечения являются методы, определяющие стадию ФП. ПБП – метод, который считают эталонным для определения стадии ФП и активности воспаления [8]. В настоящее время прижизненное морфологическое исследование ткани печени продолжает широко применяться. Используемые до настоящего времени методы функциональной диагностики не в состоянии дать ответ на вопросы о действительном характере морфологических изменений печени при различных ее поражениях. ПБП позволяет подтвердить, уточнить, а нередко и изменить клинический диагноз [46]. При этом следует отметить, что метод обладает высокой специфичностью (81–99%), но недостаточно высокой чувствительностью (36–57%) [7].

К сожалению, данная методика является инвазивной, может приводить к развитию таких осложнений, как внутрибрюшное кровотечение (0,24%) [26], внутрипеченочная гематома (2%) [13], пневмоторакс (0,08%) [53], желчный перитонит (0,04%) [38], летальный исход (0,01%) [55], местное метастазирование при прицельной биопсии злокачественных опухолей (0,0005%) [53]. Причиной невозможности проведения ПБП также является страх пациентов перед процедурой. Страх болевых ощущений в месте прокола и побочные эффекты на анестезию заставляют до трети больных отказаться от выполнения ПБП. Это приводит к замедлению принятия решения о начале специфической терапии и продлению сроков госпитализации [23, 32].
Кроме того, следует указать на требования к количеству материала при ПБП, несоблюдение которых может приводить к недостаточно корректным заключениям: длина столбика печеночной ткани должна составлять >15 мм, а количество портальных трактов – не менее 6–8 [2, 10]. Следует подчеркнуть, что ПБП не дает информации о функции печени.
В последние годы в клинической практике получили широкое распространение такие неинвазивные методы оценки ФП, как эластометрия и фибротесты.
К факторам, лимитирующим применение эластометрии, относятся индекс массы тела ≥28 кг/м2, активный гепатит, наличие асцита, холестаз, наличие венозного застоя в системе воротной вены, недостаточный опыт оператора, что требует технического совершенствования метода. Вместе с тем эластометрия может использоваться как для скрининга и ранней диагностики, так и для уточнения стадии поражения печени и контроля за эффективностью проводимой терапии [42].
Фибротест относится к неинвазивным методам диагностики ФП и активности патологического процесса в печени. Фибротест – это специальный биохимический анализ крови, основанный на определении маркеров фиброза, воспаления и стеатоза в крови пациента. Так, Фибротест (Фибромакс) включает компьютерную обработку 5 биохимических показателей: α2-макроглобулин, гаптоглоблин, аполипопротеин А1, γ-глутамилтранспептидаза (ГГТП), общий билирубин, аланинаминотрансфераза (АЛТ).
Состояния, лимитирующие проведение исследования: острый гепатит (любой этиологии), внепеченочный холестаз. Кроме того, метод не может считаться достоверным при хронических воспалительных заболеваниях соединительной ткани (ревматизм, ревматоидный артрит, системная красная волчанка, склеродермия и др.), наследственных гипербилирубинемиях по типу синдрома Жильбера, гемолитической анемии. Фибротесты можно рассматривать как альтернативу другим методам, когда последние невозможно выполнить в связи с противопоказаниями (например, ПБП) или при ожирении, асците (эластометрия).
Следует отметить, что чувствительность и специфичность данных тестов высоки только при их комбинации (эластометрия+фибротест) [44], только в этом случае данные методы диагностики способны обеспечить результат, по информативности аналогичный таковому при ПБП. Несмотря на возможность оценки степени активности и стадии ФП, данные методы не позволяют оценить функциональное состояние печени.
Дыхательные тесты и их роль в диагностике заболеваний печени
В последнее время за рубежом активно используют неинвазивные методики определения функциональной активности печени, ее функционального резерва с помощью изотопных дыхательных тестов (табл. 1) [45].
13С-дыхательные тесты в отличие от ПБП представляют информацию о функциональном резерве и метаболической емкости печени и могут отражать динамику процесса, являясь неинвазивными, безопасными и легкоповторяемыми. Дыхательные тесты могли бы сыграть важную роль в лечении и ведении больных ХЗП, а также в трансплантологии, в до- и послеоперационном периодах [16, 51].
Однако не все 13С-меченые препараты, использованные в дыхательных тестах для оценки микросомальной функции печени, были тщательно исследованы. Например, по 13С-фенацетин-дыхательному тесту информации совсем немного. Фенацетин – высокоэкстрактивный препарат, следовательно, его метаболизм зависит от кровотока в печени, что может повлиять на значения дыхательных тестов у больных с заболеванием печени, наличием портальной гипертензии и печеночных шунтов [5].
Дыхательный тест «13С-кофеин» может быть адекватным методом для оценки метаболической функции печени при ХЗП и использоваться для прогнозирования ФП при хроническом гепатите С и НАЖБП, но необходимы дальнейшие исследования, чтобы оценить удобство и простоту использования теста [16].
Дыхательные тесты 13C-метацетин и 13C-аминопирин были изучены наиболее широко и могут быть особенно полезными при ранней диагностике заболевания печени и определении прогноза. В отличие от аминопирина метацетин имеет высокий коэффициент экстракции, который может влиять на значения 13C-метацетинового дыхательного теста, особенно у больных ХЗП с портальной гипертензией и портосистемными шунтами [5].
При этом 13С-меченые дыхательные тесты могут быть выполнены в любом месте, в любое время и повторяться, не затрагивая пациента и его здоровье.
Следует подчеркнуть, что дыхательные тесты не являются альтернативой методам, которые оценивают стадию ФП и воспаление (например, ПБП). Во многих случаях наиболее важна оценка функционального состояния печени, например при острой печеночной недостаточности, когда и ФП, и активность воспаления могут быть минимальными. В случае верифицированного ЦП информация о функциональном резерве может быть также крайне важной с точки зрения показаний к трансплантации печени. Эти методы могут уменьшить потребность в ПБП, особенно при использовании вместе с другими рутинными методами диагностики.
Таким образом, представляется, что такие дыхательные тесты, как 13С-аминопириновый и 13С-метацетиновый, могут иметь значение в оценке потенциала функции микросомальных систем печени и играть определяющую роль при оценке прогноза и выборе терапии у пациентов с ХЗП [16].
Роль 13С-метацетинового дыхательного теста в диагностике заболеваний печени
Наиболее популярным является 13С-метацетиновый дыхательный тест (13С-МДТ) в связи с его безопасностью, чувствительностью и специфичностью (табл. 2) [15].
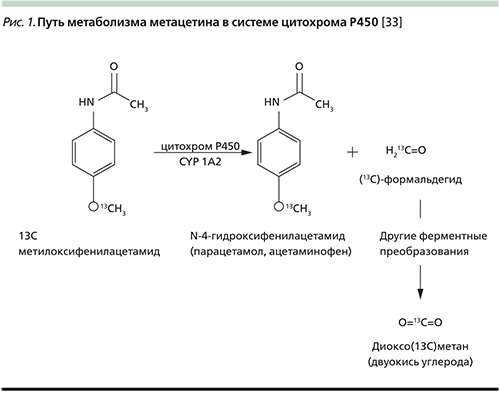
13C-МДТ печени был впервые описан Р. Krumbiegel и соавт. в 1985 г. [18]. С тех пор он считается полезным инструментом для оценки степени повреждения функционального резерва печени. Тест функциональной активности печени основан на метаболизме 13С-метацетина ее ферментными системами (CYP450) с образованием 13СО2 (рис. 1) [33].

Цитохром Р450 1А2 (CYP1A2) представляет собой печеночный фермент, который играет важную роль в метаболизме ксенобиотиков, в т.ч. таких, как метацетин, теофиллин, кофеин и клозапин [28]. По дыхательному тесту можно легко оценить функцию печени на основе меченых субстратов, которые используются и метаболизируются в печени [27, 45]. 13С-MДT является наиболее подходящим тестом для оценки функционального резерва печени по сравнению с другими тестами [3, 31]. По сравнению с другими молекулами, которые используются для дыхательных тестов, 13С-метацетин является безопасным, дешевым и имеет быстрый клиренс [24, 31].
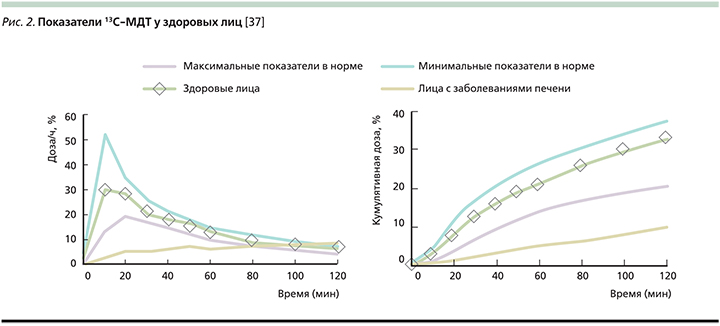
На рис. 2 представлены показатели 13С-МДТ у здоровых лиц [37].
Тест позволяет с высокой точностью определить фармакокинетические параметры деметилирования метацетина и на этой основе оценить степень детоксикационной активности печени и даже ее массу. Разработанные математические модели позволяют различать стадию ЦП, выраженность гепатита и других заболеваний [50].
С помощью 13С-MДT получены данные о количественных характеристиках влияния ожирения печени на снижение ее детоксикационной активности. Результаты 13С-MДT при метастатическом поражении печени и в послеоперационном периоде позволяют с высокой точностью определить активность интактной ткани, а также наблюдать восстановление ее биохимических показателей. Имеются сведения о возможности использования 13С-МДТ для изучения функциональной активности печени в условиях застоя в венозной системе брюшной полости (венозное полнокровие), достигавшегося размещением пациента в т.н. антиортостатическом положении (АНОП; под углом -15° к линии горизонта) [41].
Метод позволяет изучать активацию желчевыделительной функции печени, а также определять ее полную (тотальную) метаболическую емкость, включая функционирующую и нефункционирующую (резервную) части печени [52].
Исследования в АНОП показали, что механизм повышения экскреторной активности в органах пищеварительной системы и активация желчеотделения в печени обусловлены возникновением полнокровия в венозной системе печени и брюшной полости [39, 40]. Радиоизотопные методы и эндоскопические исследования в АНОП подтвердили роль венозного застоя в печени в активации желчеотделения и продемонстрировали изменения, связанные со снижением экскреторной активности гепатоцитов и концентрационной функции системы желчеотделения [41]. Снижение функциональной активности печени в условиях венозного полнокровия не всегда сопровождается изменениями биохимических показателей крови [48, 49], поскольку ее резервные возможности могут маскировать угнетение функциональной активности [55, 56].
Имеются данные о сильной прямой положительной корреляции (r=0,706) между показателями 13С-МДТ и результатами динамической гепатосцинтиграфии у пациентов с первичным и метастатическим поражением печени. Авторы полагаю, что применение 13С-МДТ позволит улучшить предоперационную оценку и результаты анатомических резекций у данных больных [51].
Данные, представленные в табл. 3, убедительно свидетельствуют, что 13С-МДТ достаточно эффективен при 3–4-й стадиях ФП.
Представляется, что необходимо продолжить изучение возможностей применения данного метода применительно к ХЗП различной этиологии.
Также, согласно выводам исследователей, 13С-МДТ можно применять для оценки эффективности проведенной терапии. Исследование было проведено на 96 пациентах с ХЗП различной этиологии, в динамике были оценены показатели 13С-МДТ на фоне приема лозартана (блокатор рецепторов ангиотензина II) в качестве антифибротического агента [47].
Приводятся данные, согласно которым 13С-МДТ обладает высокой чувствительностью при различных поражениях печени, уровень воспалительной активности оказывает эффект при проведении теста [6].
Имеются отдельные сообщения об использовании 13С-МДТ при НАЖБП [6]. Авторы отметили у больных НАЖБП достоверное снижение функции печени по сравнению с контролем (18,03±0,6 против 26,46±0,67%). При этом указывается, что тест позволяет оценивать массу функционирующих гепатоцитов [5, 9].
Согласно выводам ряда исследователей, внедрение в практику 13С-МДТ позволит расширить знания о патогенезе стеатоза печени, усовершенствовать его диагностику и лечение [54].
В то же время другие авторы отмечают, что этот тест не обнаруживает отличий между группой контроля и пациентами с ранними стадиями ФП, а также не позволяет оценивать уровень воспаления или степень ФП [14].
Неинвазивные дыхательные тесты могут быть ценным диагностическим инструментом, поскольку они дают возможность определить особенности ферментативной и метаболической функций печени «in vivo» [21]. Следует отметить, что метаболизм метацетина происходит исключительно в печени, поэтому этот метод обладает очень высокими специфичностью и чувствительностью, также необходимо учесть, что его возможно проводить на масс-спектрометрах, инфракрасных газоанализаторах, используемых и для других дыхательных тестов с меченым углеродом. Активное внедрение 13С-МДТ в клиническую практику представляется целесообразным как с научной, так и с экономической точки зрения, поскольку данный метод неинвазивен, относительно прост в применении, не требует специальных навыков у оператора, не предусматривает особых условий забора материала.
Обращает на себя внимание корреляция между «печеночными» пробами и 13С-МДТ. Наиболее заметная корреляция наблюдалась со следующими показателями: билирубин, ГГТП, МНО (международное нормализованное отношение), протромбиновое время, протромбиновый индекс, факторы свертываемости крови 5 и 7. Авторы отмечают, что корреляция между показателями 13С-МДТ и биохимических маркеров гепатита колеблется от 0,2 до 0,7. При этом статистическая значимость корреляций не была достигнута из-за небольшого числа пациентов и проведенных тестов. Очевидно, что для получения статистически значимых результатов необходимо большее число наблюдений [11].
Методика проведения теста
Принцип дыхательного теста основан на оценке определения метаболизируемого субстрата в выдыхаемом воздухе. Когда субстрат попадает в организм, он проходит через кровоток, метаболизируется в печени, а затем выводится через легкие в виде 13СО2. Скорость и объем выведения субстрата определяют метаболическую функцию печени [35].
Препарат применяется перорально с фиксированной дозировкой 75 мг на одно исследование в виде раствора в 200 мл воды. Первым метаболическим процессом, которому подвергается препарат, является О-деметилирование – отщепление меченой изотопом 13С-метильной группы, происходящее при каталитическом воздействии энзимов системы цитохромов печени Р450 с синтезом формальдегида. В дальнейшем метка входит в состав муравьиной кислоты и бикарбонат-иона и выводится через легкие в виде СО2. Измеряя изотопный состав углерода в углекислоте выдыхаемого воздуха, можно получить информацию о скорости печеночного метаболизма.
Забор образцов выдыхаемого воздуха производится в течение 2 часов – перед приемом препарата, через каждые 10 минут в первый час исследования и через каждые 20 минут в течение второго часа. Результаты каждого исследования представляются в виде зависимостей скорости вывода экзогенной углеродной метки (PDR) от времени и суммарной доли выведенной метки от времени [29, 50]. Ряд европейских клиник применяют 13C-МДТ для количественной оценки функциональных резервов печени при циррозе [4, 37].

При нарушении метаболической функции печени различного генеза наблюдается снижение скорости вывода изотопной метки и увеличение времени после приема препарата, в течение которого достигается максимум скорости. При тяжелых формах ХЗП скорость вывода изотопной метки находится на очень низком уровне и практически не изменяется в течение двух часов, когда производятся заборы образцов выдыхаемого воздуха. Имеются исследования, которые показывают хорошую корреляцию 13С-МДТ с тяжестью поражения печени при ЦП в зависимости от класса по Чайлд–Пью (табл. 4) [19, 36, 37].
Примеры клинического применения 13С-МДТ
Пациент О., мужчина 55 лет с верифицированным ЦП класса А по Чайлд–Пью, HCV-этиологии, нон-респондер (прошел курс тройной противовирусной терапии). Диагноз ЦП подтвержден при помощи ПБП.
Сопутствующие заболевания: сахарный диабет 2 типа, инсулинпотребный (гликированный гемоглобин – 11,6 %).
Обращает на себя внимание, что при наличии ультразвуковых признаков портальной гипертензии варикозно расширенных вен пищевода не выявлено. В табл. 5 представлены данные лабораторно-инструментального обследования.
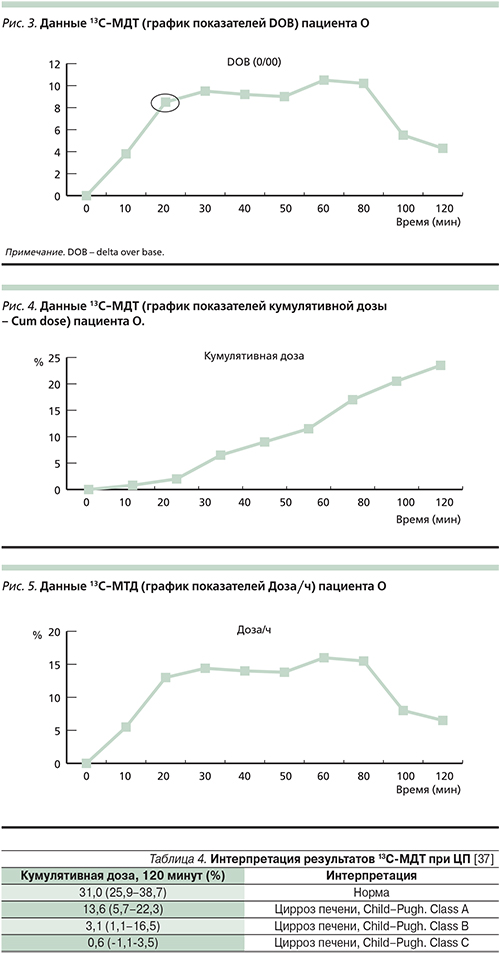
Выполнен 13C-МДТ, ниже полученные результаты приведены в виде графиков.
Результаты оценивались по следующим показателям:
- Параметр DOB-20 (delta over base на 20-й минуте исследования) – показатель разницы между исходным и полученным уровнем, т.е. соотношение выделенной 13С метки на 20-й минуте исследования и ее базального уровня. У здоровых пациентов данный показатель составляет 20,84.
- Параметры CUM-60, CUM-120 (кумулятивная доза к 60-й и 120-й минутам исследования соответственно) указывает на количество метаболизированного метацетина в процентах, рассчитывается исходя из суммарно выделенного 13С за время исследования. В норме показатель CUM-60 cоставляет 20,4%, а CUM-120 варьируется в пределах от 25,9 до 38,7%.
- Параметр Доза/ч демонстрирует скорость метаболизма метацетина в печени, определяемый по уровню выделения 13С с выдыхаемым воздухом. У здоровых людей эта величина должна достигать пика между 10-й и 20-й минутами, затем снижается. До 20-й минуты включительно показатель Доза/ч (%) для ЦП должен быть ниже 14,6% (чувствительность – 92,6%, специфичность – 84,1%).
DOB-20 у пациента О. составила 8,6 (рис. 3), что указывает на значительное снижение его величины у данного больного и свидетельствует о снижении функциональной активности печени тяжелой степени.
Хотя на 120-й минуте теста кумулятивная доза (CUM-120) достигла значения 23,2%, но к 60-й минуте теста показатель кумулятивной дозы составлял 11,4% (рис. 4), что свидетельствует о снижении количества функционирующих гепатоцитов тяжелой степени.
У пациента О. показатель Доза/ч к 20-й минуте был равен 13% (рис. 5), что наряду с другими показателями подтверждает наличие резкого снижения функционального резерва и косвенно указывает на высокую вероятность ЦП.
На примере другого пациента рассмотрим вариабельность показателей 13С-МТД в зависимости от стадии ЦП.
Пациент Д., женщина 43 лет с ЦП HCV-вирусной этиологии в анамнезе, высокая виремия, портальная гипертензия, гепатоспленомегалия, гиперспленизм. В табл. 6 представлены данные лабораторного обследования больной.
Пациентке проведено несколько различных курсов противовирусной терапии (Пегасис+ребетол, 24 недели, был получен частичный ответ; затем повторная «тройная» терапия (Виктрелис+Пегинтрон+ребетол, 4 месяца). Терапия отменена по причине отсутствия вирусологического ответа.
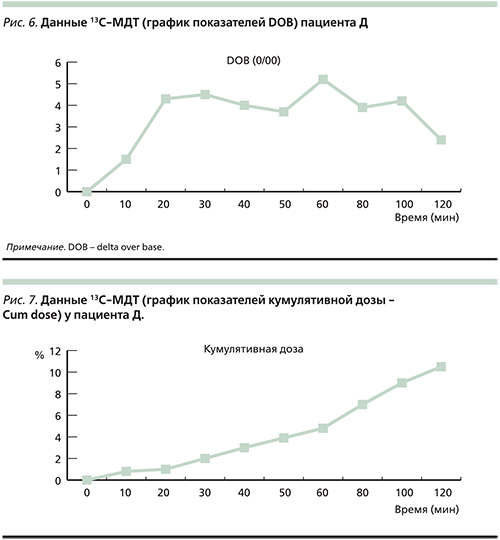
Данные, полученные при проведении 13С-МТД, представлены на рис. 6, 7, 8.
DOB-20 у пациента составила 4,3 (рис. 6). Значительное снижение величины DOB-20 свидетельствует о резком снижении функциональной активности печени.
К 60-й минуте кумулятивная доза (CUM-60) составила 4,9%, а к 120-й минуте теста она (CUM-120) достигла значения 10,5% (рис. 7), что свидетельствует о резком снижении количества функционирующих гепатоцитов. Данные изменения могут соответствовать классу В по Чайлд–Пью.
У данного пациента показатель Доза/ч к 20-й минуте был равен 6,2% (рис. 8), что наряду с другими показателями подтверждает наличие выраженного снижения функционального резерва печени и косвенно может указывать на наличие ЦП.
Заключение
Имеющиеся литературные данные подтверждают эффективность 13С-МДТ у пациентов при пересадке печени в хирургической практике (оценка функционального статуса печени донора и реципиента) [22, 34, 51], опухолях печени [12].
Также есть основания предполагать, что возможными областями применения 13С-МДТ в медицине могут быть неалкогольные или алкогольные стеатогепатиты, ФП и ЦП различной этиологии, хронические вирусные гепатиты В и С, аутоиммунные заболевания печени – для оценки тяжести поражения и степени дисфункции печени. Кроме того, точкой приложения 13С-МДТ мог бы быть мониторинг функционального резерва печени у полиморбидных пациентов и гепатотоксичности при длительном применении известных гепатотоксичных препаратов. Изучение влияния различных антиоксидантов и гепатопротекторов на динамику показателей 13С-МДТ у пациентов с ХЗБ также представляется крайне интересным.
Рассмотренные данные литературы и клинические случаи наглядно свидетельствуют, что данная методика способна отражать не только само наличие заболевания у пациента, но и степень его развития. Показатели данного теста, согласно данным литературы, коррелируют с прогностической шкалой Чайлд–Пью, а значит, могут указывать на прогноз заболевания, однако это требует уточнения. Необходимо проведение крупных исследований для изучения закономерностей изменения показателей 13С-МДТ в зависимости от стадии фиброза, функциональных проб печени, их взаимосвязи с существующими прогностическими индексами.


