Введение
В последние десятилетия в медицинcкой практике все чаще применяются хирургические методы коррекции ожирения. Безусловными лидерами по оперативной активности в 2014 г. являлись США и Канада (154 276 операций), Бразилия (86 840), Франция (37 300) и Аргентина (30 378). В настоящее время ежегодно в мире проводится около 0,5 млн бариатрических хирургических вмешательств (БХВ) [1].
Вышеописанная тенденция может определяться как ростом заболеваемости ожирением, так и недостаточной эффективностью консервативных методов его лечения. В период между 1980 и 2013 гг. доля взрослого населения с индексом массы тела (ИМТ) более 25 кг/м2 выросла с 28,8 до 36,9% у мужчин и с 29,8 до 38,0% у женщин. На Ассамблее Всемирной организации здравоохранения в мае 2013 г. по профилактике неинфекционных заболеваний и борьбе с ними одной из девяти обозначенных целей в глобальном плане являлась «остановка роста диабета и ожирения» [2].
В настоящее время признается, что стандартные консервативные мероприятия позволяют снизить вес лишь незначительно, причем рикошетный набор массы тела после эффективного лечения может происходить у 80% пациентов [3]. Проведенные мета-анализы демонстрируют, что соблюдение диеты и изменение образа жизни позволяют уменьшить вес лишь на 3–8%, дополнительная лекарственная терапия на 10–12%, бандажирование желудка на 16%, а гастрошунтирование на 32% [4, 5].
Все большая встречаемость в клинической практике пациентов, перенесших различные варианты БХВ, возможность развития ранних и поздних осложнений этих операций, большинство из которых связано с органами желудочно-кишечного тракта (ЖКТ), необходимость ведения таких пациентов врачами терапевтических специальностей обусловливают необходимость знания интернистами, в особенности гастроэнтерологами, основ бариатрической хирургии.
Показания к хирургическому лечению ожирения
Изначально бариатрическая хирургия применялась лишь для лечения пациентов с морбидным ожирением (ИМТ >40 кг/м2), при котором продолжительность жизни сокращается на 12–15 лет, вероятность смерти возра-стает в 12 раз, а консервативные методы лечения, как правило, неэффективны [6]. С течением времени показания к бариатрическому лечению значительно расширились. В соответствии с Европейскими рекомендациями по лечению ожирения 2015 г. хирургическое лечение может быть актуально для пациентов 18–60 лет с ИМТ >40 кг/м2, 35–40 кг/м2 и ассоциированными заболеваниями (сахарный диабет (СД) 2 типа и другие метаболические расстройства, различные заболевания сердечно-сосудистой и дыхательной систем, опорно-двигательного аппарата). Кроме того, оперативное вмешательство в некоторых случаях является вариантом лечения пациентов с СД 2 типа с ИМТ >30 кг/м2, поскольку может приводить к значительному улучшению течения и даже ремиссии данного заболевания [7].
История бариатрической хирургии началась в 1952 г., когда шведский хирург V. Henriksson впервые произвел удаление 105 см тонкой кишки у молодой пациентки с целью снижения веса [8]. В последующие 1970–1980 гг. в мире стали широко использоваться различные варианты еюноилеошунтирования – апробировались различные способы наложения анастомозов, выключались из пищеварения участки тонкой кишки различной длины.
Необходимо отметить, что в последнее десятилетие в медицинской литературе взамен термина «бариатрическая» (от древнегреческого βάρος – вес, тяжесть, и ἰατρεία – лечение) более востребован термин «метаболическая» хирургия, поскольку основной целью данных оперативных вмешательств признается не столько снижение веса, сколько улучшение метаболического профиля пациента, качества и продолжительности его жизни.
Варианты БХВ
К основным вариантам БХВ относятся установка внутрижелудочных баллонов, гастропластика, регулируемое бандажирование желудка (РБЖ), продольная резекция желудка (ПРЖ), гастрошунтирование (ГШ), билиопанкреатическое шунтирование (БПШ). В 2013 г. подавляющее большинство метаболических операций, проведенных в мире, было представлено классическим ГШ с формированием межкишечного анастамоза на 30–60 см ниже желудочно-кишечного анастомоза (англ. regular R-en-Y gastricbypass) – 209 352, ПРЖ – 172 320, РБЖ – 46 310 хирургических вмешательств. Около 95% операций проводилось лапароскопическим способом [1].
Эффективность БХВ
Эффективность оперативного лечения ожирения видится впечатляющей в плане снижения веса. Мета-анализ (2009), включивший 621 исследование и 135 246 пациентов, продемонстрировал, что более чем через 2 года после бариатрической операции снижение веса у пациентов в среднем составляет 59%: после РБЖ – 49%, ПРЖ – 56,5%, ГШ – 63%, БПШ в модификации Hess-Marceau – 73,7% [9]. Шведское исследование SOS (Swedish Obese Subjects) включило 2010 пациентов с ожирением, которым было проведено БХВ (376 [19%] – РБЖ, 1369 [68%] – ПРЖ, 265 [13%] – ГШ) и группу сравнения – 2037 больных, находившихся на консервативной терапии ожирения. В исследовании участвовали пациенты в возрасте 37–60 лет, мужчины с ИМТ >34 кг/м2 и женщины с ИМТ > 38 кг/м2. Продолжительность наблюдения за больными варьировалась от 10 до 20 лет. Среднее снижение ИМТ после 2, 10, 15 и 20 лет составило 23, 17, 16 и 18% в группе БХВ и 0, 1, 1 и 1% в группе терапевтического лечения соответственно. По сравнению с консервативным лечением ожирения метаболическая хирургия ассоциировалась со снижением долгосрочной общей смертности (первичная конечная точка, отношение шансов [ОШ]= 0,7), числа случаев СД (ОШ=0,71), инфаркт миокарда (ОШ=0,71), инсульта (ОШ=0,66;) и опухолей различной локализации (ОШ=0,58), а также с увеличением частоты ремиссии СД 2 типа (через 2 года ОШ=8,42, через 10 лет ОШ=3,45). Кроме того, в данном исследовании оценивались затраты на лечение пациентов на протяжении 15 лет. Общие затраты были выше у пациентов без нарушений углеводного обмена в группе БХВ, при этом затраты на хирургическое и консервативное лечение больных преддиабетом и СД 2 типа достоверно не различались. Таким образом, с экономической точки зрения пациенты с сочетанием СД 2 типа и ожирения более предпочтительны для оперативного лечения [10, 11].

Несмотря на столь впечатляющие результаты, последние исследования демонстрируют, что полное излечение СД 2 типа путем хирургического вмешательства остается нереальной целью. Результаты последних мета-анализов свидетельствуют о том, что ремиссия СД 2 типа после БХВ отмечается лишь у 7–42% пациентов, тогда как в более ранних работах говорилось о частоте ремиссии в 80% [9, 12].
Механизмы эффективности БХВ
По мере развития метаболической хирургии к практикующим врачам и исследователям постепенно приходило понимание, что эффективность данного вида лечения определяется не только снижением суточной калорийности пищи за счет уменьшения объема желудка и возникающего синдрома мальабсорбции вследствие ограничения времени контакта химуса с пищеварительными ферментами и уменьшения всасывающей поверхности тонкой кишки. В настоящее время более важным следствием БХВ видится изменение гормонального профиля ЖКТ и количественно-качественного состава микробиома, что ассоциировано с совокупностью положительных эффектов – уменьшением чувства голода и аппетита, снижением тяги к сладкой и жирной пище, уменьшением чувства удовольствия от приема пищи, восстановлением чувствительности рецепторов к лептину и инсулину [13].
Так, исследования головного мозга при помощи магнитно-резонасной томографии показали, что после перенесенной операции у пациентов отмечается меньшая активация участков мозга, обусловливающих возникновение чувства удовольствия после употребления высококалорийной пищи (орбитофронтальной коры головного мозга, амигдалы, хвостатого ядра), что, по всей видимости, опосредуется гормональными влияниями ЖКТ [14].
Известно, что ЖКТ способен оказывать влияние на центральную нервную систему и жировую ткань за счет различных нейроэндокринных механизмов. К основным химическим веществам, попадающим в системный кровоток из ЖКТ и регулирующим обмен веществ, относятся собственно нутриенты, бактериальные метаболиты (короткоцепочечные жирные кислоты, липополисахариды), желчные кислоты и гормоны ЖКТ.
Шунтирование желудка обеспечивает множественные эффекты, связанные с секрецией гастроинтестинальных гормонов. После оперативного вмешательства концентрация грелина сначала уменьшается, а затем нормализуется, гастрина – стабильно уменьшается, соматостатина – не изменяется, а концентрации секретина, холецистокинина, глюкагоноподобных пептидов-1 и -2 (ГПП-1, ГПП-2), глюкозозависимого инсулинотропного пептида (ГИП) и пептида YY стабильно увеличиваются. Изменение уровней вышеописанных веществ обусловливает уменьшение инсулинорезистентности, увеличение постпрандиальной секреции инсулина и изменение пищевого поведения. Основными веществами, определяющими увеличение выработки инсулина поджелудочной железой, в особенности в постпрандиальный период, являются инкретины ГПП-1 и ГИП, концентрация которых после метаболических операций может увеличиваться в 10–20 раз [15].
Многочисленные работы демонстрируют, что изменения в кишечной микрофлоре могут быть ассоциированы с развитием ожирения и других метаболических заболеваний [16].
В экспериментальных моделях на мышах было показано, что кишечный микробиом различен в двух генетически одинаковых линиях мышей с нормальным весом и ожирением, кроме того, трансплантация фекального материала от мышей с ожирением грызунам со стерильным кишечником приводила к статистически значимому увеличению жировой массы и возникновению инсулинорезистентности на фоне неизменной калорийности диеты [16, 17]. Схожие результаты были получены и в немногочисленных исследованиях на человеке: так, фекальная трансплантация от здоровых доноров с нормальной массой тела пациентам с метаболическими расстройствами приводила к увеличению чувствительности к инсулину на фоне роста популяции бутиратпродуцирующих бактерий [18].
В настоящее время установлено, что в плане наличия сопутствующих метаболических осложнений ожирения ведущую роль играет не столько масса жировой ткани, сколько выраженность воспаления в ней и ее метаболическая активность. При увеличении объема жировой ткани в организме воспаление в ней провоцируется происходящими процессами ангиогенеза и продукцией различных факторов роста, привлекающих в жировую ткань иммунокомпетентные клетки; а также ишемией жировой ткани, возникающей из-за несоответствия скорости ее роста скорости ангиогенеза, что в свою очередь также провоцирует возникновение асептического воспаления [19]. Употребление высококалорийной пищи, приводящее к изменению микробного пейзажа кишечника с увеличением количества грамотрицательной флоры и снижением концентрации лакто- и бифидобактерий, может провоцировать повышение уровня липополисахаридов в крови, развитие эндотоксинемии [20]. При этом липополисахариды через антиген CD-14 и tall-like-рецепторы стимулируют макрофаги, увеличивая концентрацию провоспалительных цитокинов, что провоцирует развитие воспаления в жировой ткани, нарастание инсулинорезистентности, стимуляцию липогенеза в печени [21].
Позитивное влияние БХВ на обмен веществ обусловливается в т.ч. и изменениями микробиома пациента.
В настоящее время механизмы данных влияний активно исследуются. Так, после перенесенных операций ГШ у пациентов увеличивается количество водородпродуцирующих и водородпотребляющих бактерий (семейство Prevotellaceae и ряд бактерий группы Firmicutes), что приводит к повышению потребления энергетических субстратов микробиомом, модифицирует экспрессию генов организма хозяина, связанных с гормональной активностью ЖКТ. Увеличение количества бактерий, продуцирующих короткоцепоченые жирные кислоты, в частности бутират, также ведет к увеличению потребления энергии микробиомом, улучшает трофику слизистой оболочки кишечника. Кроме того, именно бутират способен модулировать работу центра голода – насыщения в гипоталамусе – и уменьшать чувствительность периферических тканей к инсулину [22, 23].
Осложнения БХВ и подходы к их лечению
В последнее время на фоне восторженных отзывов об оперативном лечении ожирения по поводу БХВ высказываются и скептические мнения, как правило связанные с возникновением побочных эффектов, в т.ч. серьезных. Установлено, что риск развития серьезных побочных эффектов после БХВ весьма значителен. К их числу относятся нозокомиальная пневмония (ОШ=22), острая почечная недостаточность (ОШ=27), тромбоз глубоких вен нижних конечностей и тромбоэмболии легочной артерии (ОШ=9,4), перитонит или интраабдоминальный абсцесс (ОШ=26,1), возникновение спаек, требующих рассечения (ОШ=5,7), язвы ЖКТ (ОШ=96), желудочно-кишечные кровотечения в течение 4 лет (ОШ=1,7), постоперационные грыжи в течение 4 лет (ОШ=2,2) [24].
В исследовании польских врачей, включившем 408 пациентов, прооперированных в 2009–2015 гг., было продемонстрировано, что различные осложнения развиваются у 7,35% больных, летальность находится на уровне 0,49%, повторные оперативные вмешательства требуются 1,23% пациентов. Среди ранних постоперационных осложнений лидировали рабдомиолиз, тромбоэмболия легочной артерии, разлитой перитонит вследствие несостоятельности анастомоза или кишечной непроходимости. В случае ГШ риск осложнений прямо коррелировал с ИМТ, в случае гастропластики – с количеством наложенных степлеров и с продолжительностью операции [25].
Частым и длительно существующим побочным эффектом шунтирующих операций является демпинг-синдром. В основе его этиопатогенеза лежит быстрое поступление непереваренной, концентрированной, содержащей «быстрые» углеводы пищи в тонкий кишечник. Избыточное механическое, химическое и осмотическое раздражение кишечной слизистой оболочки провоцирует резкое усиление локального кровотока, что снижает перфузию головного мозга. Возникающие гемодинамические изменения обусловливают выброс катехоламинов, дегрануляцию эндокринных клеток АПУД-системы, высвобождение кишечных гормонов – мотилина, нейротензина, энтероглюкагона, ГПП-1, ГПП-2 и ГИП. Избыточное поступление инкретинов в системный кровоток провоцирует выраженную постпрандиальную гиперинсулинемию, что в конечном итоге может вызывать гипогликемию через 1–3 часа после приема пищи. Гипогликемические состояния после БХВ возникают примерно у 1% больных [26].
Для профилактики демпинг-синдрома после выписки из стационара пациент должен в течение 2–3 недель получать жидкие продукты питания (каши, супы, блендированные блюда), а затем постепенно в рацион добавляются твердые продукты. В первый месяц суточный калораж пищи должен находиться на уровне 400–800 ккал, преимущество отдается продуктам, имеющим низкий гликемический индекс: фруктам, овощам, салатам. Количество белка в рационе должно быть на уровне 1–1,5 г/кг/сут. Пищу следует потреблят медленно, при появлении минимального чувства насыщения прием пищи необходимо завершить.
Частым следствием БХВ является развитие гиповитаминозов, водно-электролитных расстройств, гипопротеинемии. В основе этиопатогенеза данных осложнений лежат явления мальабсорбции и мальдигестии, избыточный бактериальный рост в отключенном участке кишки, гипермоторика кишечника за счет контакта с агрессивным химусом.
Недостаточность витаминов и микроэлементов не возникает после БХВ de novo, поскольку пациенты с ожирением исходно имеют такого рода проблемы. Так, у лиц с ожирением исходная недостаточность белка отмечается в 16% случаев, железа – в 44–50%, витамина С – в 36%, витамина D – в 25–80%, витамина А – в 12,5%, витамина Е – в 23%, цинка – в 28%, витамина В1 – в 15–29%, витамина В12 – в 18%, фолиевой кислоты – в 6% [27–29].
Информация о недостаточности основных витаминов, микроэлементов, протеина после БХВ представлена в табл. 1.
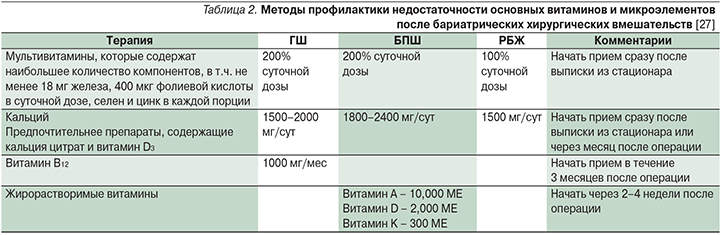
Высокая частота недостаточности витаминов и микроэлементов после БХВ однозначно требует профилактического назначения витаминно-минеральных комплексов. Подходы к профилактике недостаточности микроэлементов и витаминов представлены в табл. 2.
Частыми гастроэнтерологическими симптомами после бариатрического лечения являются тошнота и рвота.
К препаратам выбора в данном случае относятся прокинетики и ингибиторы протонной помпы (ИПП) [32]. При резистентности симптомов к проводимой терапии необходимо проведение компьютерной томографии и эндоскопического обследования верхних отделов ЖКТ для исключение органической патологии. В некоторых случаях тошнота и рвота после перенесенного оперативного лечения имеют психологическую природу, что требует применения антидепрессантов [33, 34].
В ряде работ было продемонстрировано, что пациенты после перенесенных БХВ имеют повышенный риск возникновения НПВС-индуцированного поражения верхних отделов ЖКТ, что требует более осторожного применения нестероидных противовоспалительных средств такими больными [35].
Необходимо помнить, что БХВ оказывают выраженное влияние на течение гастроэзофагеальной рефлюксной болезни (ГЭРБ). Как правило, после ГШ и РБЖ потребность в ИПП значимо уменьшается, тогда как после ПРЖ потребность в ИПП может возрастать. В случае нарастания интенсивности изжоги после гастрошунтирующих операций, в особенности на фоне снижения веса, необходимо исключить образование фистулы между сформированным малым желудком и культей желудка, в норме связанной с просветом ЖКТ лишь через приводящую петлю тощей кишки. Для исключения данного осложнения требуется проведение рентгенологического исследования верхних отделов ЖКТ с барием или компьютерная томография.
В ряде работ продемонстрировано, что изжога, возникающая после метаболических хирургических операций, часто ассоциирована с резистентностью к ИПП, что требует применения дополнительных фармакологических и нефармакологических методов коррекции данного симптома [36–38].
Заключение
С учетом роста заболеваемости ожирением в XXI в., неудовлетворительной эффективности медикаментозного лечения данного страдания применение хирургических методов коррекции ожирения, по всей видимости, будет увеличиваться. Несмотря на высокую эффективность метаболической хирургии, данная методика сопряжена с повышенным риском развития широкого спектра осложнений, многие из которых связаны с органами ЖКТ, что, безусловно, требует ведения таких пациентов врачами терапевтических специальностей, в частности гастроэнтерологами. Необходимо отметить, что из-за относительно недавнего начала широкого применения хирургических методов коррекции ожирения четкие подходы к терапии коморбидных заболеваний (ГЭРБ, НПВС-индуцированные поражения ЖКТ, демпинг-синдром) недостаточно разработаны. Изучение механизмов положительного влияния БХВ демонстрирует важную роль ЖКТ в патогенезе ожирения. Дальнейшие исследования микробиома, инкретинового профиля у пациентов с ожирением, в т.ч. и после хирургического лечения, возможно, позволит разработать новые эффективные фармакологические методы лечения данного заболевания.


