Хроническая ишемия мозга (ХИМ) – особая разновидность сосудистой церебральной патологии, обусловленная медленнопрогрессирующим диффузным нарушением кровоснабжения головного мозга с постепенно нарастающими разнообразными дефектами его функционирования [1, 2]. Важно уметь поставить этот диагноз не только неврологу, но и врачу общего профиля. При этом основной проблемой является сложность выявления неврологических проявлений ХИМ у многих пациентов с соматической патологией.
Понимание патогенеза ХИМ необходимо для адекватной, оптимально подобранной стратегии лечения. Изучение функционально-энергетического статуса клетки в условиях патологии определяет поиск методов лекарственного воздействия на клеточный энергетический потенциал с использованием препаратов, воздействующих на различные звенья развития патологического процесса. Правильный выбор препарата для начальной терапии всегда сложен для врача-интерниста. Обычно он основывается на личных предпочтениях, в то же время практически всегда игнорируется патогенетический подбор фармтерапии. В результате большинство таких пациентов остаются без оптимальной медикаментозной терапии на начальных стадиях заболевания. Особенно, когда речь идет о пациентах старшего возраста. Это обусловлено наличием сопутствующей соматической патологии, требующей назначения двух и более лекарственных средств различными механизмами действия, что приводит к появлению ряда негативных моментов, таких как [3, 4]:
- «перекрещивание» путей биотрансформации препаратов в организме, что приводит к усилению или ослаблению их действия и как следствие – к росту числа негативных эффектов и неконтролируемости клинического ответа;
- потенцирование имеющихся побочных эффектов отдельных лекарств с усилением их токсического действия, прежде всего на желудочно-кишечный тракт, печень, почки и головной мозг;
- возможность возникновения новых побочных эффектов;
- трудность выбора адекватного дозового режима, связанного с необходимостью более низкой дозировки препарата и увеличением длительности терапии;
- значительное удорожание процесса лечения.
В связи с вышеизложенным не подвергается сомнению необходимость оптимизации выбора терапии с учетом возрастных особенностей. Если целью лечения молодых пациентов является максимальное восстановление нарушенных функций, то для пациентов пожилого и старческого возраста – уменьшение выраженности симптоматики и компенсация нарушенных функций, а также профилактика дальнейшего прогрессирования патологического процесса [5].
Физиологические процессы старения организма приводят к изменению фармакокинетики и фармакодинамики лекарственных средств [6]. У лиц пожилого возраста для большинства препаратов практически все фармакокинетические процессы протекают замедленно, в связи с чем наблюдается повышение количества свободных препаратов в кровеносном русле. При ухудшении условий доставки фармпрепаратов к тканям число специфических рецепторов уменьшается, но их чувствительность к медикаментозному воздействию увеличивается и извращается. Извращенным реакциям на препараты способствуют сниженная физическая активность, меньшее потребление пищи и воды, склонность к запорам, витаминная недостаточность, ухудшение кровоснабжения тканей и относительное преобладание возбудительных процессов нервной системы старых людей [7]. По этим причинам пожилые больные для достижения необходимого терапевтического эффекта обычно нуждаются в меньшем количестве лекарств. По достижении клинического эффекта дозу многих препаратов уменьшают, определив поддерживающую, которая, как правило, ниже, чем для лиц среднего возраста. В то же время не следует забывать, что фармакотерапевтическое воздействие при любой форме ишемического поражения мозга должно быть максимально комбинированным и направленным не только на восстановление нормального кровотока в пораженном участке, но и на устранение «ишемического каскада» – комплекса нейрометаболических, нейромедиаторных, нейротрофических и других реакций, определяющих развитие дегенеративно-деструктивных изменений в нейронах, и в итоге формирование неврологического дефицита. В последние годы список показаний к использованию лекарственных средств значительно расширился, однако сложность и многокомпонентность нарушений мозгового метаболизма, а также ограничение экстраполяции экспериментальных данных в клиническую практику обусловливают неоднозначность мнений о нейропротекторной и метаболически активной терапии пожилых пациентов. Несомненно, данное направление является одним из ключевых, наиболее перспективным и в то же время наиболее сложным. Поиск «идеального препарата» еще далек до завершения, поэтому в клинической практике комбинированно назначают два или несколько лекарственных средств, базовыми препаратами являются антиоксиданты, к которым в зависимости от тех или иных клинических проявлений добавляются препараты других классов [8]. Следовательно, задача современной медикаментозной терапии – не только отыскать эффективные и безопасные препараты, но и изучить их различные комбинации, прежде всего комбинации препаратов с разнонаправленными механизмами действия. Поэтому применение комбинированных схем лекарственных средств в геронтологической практике должно основываться на тщательном анализе соответствия клинико-фармакологических эффектов конкретного препарата и клинической картины у конкретного пациента, возраста, наличия сопутствующей патологии и т.д.
Для успешного решения этой задачи необходимо сконцентрировать внимание на следующих особенностях геронтологических больных:
- В основе физиологических возрастных изменений лежат нарушения метаболических процессов, связанные с гормональной перестройкой и энергодефицитом в организме в целом, влекущие за собой развитие регионарной ишемии с явлениями оксидантного стресса [9]. Окислительно-восстановительные реакции протекают в митохондриях, обеспечивающих клетки энергией. Число митохондрий в одной клетке от единиц до нескольких тысяч. Митохондрии найдены во всех клетках организма человека, но их размер, число и форма в разных клетках различны. Патологические процессы в клетках, старение и связанное с ним изменение метаболизма приводят к изменению этих характеристик митохондрий. Накопление повреждений в результате этого процесса приводит к возраст-зависимому повреждению тканей, местному воспалению, канцерогенезу и наконец к старению, поэтому у пациентов пожилого возраста всегда присутствует дефицит собственных антиоксидантных систем с ранним проявлением постгипоксических изменений в виде когнитивных расстройств.
- Когнитивные расстройства при сосудистой мозговой недостаточности являются самыми ранними проявлениями ХИМ, которые наряду с аффективными и двигательными нарушениями имеют большое значение в снижении социальной адаптации и качества жизни у лиц пожилого возраста [10].
- Возможности восстановления утраченных функций у пациентов пожилого возраста значительно снижены из-за дисфункции нейропластических процессов, нарушения синаптической передачи и дестабилизации клеточных мембран [11–13].
- Согласно данным демографических исследований, население планеты стремительно стареет, наиболее быстро растет часть общей популяции людей старше 65 лет. Следовательно, можно ожидать, что частота заболеваний, ассоциирующихся с возрастом, таких как инсульт, деменция, коморбидных с соматической и кардиоваскулярной патологиями, возрастет. Обязательным условием лечения при этом является одновременная коррекция у пациентов метаболического, медиаторного и оксидативного дисбалансов.
Таким образом, терапевтическая стратегия лечения ХИМ у пожилых пациентов должна быть оптимизирована за счет одновременной активной коррекции церебральной перфузии, системной гемодинамики, энергетического метаболизма и нейромедиаторных нарушений.
Самой частой комбинацией в неврологической практике является схема: антиоксидант-нейромедиаторный препарат. Более подробно остановимся на положительных аспектах этой схемы. Для начала необходимо ответить на вопрос: что такое антиоксидантные препараты и есть ли преимущества у отечественных лекарственных средств перед зарубежными?
Антиоксиданты (антиокислители) – природные или синтетические вещества, замедляющие или предотвращающие окисление органических соединений.
Зарубежные ферментные антиоксиданты, созданные на основе супероксиддисмутазы, выделяемой из природного материала (онтосеин, оксодрол, пероксинорм), имеют существенные недостатки: нестабильны, быстро инактивируются и имеют много побочных эффектов, в результате чего имеют ограничения для использования в клинической практике.
Препараты, производные янтарной кислоты (ЭМГПС – этилметилгидроксипиридина сукцинат), торговые названия: Мексидол, Нейрокс, имеют широкий спектр фармакологической активности, обладают способностью стабилизировать мембраны. В отличие от препаратов экзогенной янтарной кислоты остатки пиридина и сукцината в качестве энергетических субстратов облегчают проникновение молекулы в клетку, имеют минимальное число побочных эффектов, безопасны и удобны в применении, производятся в России. Согласно инструкции, являются антиоксидантами, оказывающими антигипоксическое, мембранопротекторное, ноотропное, противосудорожное и анксиолитическое действия. Механизм действия ЭМГПС обусловлен антиоксидантным и мембранопротекторным действиями. Они стимулируют прямое окисление глюкозы по пентозо-фосфатному шунту, повышют уровень пула восстановленных нуклеотидов (НАДФН), тем самым усиливая антиоксидантную защиту клетки, стабилизируя уровень эндогенных антиоксидантов. При применении ЭМГПС происходит активация сукцинатоксидазного пути окисления, которая в условиях ограничения НАД-зависимого окисления на ранних стадиях гипоксии позволяет сохранить в митохондриях определенный уровень окислительного фосфорилирования. Активация сукцинатоксигеназного пути окисления при гипоксии способствует повышению резистентности клеток мозга, миокарда, печени к дефициту кислорода и определяет механизм антигипоксического действия сукцинатсодержащих производных оксипиридина.
Сукцинаты ингибируют перекисное окисление липидов, повышают активность супероксидоксидазы и соотношение липид–белок, уменьшают вязкость мембраны, увеличивая ее текучесть. Происходит модуляция активности мембраносвязанных ферментов (кальцийнезависимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового), что усиливает их способность связывания с лигандами, способствует сохранению структурно функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Производные янтарной кислоты повышают содержание в головном мозге дофамина, вызывают усиление компенсаторной активации аэробного гликолиза и снижение степени угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий, стабилизацию клеточных мембран. Свои фармакологические эффекты сукцинаты реализуют на трех уровнях: нейрональном, сосудистом и метаболическом. За счет сочетания в структуре пиридинового основания и янтарной кислоты обладают высокой способностью прохождения гематоэнцефалического барьера и биодоступностью.
Этилметилгидроксипиридин сукцинаты разрешены для широкого медицинского применения в лечении острых нарушений мозгового кровообращения, энцефалопатии различного генеза (гипертонической, атеросклеротической, травматической и т.д.), невротических и неврозоподобных расстройств с проявлением тревоги, для купирования абстинентного синдрома при алкоголизме, для лечения острой интоксикации нейролептиками и ряда других заболеваний. Производные янтарной кислоты обладают выраженным стрессопротекторным действием, которое проявляется в нормализации постстрессового поведения, соматовегетативных нарушений, восстановлении циклов «сон–бодрствование», нарушенных процессов обучения и памяти, снижении дистрофических изменений в различных структурах головного мозга. Включены в федеральное руководство по использованию лекарственных средств [13].
Существенным преимуществом сукцинатов является то, что они имеют незначительные побочные эффекты и низкую токсичность. При совместном использовании усиливают действие бензодиазепиновых анксиолитиков, противоэпилептических, противопаркинсонических (леводопа) лекарственных средств, нитратов, не влияют на состояние системной гемодинамики. Изучение побочных эффектов ЭМГПС показало отсутствие угнетающего или стимулирующего действия на спонтанную двигательную активность, изменения координации движений, ориентировочно-исследовательского поведения, ректальную температуру, корнеальный и пиннеальный рефлексы, препараты не вызывают сонливости, сохраняется адекватность реагирования животных на провоцирующие тест стимулы, не нарушаются простые рефлексы даже в верхнем диапазоне терапевтических доз. При увеличении средней терапевтической дозы в 4–5,5 раза препараты не оказывают миорелаксантного действия, при использовании в сверхвысоких дозах не ухудшается память, а наоборот, проявляется атиамнестическое действие [14]. В противоположность ряду других ноопропных препаратов при использовании ЭМГПС не наблюдается активирующего действия, нарушений сна и повышения судорожной готовности. Кроме того, по своей эффективности они значительно превосходят пирацетам. По сравнению с транквилизаторами бензодиазепинового ряда (диазепам, хлордиазепоксид, оксазепам, лоразепам, бромдигидрохлорфенилбензодиазепин и др.) не обладают миорелаксантным действием даже в дозах, превышающих среднюю терапевтическую анксиолитическую дозу в 4–5,5 раза и не вызывают таких проявлений, как нарушение координации движений, снижение мышечного тонуса и мышечной силы, не оказывают седативного и амнезирующего действий, а наоборот, обладают позитивным влиянием на память, особенно в условиях нарушения когнитивных функций. При длительном введении и/или прекращении применения не возникает синдром отмены, характерный для бензодиазепиновых транквилизаторов. Применение ЭМГПС имеет дозозависимый характер. С повышением дозы до определенного уровня наблюдается, как правило, усиление действия. Диапазон терапевтических доз достаточно широк и в эксперименте колеблется от 10 до 300 мг/кг. С повышением дозы уменьшается латентный период наступления и увеличивается выраженность и длительность эффекта.
Сравнительных исследований эффективности препаратов этого класса крайне мало, поэтому особого внимания заслуживает открытое сравнительное контролируемое исследование продолжительностью 15 дней 60 пациентов обоего пола с подтвержденным диагнозом «дисциркуляторная энцефалопатия» (ДЭ) 1–2-й степеней в возрасте от 45 до 68 лет [15]. Включенные в исследование пациенты случайным методом были разделены на 2 группы: 1-я (основная) группа (препарат Нейрокс): 30 человек (7 мужчин и 23 женщины) с ДЭ 1–2-й степеней, средний возраст – 52,5 года; 2-я (контрольная) группа (препарат Мексидол): 30 человек (4 мужчины и 26 женщин) с ДЭ 1–2-й степеней, средний возраст –51,5 года. Статистически значимых различий между группами по полу и возрасту не было. Выявлено положительное влияние препаратов двух исследуемых групп на окислительный потенциал липопротеидов низкой плотности (ЛПНП), а именно – уменьшение предрасположенности к окислительным процессам ЛПНП in vivo под влиянием обоих препаратов, повышение содержания в ЛПНП липофильных антиоксидантов α-токоферола и β-каротина. Зафиксирована сопоставимая терапевтическая эквивалентность воспроизведенного и оригинального препаратов.
Нейрокс (ЗАО «ФармФирма «Сотекс») зарекомендовал себя как эффективное, безопасное средство, улучшающее не только метаболизм и кровоснабжение головного мозга, микроциркуляцию и реологические свойства крови, уменьшающее агрегацию тромбоцитов, но и метаболические процессы в ишемизированном миокарде: восстанавливает и/или улучшает электрическую активность и сократимость миокарда, а также увеличивает коронарный кровоток в зоне ишемии, повышает антиангинальную активность нитратов, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности [16, 17].
Таким образом, с учетом возможных лекарственных взаимодействий можно рекомендовать ЭМГПС как средство базовой терапии цереброваскулярных заболеваний (для нормализации метаболизма и энергетики ишемизированных клеток мозга.
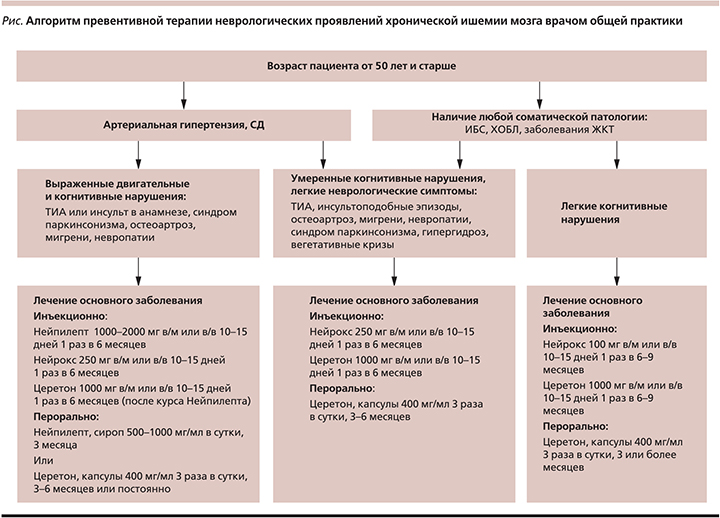
Пациентам пожилого возраста препарат назначают в суточной дозе 250 мг внутримышечно в течение 14 дней один раз в 6 месяцев. У пациентов с минимально выраженными проявлениями цереброваскулярных заболеваний в качестве превентивной терапии рекомендованы курсы препарата в дозе 100 мг внутримышечно в течение 14 дней один раз в 6 месяцев (рисунок). Следует особо отметить тот факт, что эти дозы не оказывают влияния на системную гемодинамику, не требуют коррекции дозы антигипертензивных препаратов, совместимы практически со всеми лекарственными препаратами и не требуют снижения дозы у пожилых пациентов.
При любом поражении головного мозга происходит резкое снижение содержания фосфолипидов в мозге, причем лимитирующими звеньями в этом процессе служат как ослабление биосинтеза, так и усиление деградации фосфатидилхолина за счет активации ведущего фермента катаболизма фосфолипидов — фосфолипазы А2 [18]. Роль фосфолипидов в головном мозге чрезвычайно велика. Они формируют структурно-функциональную основу нейрональных мембран, обеспечивающих деятельность нервных клеток и мозга в целом (поддержание ионного баланса и активности мембраносвязанных ферментов, обеспечение проведения нервного импульса и др.), являются важной составляющей липопротеидов крови и необходимы для образования и функционирования большинства из них, их отсутствие или недостаток индуцирует серьезные нарушения транспорта холестерина. При потере мембраной своих жидкостных свойств такой транспорт сразу нарушается. Холестерин и насыщенные жирные кислоты делают мембрану твердой, ригидной, маловосприимчивой. Фосфолипиды с ненасыщенными жирными кислотами, наоборот, повышают текучесть и чувствительность мембран, улучшают проницаемость. Соотношение холестерин/фосфолипиды с возрастом, как правило, увеличивается в пользу холестерина. Это рассматривают как один из факторов старения организма, поскольку мембраны становятся жесткими и хуже начинают реагировать на гормональные и другие сигналы. Поступление дополнительных количеств фосфолипидов в организм способно «омолаживать» клеточные мембраны. Кроме фосфолипидов и холестерина в мембрану также встроены различные белки, которые являются рецепторами для гормонов, ферментов, биологически активных веществ. Нормальное функционирование этих белков напрямую зависит от окружающих их фосфолипидов. В последние годы изучена роль фосфолипидов в процессах гемокоагуляции. Внутрисосудистое фибринообразование характеризуется глубокими расстройствами биохимии свертывающей системы крови с одновременными нарушениями количественных соотношений между нейтральными и кислыми категориями фосфолипидов (НФЛ и КФЛ соответственно) [19]. Процесс трансформации фибриногена в фибрин, сопровождающийся уменьшением количественного содержания КФЛ и возрастанием уровня НФЛ, вносит существенные сдвиги в соотношения между указанными группами фосфолипидов. Он характеризуется в каждом конкретном случае их про- и антикоагулянтной активностью. Это может проявляться стимулирующим или ингибирующим действием указанных соединений на протромбиновое время, тромбопластическую активность, время свертывания крови, количество фибриногена и фибринолитическую активность.
В условиях ишемии значительно ослабляется физиологический механизм синтеза эндогенного CDP-холина за счет нарушения энергетического метаболизма и дефицита макроэргических соединений, поэтому необходима своевременная коррекция этого медиатора [24]. Сегодня этот механизм рассматривается как один из ведущих нейрохимических механизмов старения мозга и основной компонент поражения нейронов при различных формах цереброваскулярной патологии. При несвоевременной коррекции деструкция структурно-функциональных компонентов нейрональных мембран становится необратимой. Таким образом, приоритетно назначение препаратов, влияющих на фосфолипиды и продукты их метаболизма. Использование на этом этапе химически синтезированных, чужеродных лекарственных средств потребует дополнительного назначения других медикаментов.
В то же время естественные метаболиты биохимических процессов в организме даже при монотерапии позволяют уже на ранних стадиях заболевания уменьшить прогрессирование процесса и предотвратить дальнейшую дегенерацию нейрона.
С этой точки зрения несомненный интерес представляют данные об использовании цитиколина – лекарственного средства, широко изученного при различных формах цереброваскулярной патологии в странах Западной Европы, США и Японии в течение последних 30 лет [20]. Особое место занимает изучение плейотропных эффектов препарата, его воздействия не только на причины повреждения ишемизированной ткани мозга, но и на процессы восстановления структуры и функций нервной ткани за счет нейропротекторных и нейрорепаративных эффектов и увеличения пластичности нейронов. Препарат имеет большую доказательную базу: общее число пациентов, включенных в различные исследования его эффективности, составляет около 12 тыс. Цитиколин (цитидин 5’–дифосфохолин или ЦДФ–холин) представляет соединение, которое в норме присутствует во всех клетках человеческого организма, является естественным метаболитом биохимических процессов в организме, т.е. не является чужеродным химическим соединением – ксенобиотиком, как большинство лекарственных средств, состоит из цитидина и холина, связанных дифосфатным мостиком, и является необходимым промежуточным соединением в синтезе фосфатидилхолина, основного мозгового фосфолипида, в пути синтеза фосфолипидов (путь Кеннеди), уменьшает потерю фосфатидилхолина, входящего в состав клеточной мембраны. Препарат, являясь источником холина, участвует в синтезе нейромедиатора ацетилхолина, стимулирует активность тирозингидроксилазы и секрецию дофамина. В экспериментах цитиколин снижал нейронную дегенерацию в гиппокампе крыс, вызванную инъекцией β-амилоидного белка [21]. β-амилоид (β-amyloid) является нормальным белком организма. Он образуется в результате протеолитического процессинга из своего предшественника, названного предшественником β-амилоида (ПБА), экспрессирующегося фактически во всех изученных к настоящему времени животных клетках. Степень когнитивных расстройств прямо пропорциональна его накоплению. Холин в сочетании с цитидином стимулирует секрецию нормального нейротрофного амилоидного белка-предшественника мозговыми клетками крыс. Цитиколин способен снижать отложение β-амилоида в головном мозге, что клинически проявляется в улучшении интегральных показателей когнитивных функций. С учетом этих данных проведено большое количество клинических исследований оценки эффективности цитиколина в лечении когнитивных расстройств, связанных со старением головного мозга, цереброваскулярными заболеваниями и деменцией. Кроме воздействия на β-амилоид нейропротекторное действие цитиколина, вероятно, обусловлено перераспределением основного транспортера глутамата EAAT2 в микродомены липидных рафтов, приводящим к повышению усвоения глутамата [22]. Цитиколин приводит к мобилизации эндотелиальных прогениторных клеток из костного мозга у пациентов с инсультом, тем самым улучшая функциональное восстановление после острого ишемического инсульта. Таким образом, увеличение содержания эндотелиальных прогениторных клеток в периферической крови, индуцированное лекарственным средством, ассоциировано с лучшим функциональным исходом у пациентов, перенесших острый ишемический инсульт [23]. Цитиколин при экзогенном введении (как пероральном, так и внутривенном) обладает 100%-ной биодоступностью. Его содержание в плазме крови после перорального приема имеет два пика: один – через час после приема, второй –через 24 часа. Применение цитиколина в течение первых 24 часов от момента появления симптомов инсульта с последующим непрерывным применением в течение 6 месяцев является безопасным и демонстрирует эффективность в отношении профилактики развития сосудистых когнитивных нарушений после инсульта по сравнению с плацебо [24].
Относительно недавно в клинической практике стал использоваться препарат Нейпилепт фирмы «Сотекс», Россия. Этот цитиколин производится из итальянской субстанции и имеет все формы, как и оригинальный препарат, а именно: растворы для внутривенного и внутримышечного введения, питьевые формы для приема внутрь. Проведенное открытое сравнительное многоцентровое рандомизированное исследование эффективности и безопасности применения Нейпилепта и Цераксона у больных в остром периоде ишемического инсульта в каротидной системе продемонстрировало безопасность, переносимость и эффективность препаратов цитиколина у 152 пациентов в остром периоде ишемического инсульта, которое подтвердило сопоставимое клиническое действие воспроизведенного препарата с оригинальным. Результаты двойного слепого плацебо-контролируемого многоцентрового рандомизированного исследования эффективности и безопасности препарата Нейпилепт раствора для приема внутрь 100 мг/мл у пациентов с когнитивными нарушениями убедительно доказали более высокую эффективность препарата по сравнению с плацебо. В исследовании принимали участие 122 пациента (средний возраст – 55,9 года) с когнитивными нарушениями, выявленными при нейропсихологическом тестировании. Все больные имели сопутствующую коморбидную патологию (ишемическая болезнь сердца, сахарный диабет, артериальная гипертензия, ХИМ). Выводы исследователей об отсутствии побочных эффектов и совместимости с другими лекарственными средствами на фоне высокой клинической эффективности дают право рекомендовать его для применения в общетерапевтической практике.
Медикаментозная коррекция мембранной деструкции протекает с большими затратами энергии, как правило, через 1 месяц активной нейрометаболической терапии организм не в состоянии поддерживать нормальный энергобаланс. А как уже отмечалось выше, первопричиной неврологических нарушений при заболеваниях является гипоксия и энергодефицит, поэтому в комплексную терапию рекомендуется вводить лекарственные средства, способствующие улучшению утилизации органами и тканями кислорода и приводящие к снижению потребности в кислороде, такие как ЭМГПС.
Нейпилепт является лекарственным средством первой линии у пациентов пожилого возраста, имеющих коморбидные состояния (артериальная гипертензия, сахарный диабет), с двигательными и когнитивными постинсультными нарушениями, болезнью Паркинсона. Его назначают в суточной дозе 1000 мг/сут внутримышечно или внутривенно в течение 10–15 дней один раз в 6 месяцев. У пациентов с коморбидными состояниями плюс когнитивные нарушения возможен переход или начало терапии пероральными формами в дозе 100 мг/мл в течение 1–3 месяцев. Возможно, необходимо сочетать с антиоксидантом или применять в монотерапии более длительно – до 6 месяцев, отдавая предпочтение формам для приема внутрь.
Холина альфосцерат (Глиатилин, Церетон) – соединение, содержащее 40% холина и превращающееся в организме в метаболически активную форму – фосфорилхолин, способный проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [25]. С учетом механизма его действия холина альфосцерат был отнесен к парасимпатомиметикам центрального действия. Препарат, являясь донором холина, увеличивает синтез ацетилхолина, что в свою очередь оказывает положительное воздействие на нейротрансмиссию.
С другой стороны, глицерофосфат участвует в синтезе фосфатидилхолина (мембранного фосфолипида). В настоящее время установлены три основных механизма нейропротективного действия холина альфосцерата:
- являясь донором ацетилхолина, способствует восстановлению межнейронных связей и холинергической нейротрансмиссии;
- участвует в репарации нейрональных мембран;
- оказывает метаболотропное действие, связанное с уменьшением дегенерации свободных жирных кислот [26].
Холина альфосцерат противодействует биохимическому и функциональному дефициту холинергической системы, подвергшейся влиянию ишемии, что обосновывает его применение при острых нарушениях мозгового кровообращения. Другим механизмом его действия является анаболический эффект, проявляющийся в стимуляции мембранного и глицеролипидного синтеза вследствие образования предшественников фосфолипидов мембран из продуктов его метаболического распада. В экспериментах на животных показано, что препараты этого ряда предупреждают индуцированный холинергический дефицит, предотвращают развитие деменции, облегчают процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [27]. В большинстве работ подчеркивается эффективность и дозозависимость терапевтического воздействия холина альфосцерата. Мета-анализ F. Amenta (2010) применения холина альфосцерата [28] доказал высокую эффективность препарата в отношении когнитивной дисфункции и продемонстрировал крупнейшую доказательную базу среди всех предшественников холина. Отечественный препарат Церетон в ряде исследований подтвердил терапевтическую эквивалентность оригинальному препарату, что позволило рекомендовать его в клиническую практику без ограничений у пациентов пожилого возраста [29].
У пациентов пожилого возраста с легкими когнитивными нарушениями Церетон назначают в суточной дозе 1000 мг/сут внутримышечно или внутривенно в течение 10–15 дней один раз в 6 месяцев с последующим переходом на прием внутрь по 400 мг три раза в сутки 3–6 месяцев. Возможно, необходимо добавлять к терапии цитиколином после завершения курса последнего у пациентов в постинсультном периоде в дозе 400 мг три раза в сутки более длительно (6 месяцев).
Заключение
Суммируя вышеизложенное, можно с уверенностью заявлять, что препараты нейромедиаторного, нейрометаболического действий являются средством первой линии для лечения пациентов с ХИМ.
Однако у практических врачей очень часто эти лекарственные средства вызывают наибольшее число вопросов:
- аналогичные ли это препараты;
- если нет, то в чем различия;
- можно ли заменить один другим;
- надо ли их применять совместно;
- безопасны ли эти схемы для пациентов?
Ответ на эти вопросы кроется в анализе механизмов нейропротекторного действия препаратов.
Нельзя ставить знак равенства между препаратами: принципиальным отличием холина альфосцерата является способность нормализовать уровень ацетилхолина в острой ситуации, он обладает выраженным пробуждающим эффектом у пациентов в коматозных состояниях, главные же нейропротекторные свойства цитиколина заключаются в сохранении и наружных, и внутренних нейрональных мембран [30, 31]. Поэтому для усиления соответствующих эффектов этих препаратов, по-видимому, имеет смысл применять их в комплексе. Наиболее эффективно комплексное последовательное введение холинергических препаратов с различными преимущественными нейропротективными эффектами с первых часов пребывания в стационаре. Выбор первоочередного назначения холинергических препаратов для пациентов с ХИМ должен быть патогенетически обоснован с учетом нарушений функционирования модулирующих субсистем активации головного мозга, предикторами которых являются возраст пациента, уровень сознания, наличие соматической патологии, нарушения мозгового кровообращения в анамнезе, когнитивные нарушения.
Цитиколин в первую очередь следует рассматривать в качестве универсального мембранопротектора, способного сохранять каркасные и матричные свойства биологических мембран у пациентов с тяжелой соматической патологией в острый и восстановительный периоды острого нарушения мозгового кровообращения и черепно-мозговой травмы с выраженным двигательным дефицитом, у пациентов с болезнью Паркинсона, гипертонической энцефалопатией с выраженными когнитивными нарушениями.
В течение определенного времени запасы холина для синтеза ацетилхолина-медиатора могут поддерживаться за счет гидролиза фосфотидилхолина фосфолипазами. Однако снижение концентрации Ptd-Chol приводит к гибели холинергического кластера, что сопровождается резким снижением эндогенного ацетилхолина. Эта биохимическая констелляция получила название «аутоканнибализм» фосфотидилхолина [32]. Следовательно, необходимо усиление холинергического действия за счет использования препаратов донаторов холина: холина альфосцерата.
Другая очередность использования препаратов у пациентов с менее выраженными клиническими проявлениями: начало терапии проводится холином альфосцератом, т.к. на первое место выходят клинические проявления в виде дефицита ацетилхолина (забывчивость, импульсивность, изменения настроения и т.д.), поэтому холина альфосцерат следует рассматривать в качестве нейромедиаторного препарата, стимулирующего холинергическую нейротрансмиссию у пациентов с легкими когнитивными нарушениями [33].
Очевидно, что оптимизация выбора нейропротективной терапии пожилых пациентов с ХИМ базируется на понимании механизма действия лекарственных веществ. Эффективность лекарственного средства определяется с позиций доказательной медицины и выражается в уменьшении клинических проявлений заболевания и улучшении качества жизни больного. В то же время врачу следует помнить, что при учете общих закономерностей назначения лечения необходим индивидуальный подход к каждому пациенту с учетом возраста, пола, анамнеза, сопутствующих заболеваний, особенностей метаболизма и гемодинамики.



