Введение
Болезнь Паркинсона (БП) – хроническое прогрессирующее заболевание головного мозга с дегенерацией нигростриарных нейронов и нарушением функции базальных ганглиев [3, 17]. При БП характерны нарушения двигательной сферы в виде сочетания гипокинезии с ригидностью, тремора покоя и постуральной неустойчивости. Однако кроме моторных нарушений в клинической картине БП присутствуют и немоторные проявления. Широкий спектр немоторных расстройств выявляется на всех стадиях болезни Паркинсона. Большинство из них развивается и нарастает по мере прогрессирования заболевания параллельно усугублению двигательных расстройств, некоторые приобретают доминирующее клиническое значение, оказывая негативное влияние на качество жизни пациентов, приводя к инвалидизации и сокращая продолжительность жизни [16].
К числу наиболее частых немоторных расстройств относятся нарушения познавательных (когнитивных) функций, таких как память, внимание, интеллект, гнозис, речь, праксис [5, 8]. В типичных случаях начальные проявления болезни Паркинсона в возрасте 50–70 лет сопровождаются недементными (субъективными и легкими или умеренными) когнитивными расстройствами, которые проявляются в виде снижения внимания, ограничения способности к запоминанию [3, 9, 15, 17]. Определение “умеренного когнитивного расстройства” включает жалобы на снижение памяти или повышенную утомляемость при умственной работе; объективные свидетельства снижения памяти, внимания или способности к обучению; уровень нарушений является недостаточным для диагностики деменции; когнитивные нарушения должны иметь органическую природу [6, 7, 8, 12].
Умеренные когнитивные нарушения (УКН) имеют тенденцию к прогрессированию в связи с прогредиентным течением БП и чаще всего достигают стадии деменции через 5 и более лет после появления первых двигательных расстройств, что приводит к снижению профессиональных способностей, социальной и бытовой адаптации [9, 10, 13]. Выявление когнитивных расстройств на недементных стадиях при проведении нейропсихологического тестирования больных БП требует проведения адекватной терапии для уменьшения риска и скорости развития деменции и улучшения функциональной адаптации, способствующей повышению качества жизни [1, 12].
Общепринятых стандартов УКН не существует. По литературным данным, на недементных стадиях когнитивных расстройств применение ацетилхолинергических препаратов ведет к противоречивым результатам. Как известно, они эффективны при лечении деменции, но, очевидно, менее тяжелые когнитивные нарушения в большей степени обусловлены дисфункцией со стороны других нейротрансмиттерных систем [12]. Одним из приоритетных направлений терапии синдрома УКН является нейропротекторная терапия, теоретически способная замедлить их прогрессирование. Цитидин-5-дифосфохолин (цитиколин), состоящий из цитидина и холина, представляет собой нейропротективное средство нового поколения, эффективность и безопасность которого подтверждены многими рандомизированными плацебо-контролируемыми исследованиями. Нейропротекторный эффект цитиколина определяется нейромедиаторными и нейрометаболическими механизмами его действия [2]. Широкий спектр фармакологической активности препарата, в т. ч. и ноотропные свойства, послужили причиной для назначения цитиколина пациентам с БП с целью улучшения когнитивных функций.
В данном исследовании проведена оценка клинической эффективности и переносимости цитиколина у пациентов с БП с недементными когнитивными нарушениями в амбулаторной практике.
Материал и методы
В исследовании принимали участие 68 пациентов с БП (43 женщины и 25 мужчин), средний возраст которых составил 59,5 ± 6,3 года, с длительностью заболевания от года до 10 лет. Среди пациентов преобладали лица в возрасте от 60 до 69 лет (63,2 %), в меньшем количестве были пациенты от 40 до 49 (7,4 %) и от 50 до 59 лет (29,4 %).
Диагностика БП основывалась на наличии гипокинезии и минимум одного из следующих симптомов – тремора покоя, ригидности. При постановке диагноза учитывались общепризнанные международные критерии и рекомендации кафедры неврологии Российской медицинской академии последипломного образования (Центр экстрапирамидных заболеваний, Москва). Отмечена выраженность когнитивных нарушений с уточнением стадии болезни по Хен и Яру (1967) и темпа прогрессирования [17].
Тяжесть когнитивных нарушений определялась по общепринятой классификации Н.Н. Яхно, согласно которой выделяют легкие, умеренные и тяжелые когнитивные расстройства [4, 11]:
- Легкие когнитивные нарушения (ЛКН) – снижение когнитивных способностей по сравнению с более высоким преморбидным уровнем индивидуума, которое формально остается в пределах среднестатистической возрастной нормы или отклоняется от нее незначительно. Обычно отражается в жалобах больного, но не обращает на себя внимания окружающих. Не вызывает затруднений в повседневной жизни, даже при наиболее сложных ее формах.
- УКН – снижение когнитивных способностей, явно выходящее за пределы возрастной нормы. Отражается в жалобах индивидуума и обращает на себя внимание окружающих. Не приводит к существенным затруднениям в повседневной жизни, хотя может препятствовать наиболее сложным видам интеллектуальной активности.
- Тяжелые когнитивные нарушения (деменция) – снижение когнитивных способностей, которое приводит к существенным затруднениям в повседневной жизни, частичной или полной утрате независимости и самостоятельности.
Критерии включения в исследование:
- наличие жалоб на снижение памяти или умственной работоспособности, высказанных пациентом самостоятельно или при активном расспросе врача;
- наличие когнитивных нарушений на недементной стадии (ЛКН и УКН);
- письменное информированное согласие пациента на участие в исследовании;
- сумма баллов по MMSE не менее 26.
Критерии исключения:
- отсутствие жалоб у больных и их родных на ухудшение памяти;
- отсутствие когнитивных нарушений при проведении нейропсихологического тестирования;
- сумма баллов по MMSE < 26 баллов [1, 14].
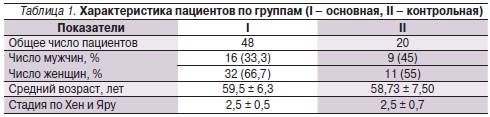
В дальнейшем для проведения сравнительной оценки влияния цитиколина на когнитивные нарушения больных в произвольном порядке распределили на две группы, сопоставимые по возрасту, длительности заболевания и степени его тяжести. Характеристика больных по группам представлена в табл. 1. Пациенты основной группы (n = 48) принимали цитиколин по назначенной схеме: первые 10 дней по 1000 мг внутривенно, затем внутрь по 200 мг 3 раза в день в течение 8 недель. В контрольной группе (n = 20) цитиколин не назначался. У больных обеих групп, включенных в исследование, изначально была откорректирована противопаркинсоническая медикаментозная терапия, которая в последующем на протяжении наблюдаемого периода не менялась.
Количественная оценка выраженности двигательных расстройств и тяжести заболевания у больных выполнялась с помощью унифицированной рейтинговой шкалы оценки проявлений паркинсонизма – III раздел, (УРШОП-III).
Когнитивные функции оценивались с помощью нейропсихологических тестов:
- тест рисования часов, чувствительный к характерным для БП зрительно-пространственным и регуляторным расстройствам. Простота и необычайная информативность делают его одним из наиболее применяемых для диагностики когнитивных нарушений;
- тест на речевую фонетическую активность.
Для оценки динамики когнитивных нарушений после лечения применялась Краткая шкала оценки психического статуса (Mini-Mental State Examination – MMSE), включающая разделы по ориентации, запоминанию, вниманию, счету, воспроизведению, речи, конструктивному праксису. Результаты теста оценивались по сумме баллов: высокие когнитивные способности – 30 баллов, от 26 до 28 – ЛКН и УКН, менее 26 баллов – деменция с различной степенью тяжести [1].
Дизайн исследования был следующим – проводилось сравнение двигательных нарушений, и психологического фона у наблюдаемых пациентов в первый день и после окончания курса лечения. Оценка безопасности включала регистрацию всех нежелательных явлений (НЯ). Проводился анализ НЯ: характер, время возникновения и прекращения, тяжесть, связь с исследуемым препаратом, являются ли серьезными меры по устранению. Степень тяжести НЯ устанавливалась в соответствии со следующей классификацией: 1-я степень – легкое НЯ, легко переносимое пациентом, причиняющее минимальные неудобства и не препятствующее повседневной деятельности; 2-я степень – среднее НЯ, причиняющее дискомфорт, мешающее повседневной деятельности, и 3-я степень – тяжелое НЯ, препятствующее нормальной повседневной деятельности.
Статистическая обработка проводилась с использованием стандартизованных функций программ Microsoft Excel и Statistika 6. Достоверность различий средних величин определялась с помощью параметрического (t-тест Стьюдента) и непараметрического метода (критерий Манна–Уитни). Для определения взаимосвязи между переменными вычисляли коэффициент корреляции R-Спирмена.
Критический уровень значимости при проверке статистических гипотез (р) составлял в исследовании 0,05.
Результаты
После проведенного нейропсихологического тестирования у наблюдаемых пациентов зарегистрировано преобладание УКН в более половине (58,3 %) случаев, несколько реже отмечали ЛКН (31,3 %) и нормальные показатели (10,4 %). При опросе больные предъявляли жалобы на ухудшение памяти на ближайшие события, затруднения при усвоении новой информации, нарушение внимания и умственной работоспособности. В то же время оставались сохранными память на отдаленные события жизни, приобретенные в прошлом навыки.
Исследование показало, что применение цитиколина привело к улучшению субъективных показателей. Так, после лечения пациенты основной группы отмечали улучшение памяти, внимания и общего психологического фона. У них выявлено статистически достоверное повышение интегрального показателя, отражающего выраженность когнитивных нарушений – суммарного балла ММSE (с 27,2 ± 1,2 до 28,7 ± 1,1 балла; р = 0,005; табл. 2). При этом наблюдалось улучшение внимания (с 4,0 ± 1,0 до 4,5 ± 0,7 балла; р = 0,002), памяти (1,1 ± 0,7 до 2,0 ± 0,6 балла; р = 0,005), речевой фонетической активности (с 8,6 ± 2,5 до 10,6 ± 2,5 балла; р = 0,05). Отмечено и улучшение показателей теста рисования часов (с 8,7 ± 0,9 до 9,2 ± 0,7 балла; р = 0,001).
Таблица 2. Динамика показателей диагностических тестов (баллы) для выявления когнитивных
расстройств и двигательных нарушений у пациентов I и II групп.
В контрольной группе существенной положительной динамики в когнитивной сфере за период наблюдения не отмечено (табл. 2).
Корреляционный анализ показал, что полученные показатели MMSE отрицательно коррелировали с возрастом больных (r = -0,5; p = 0,001) и возрастом дебюта заболевания (r = -0,4; p = 0,001). Так, чем старше был возраст дебюта и возраст больных, тем более выраженными становились когнитивные расстройства.
В ходе исследования не отмечено нарастания основных симптомов паркинсонизма как в основной, так и в контрольной группе. Тем не менее больные, получавшие цитиколин, указали на улучшение общего самочувствия и двигательной активности. В частности, в основной группе выявлена тенденция к улучшению двигательной активности по шкале УРШОП-III (общий балл с 38,5 ± 12,0 снизился до 36,1 ± 10,7; р = 0,007), в то время как в контрольной группе изменений практически не наблюдалось (36,7 ± 10,8 и 37,5 ± 11,6 балла).
За период наблюдения цитиколин продемонстрировал благоприятный профиль безопасности и переносимости. Тем не менее в ходе исследования у трех пациентов основной группы были зарегистрированы НЯ, связанные с проводимой терапией (II степень). У 1 (2,1 %) пациента отмечено двигательное возбуждение, а у 2 (4,2 %) – головокружение при применении цитиколина в дозе 1000 мг/сут. При уменьшении дозы до 500 мг/сут состояние больных улучшилось и отмены препарата не потребовалось.
Заключение
В ходе проведенного исследования были получены достоверные данные о том, что препарат цитиколин оказывает положительное влияние на больных БП с когнитивными нарушениями. При нейропсихологическом тестировании выявлено увеличение суммарного балла по шкале ММSE в основной группе, отсутствовавшее в контрольной. В основной группе зарегистрировано также улучшение памяти, внимания и речевой активности.
Кроме того, на фоне лечения цитиколином больные отметили позитивные изменения общего психологического фона с улучшением самочувствия и настроения, что положительно сказалось на качестве их жизни. У пациентов основной группы выявлена тенденция к улучшению двигательной активности (оценка по УРШОП-III).
В целом в проведенном исследовании отмечены высокая безопасность и хорошая переносимость цитиколина. На фоне его применения не было зарегистрировано значимых НЯ, требовавших отмены препарата. Полученные результаты свидетельствуют о целесообразности назначения цитиколина как средства нейропротекторной терапии в комплексном лечении больных БП с недементными нарушениями когнитивных функций. Также целесообразно продолжить дальнейшее наблюдение за пациентами с целью анализа устойчивости эффекта проведенной лекарственной терапии с использованием цитиколина.
Информация об авторе:
Гашилова Фарида Фаридовна – кандидат медицинских наук, врач высшей категории
МЛПУ “Медико-санитарная часть № 2”


