Введение
Злокачественные новообразования средостения и легкого отличаются большим полиморфизмом, при этом тактика лечения во многих случаях принципиально отличается в зависимости от гистологической структуры опухоли и мутаций гена [2, 3]. Согласно современным представлениям о лечении злокачественных опухолей, большинство пациентов нуждаются в комбинированной или комплексной терапии [1, 7]. Несмотря на это, частота рецидивов достигает высоких цифр, что зачастую обусловлено неполноценной диагностикой [4, 8, 12]. Указанные обстоятельства значительно повышают требования к качеству диагностики [5, 6, 9, 10]. Ультразвуковая эндосонография в ряде случаев может быть оптимальной методикой для решения вышеуказанных задач [5, 6, 9, 11]. Эндобронхиальная ультрасонография с использованием ультразвуковых эндоскопов и мини-датчиков обеспечивает получение изображения не только трахеобронхиальной стенки, но и смежных с ней структур средостения [10]. Для диагностики перибронхиальных структур в настоящее время используют иглы для цитологического исследования и тонкоигольной аспирационной биопсии [5].
В настоящей статье мы сообщаем о нашем опыте использования данной методики в отношении 183 пациентов.
Материал и методы
Исследование проводилось с целью оценки возможности методики эндобронхиальной ультрасонографии (EBUS-TBNA) при обследовании пациентов с очаговой патологией органов грудной клетки, выявленной при рентгенологическом исследовании. В исследование были включены 183 пациента, которым эндобронхиальное ультразвуковое исследование проводилось с января 2015 по февраль 2016 г.
Оборудование: диагностическая ультразвуковая система EU-ME1; видеоэндоскопическая система «Evis Exera III»; ультразвуковой бронховидеоскоп BF-UC180F; ультразвуковые датчики UM-S20-20R и UM-BS20-26R; бронхофиброскоп BF-1TH190 «Olympus Medical System Corp.». Инструменты: иглы для пункций; аспирационные иглы для TBNA 22G «Olympus Medical System Corp.», иглы «Essen»; иглы MTW.
Эндобронхиальное ультразвуковое исследование выполнено с использованием бронхоскопа с конвексным электронным датчиком, расположенным на дистальном конце эндоскопа, с частотой сканирования 5, 7,5, 10 и 12 МГц. Кроме того, использовался механический высокочастотный (20 МГц) эндосонографический ультразвуковой зонд с радиальным сектором сканирования. Зонд вводился через инструментальный канал эндоскопа в исследуемый бронх с последующим сканированием области опухолевого поражения. Во время бронхоскопии пациентам непрерывно проводили пульс-оксиметрию и каждые 5 минут измеряли артериальное давление.
 Методика EBUS
Методика EBUS
Исследование выполняют в положении лежа на спине или полусидя. При исследовании ультразвуковым бронхоскопом осмотру доступны трахея, главные бронхи и промежуточный бронх. В некоторых случаях возможно исследование нижнедолевых бронхов. При исследовании мини-датчиком возможны как манипуляции в трахее и крупных бронхах, так и обследование на уровне бронхов вплоть до 6-го порядка. В нашем исследовании оценивались стенка бронха, прилежащие ткани, сосуды, лимфатические узлы в непосредственной близости к патологическому очагу и сам патологический очаг. Наряду с исследованием опухоли немаловажной задачей ультразвуковой диагностики стала оценка возможности забора патологического материала для цитологического и гистологического исследований с помощью иглы или биопсийных щипцов. Основным ориентиром служило соотношение структур в зависимости от положения эндоскопа в стандартных точках бронхиального дерева.
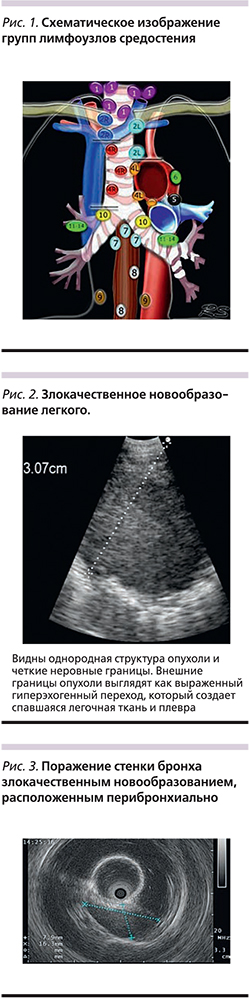
Лимфатические узлы визуализируются в виде гипо- и изоэхогенных структур овоидной формы с более гиперэхогенным внутренним и гипоэхогенным корковыми слоями. При эндобронхиальной ультрасонографии удается визуализировать измененные лимфоузлы 2-й, 4, 7-й, иногда 5-й, 10 и 11-1 зон (рис. 1).
Опухоль чаще определяется в виде гипоэхогенного новообразования с неровными границами и четкими контурами на фоне нормальной структуры легкого (рис. 2).
При поражении стенки бронха исчезает его нормальная слоистость, в зоне поражения стенка утолщается (рис. 3).
Исследование конвексным бронхоскопом проведено из стандартных точек: трахея, левый трахеобронхиальный угол (4L-группа), зона бифуркации трахеи (7-я группа), шпора долевых бронхов слева (10L-группа), зона долевых бронхов справа (10R-группа), правый трахеобронхиальный угол (4R-группа). Исследование начиналось сканированием из трахеи зоны левого трахеобронхиального угла. Датчик при этом был обращен латерально. Выводится аортопульмональное окно и группа лимфоузлов 4L.
При значительном увеличении бывают доступными для осмотра лимфоузлы 5-й группы. Лимфоузлы 6-й группы, как правило, доступны для диагностики из парастернального чрескожного доступа. При эндоскопическом ультразвуковом исследовании они недоступны.
Выше аорты при сканировании из трахеи слева определяются лимфоузлы зоны 2. Таким образом, ориентиром, разделяющим зоны 4 и 2 слева, служит тень от аорты.
После оценки зон 2 и 4 переходили к сканированию зоны бифуркации трахеи (зона 7). Осмотр лимфоузлов этой зоны можно проводить как через левый, так и через правый скаты бифуркации.
На следующем этапе аппарат проводится до шпоры долевых бронхов слева и сканируется зона 10 слева. Нижняя граница ствола легочной артерии служит линией, отграничивающей группу лимфоузлов 10. При сканировании из нижнедолевого бронха слева датчик расположен к шпоре, оцениваются лимфоузлы 11–13-й зон. Сканирование и пункция из верхнедолевого бронха технически затруднительны и бывают легкоосуществимыми только в редких случаях.
Далее аппарат перемещается в правый главный бронх до уровня шпоры долевых бронхов. На этом уровне определяются лимфоузлы 10-й зоны справа. Визуальным ориентиром, разделяющим лимфоузлы 10-й и 11–13-й зон, является устье верхнедолевого бронха справа. Медиально проходит ствол легочной артерии, кпереди – легочная вена.
Далее аппарат медленно извлекается из бронхов, сканируя латеральную стенку главного бронха. Проксимальнее верхнедолевого бронха справа определяется группа лимфоузлов 10R, еще проксимальнее, как правило, видна непарная вена, которая служит границей, разделяющей 10-ю и 4-ю группы лимфоузлов справа. Диаметр непарной вены в этой зоне составляет 10–12 мм.
После осмотра лимфоузлов 4-й группы аппарат медленно извлекается и по латеральной и передней стенкам становится виден плечеголовной венозный ствол, впадающий в полую вену. Плечеголовной ствол является границей, разделяющей 4-ю группу лимфоузлов справа от группы 2. При сканировании латеральной стенки плечеголовную вену вывести удается не всегда, однако она всегда «пересекает» трахею спереди и для точного ориентирования следует сканировать переднюю стенку трахеи. Диаметр вены достигает 15–17 мм.
При выявлении увеличенных лимфоузлов оценивались следующие параметры: 1) форма, 2) размер, 3) соотношение кортикального и медуллярного слоев лимфатического узла, 4) структура лимфоузла, 5) эхоплотность, 6) наличие или отсутствие экстракапсулярного распространения. Другие параметры, такие как характер васкуляризации при цветовом допплеровском картировании, толщина области ворот и т.д., нами оценивались в меньшей степени и не являлись критерием оценки целесообразности пункции.
Зона исследования конвексным бронхоскопом, как правило, ограничивалась трахеей, главными и промежуточным бронхами. Исследование тканей, окружающих более мелкие бронхи, затруднительно. В этом случае исследование дополнялось использованием мини-датчиков. В долевых бронхах мы применяли зонд с баллоном на дистальной части оболочки. При локализации процесса на уровне бронхов 5-го порядка и дистальнее в использовании баллона для создания ультразвукового «окна» уже не было необходимости. Начинали исследование бронхиального дерева мини-датчиками из тех же стандартных точек: 1) нижняя треть трахеи, 2) левый трахеобронхиальный угол, 3) бифуркация трахеи (левый и правый скаты), 4) шпора долевых бронхов слева, 6) долевые бронхи слева до деления на сегментарные, 7) шпора долевых бронхов справа до деления на сегментарные, 8) правый трахеобронхиальный угол. Последовательность может меняться в любом порядке, однако анатомические перибронхиальные структуры этих зон, как правило, стабильны.
При сканировании из нижней трети трахеи видны нисходящая аорта, ствол легочной артерии, лимфоузлы аортопульмонального окна и левое предсердие с митральным клапаном. Из левого главного бронха и трахеи хорошо виден спавшийся пищевод, зачастую в этой зоне видны увеличенные лимфоузлы, и при определенном навыке можно обнаружить инвазию опухоли в мышечную стенку пищевода.
При сканировании в области задней стенки трахеи хорошо визуализируются тела шейных позвонков, видны срезы позвоночной артерии и нисходящая аорта.
 Затем, изменив масштаб изображения, выводили интересующий нас патологический очаг. При работе мини-датчиком нет возможности использовать допплеровский режим, а также контролировать инструмент в процессе биопсии, однако оценить локализацию и размеры перибронхиального очага удается с высокой точностью.
Затем, изменив масштаб изображения, выводили интересующий нас патологический очаг. При работе мини-датчиком нет возможности использовать допплеровский режим, а также контролировать инструмент в процессе биопсии, однако оценить локализацию и размеры перибронхиального очага удается с высокой точностью.
Нами определялось расположение патологического очага, оценивалась его структура, измерялся поперечный размер и маркировалась слизистая оболочка в области максимального поперечного размера новообразования. Маркировка слизистой оболочки в нашем случае выполнялась биопсийными щипцами. Затем в этой зоне проводилась тонкоигольная аспирационная биопсия новообразования. Расстояние выхода иглы устанавливалось на 5 мм меньше максимального размера новообразования в исследуемой зоне.
Выполнение биопсии
После визуализации патологического очага манипуляцию забора материала начинали с тонкоигольной аспирационной биопсии. Использовали иглу 22 G (рис. 4).
После введения иглы в очаг выполняли от 5 до 20 пассов. Методику повторяли до получения адекватных столбиков ткани, но не более 3 раз. Полученный материал помещали в сосуд с физиологическим раствором. После завершения процедуры тонкоигольной аспирационной биопсии, особенно при ее неэффективности, дальнейшую работу продолжали биопсийными щипцами в форме иглы, модель «Essen». Щипцы состоят из иглы, имеющей раскрытие аналогично биопсийным щипцам. Игла убирается в тубус полностью. Диаметр инструмента – 1,8 мм, диаметр иглы – 1 мм, длина инструмента – 120 см.
Методика EBUS-TBNA
После появления тубуса в поле зрения эндоскопа с помощью ручки выдвигали иглу. Затем иглу продвигали вглубь поражения под контролем ультразвукового сканирования и раскрывали бранши.
При раскрытых чашечках щипцы продвигали на 2–3 мм вглубь поражения, затем чашечки закрывались. Открытие и закрытие щипцов можно повторять неоднократно для фрагментации опухоли и максимально лучшего забора материала.
Игла извлекалась из тубуса полностью, последний оставался в канале. Полученный образец помещали в формалин. Процедуру биопсии при неудовлетворительном заборе материала повторяли также до 3 раз. При безуспешном заборе материала в просвет тубуса вводили цитологическую щетку с целью забора материала для цитологического исследования. После проведения биопсии тубус оставляли на месте в течение 2 минут для предотвращения кровотечения. Безопасной считали кровопотерю в пределах 50 мл.
Результаты
В отношении 183 пациентов они были подтверждены при проведении трансторакальной пункционной биопсии под рентгенологическим либо под контролем компьютерной томографии и при торакотомии. Для 152 (83%) пациентов окончательный диагноз не отличался от такового, установленного посредством EBUS-TBNA. Среди остальных пациентов (31; 17%) в 5 случаях диагноз был установлен при проведении трансторакальной пункционной биопсии, 24 пациентам – при проведении торакотомии, 2 больным – при безуспешности морфологической верификации увеличенных неизмененных лимфоузлов после курса противовоспалительной и антибактериальной терапии при повторном рентгенологическом исследовании отмечена выраженная положительная динамика с нормализацией размеров лимфоузлов. В этих случаях был выставлен диагноз неспецифического воспаления.
Правильный диагноз при использовании ЭБУС-ТП был установлен в 35 (61,4%) случаях, в т.ч. при злокачественных поражениях в 31 из 47 (66%) случаев, а при доброкачественных – в 4 из 10 (40%).
Правильный диагноз при использовании EBUS-TBNA был установлен в 152 (83,0%) случаях, в т.ч. при злокачественных поражениях в 127 (83,6%) из 152 случаев, а при доброкачественных в 25 (80,6%) из 31. При использовании игл для тонкоигольной аспирационной биопсии цитологическая верификация была достигнута в 73,2% (134 из 183) случаев, а гистологическая в 54,3% (99 из 183). При трансбронхиальной биопсии щипцами типа «Essen», цитологическое исследование не выполнялось, а успешность гистологической верификации при успешном заборе материала была несколько выше, чем при использовании игл, и составила 87,3% (76 из 87; p<0,001, χ2).
Успешность диагностики при использовании мини-зонда и конвексного бронхоскопа была примерно одинаковой: 44 (84,6%) из 52 при использовании бронхоскопа и 58 (81,7%) из 71 при использовании мини-зондов (p=0,89; χ2). Однако общая продолжительность процедуры при использовании зондов составила 14±4,3 минуты, а при использовании ультразвукового бронхоскопа – 8±2,7.
Данные необходимо понимать следующим образом: количество манипуляций прибором/всего манипуляций в этой зоне (% успешной диагностики). В таблице указаны диагностические процедуры. При диагностике на уровне крупных бронхов чаще использовался конвексный бронхоскоп. На уровне же долевых бронхов и дистальнее большую результативность обеспечивало использование мини-датчиков. Пункцию во всех случаях осуществляли иглой для тонкоигольной аспирационной биопсии. На успешность диагностики при EBUS-TBNA оказывала влияние локализация поражения. Показатели успешной диагностики были следующими: при локализации патологического процесса в проекции лимфоузлов зоны 2R (8 из 16 случаев; 50%), 4R (11 из 14 случаев; 78,6%), 4L (18 из 20 случаев; 90%), 2L (19 из 23 случаев; 82,6%), 7 (35 из 37 случаев; 94,6%), 10 (61 из 73 случаев; 83,6%). Успешность диагностики для 2R-зоны была значительно ниже, чем для других локализаций (p=0,003, χ2).
Восемнадцать поражений не удалось отобразить на EBUS-изображениях (эти пациенты были исключены из исследования). У 3 (1,6%) пациентов развилось умеренное кровотечение.
У 2 (1,1%) больных после биопсии щипцами лимфоузлов 2-й зоны в течение первых суток развилась незначительная подкожная эмфизема на шее. Ни одному пациенту не потребовалась интубация или хирургическое вмешательство. Пневмоторакса и других серьезных осложнений не встретилось. Летальных исходов не было.
Обсуждение
Согласно опубликованным сообщениям [11], диагностическая точность ультразвуковой бронхоскопии для внутригрудных поражений достигает 98%, по точности превосходит компьютерную томографию (КТ; 60,8%) и позитронно-эмиссионную томографию (72,5%). Хотя мы использовали EBUS-TBNA в качестве процедуры с целью выполнения биопсии для верификации диагноза, КТ нередко использовалась для оценки распространенности процесса и уточнения локализации поражения. В то время как чувствительность КТ и EBUS составила 84,3 и 81,7% соответственно, специфичность EBUS-TBNA в нашем исследовании достигла 98% (82,3% при КТ). Мы предполагаем, что в дальнейшем EBUS-TBNA в значительной степени дополнит лучевые методы диагностики. В настоящей работе результативность исследования при доброкачественных процессах составила 80,6%, при злокачественных – 83,6%. В нашем исследовании с применением EBUS-TBNA наихудшие результаты диагностики отмечены при локализации поражения в проекции лимфоузлов 2R-зоны (8 из 16; 50%) по сравнению с другими локализациями. Причиной более низкой точности диагностики для 2R-зоны, вероятно, служит сложность анатомических взаимоотношений с крупными сосудами. В этой зоне расположено множество крупных венозных структур: полая вена, плечеголовной венозный ствол. При наличии патологического очага в этой зоне всегда существует опасность травматизации этих структур, что может иметь серьезные последствия. Лучшие результаты были достигнуты при пункции новообразований в проекции лимфоузлов зоны 7 (35 из 37, 94,6%). Считаем эту локализацию наиболее удобной для пункции, которую можно выполнять как с левого, так и с правого скатов карины, в этой зоне отсутствуют крупные сосудистые магистрали, и манипуляции относительно безопасны. Процедура EBUS-TBNA была наиболее успешной в случае однородного новообразования без очагов распада. После забора материала биопсийными щипцами «Essen» необходимо помнить, что при этом происходит существенная травма окружающих тканей и удалять тубус щипцов после биопсии следует только через 2–3 минуты. За это время в зоне прокола стенки бронха формируется сгусток и опасность кровотечения в просвет бронха существенно снижается. Анализируя результаты настоящего исследования, можно отметить, что трансбронхиальное ультразвуковое исследование при патологии органов средостения может осуществляться с использованием различной эндоскопической аппаратуры и инструментария. Оно позволяет в большинстве случаев получить подтверждение диагноза и значительно расширяет диагностические возможности клиники. При приобретении персоналом определенного навыка трансбронхиальное ультразвуковое исследование становится эффективным и безопасным диагностическим методом. Его использование может быть рекомендовано всем клиникам, имеющим профильные стационары.


