Длительно существовавшее представление о немелкоклеточном раке легкого (НМРЛ) как о гомогенном заболевании, лечение которого должно строиться на общих принципах, в течение последних 10 лет претерпело существенные изменения. Длительное время прогресс в терапии метастатического НМРЛ был весьма скромным. Появление новых химиопрепаратов лишь незначительно улучшило результаты лечения в отношении преимущественно неплоскоклеточного рака легкого (табл. 1).
Широкое распространение в последнее десятилетие молекулярно-генетических методов исследования вскрыло новые механизмы канцерогенеза. Часть из этих механизмов оказалась пригодной для терапевтического воздействия. Обнаружено несколько ключевых сигнальных каскадов, активация которых напрямую связана с пролиферацией, миграцией и метастазированием опухолевых клеток. Экспрессия рецепторов к эпидермальному фактору роста (EGFR – epidermal growth factor receptor) обнаруживается при НМРЛ в 85–90%. Вследствие этого именно EGFR был первым рецептором, предложенным как мишень для противоопухолевой терапии. EGFR – один из четырех членов семейства рецепторов тирозинкиназы ERBB. Все семейство состоит из четырех членов: EGFR (также известный как ERBB1/HER1), ERBB2/HER2/NEU, ERBB3/HER3 и ERBB4/HER4. Специфические лиганды связываются с экстраклеточным доменом EGFR, что приводит к формированию гомо- и гетеродимеров. Димеризация стимулирует внутреннюю тирозинкиназную активность рецепторов, что является пусковым механизмом аутофосфорилирования специфических тирозинкиназных окончаний. Это приводит к запуску нескольких внутриклеточных каскадов, таких как MAPK, PI3K-AKT, STAT 3 и 5, непосредственно регулирующих пролиферацию и апоптоз [2].
Сам ген EGFR локализуется в хромосоме 7p12, состоит из 28 экзонов и 27 интронов. В 2004 г. были обнаружены соматические мутации в киназном домене пациентов, чья опухоль ответила на терапию гефитинибом [3, 4]. Мутации EGFR способствует увеличению степени и длительности фосфорилирования EGFR и других протеинов семейства HER, что означает их активирование без стимуляции лигандом [5].

В настоящее время препараты, воздействующие на пути регуляции EGFR, представлены двумя классами: моноклональные антитела к EGFR (цетуксимаб, панитумумаб) и ингибиторы тирозинкиназ – ИТК (эрлотиниб, гефитиниб, афатиниб). При использовании моноклональных антител к данным рецепторам наибольшее значение имеют уровень их экспрессии и амплификация гена EGFR. Для ИТК экспрессия EGFR обладает слабыми предиктивными свойствами. Гораздо большее значение имеет наличие мутаций, которые приводят к постоянной активизации EGFR даже в отсутствие контакта со специфическим лигандом.
Клиническая эффективность ИТК при различных мутациях EGFR
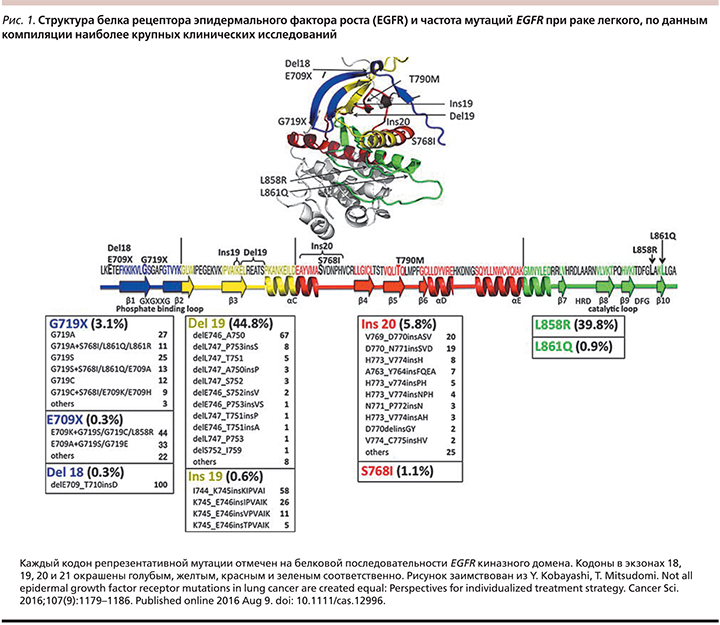
Подавляющее число «активирующих» мутаций локализуется в 18–21-м экзонах гена EGFR. Подобные мутации чаще регистрируются среди лиц азиатской расы (30 против 8%), никогда не куривших (51 против 10%), женщин (42 против 14%) и пациентов с аденокарциномой (40 против 3%). Наиболее часто встречаются делеция в экзоне 19 (del19) и точечная мутация L858R в экзоне 21 [6]. Однако этими вариантами мутации в гене EGFR не ограничиваются. В каталоге соматических мутаций при злокачественных новообразованиях (COSMIC – Catalogue of Somatic Mutations in Cancer), крупнейшей открытой базе данных [7], на май 2016 г. зарегистрировано приблизительно 16 тыс. мутаций EGFR. В соответствии с этой базой данных описано 594 различных типа мутаций EGFR. Среди них 93% представлены в первых четырех экзонах (18–21) гена, кодирующего тирозинкиназный домен.
Частота объективных ответов (ОО) в проспективных исследованиях больных НМРЛ с наличием наиболее частых соматических мутаций колеблется от 55 до 91% [8]. Причина столь высокой вариабельности частоты ОО и времени до прогрессирования заболевания неизвестна. В ряде исследований есть указания на то, что демографические характеристики могут быть связаны с длительностью ответа на терапию. Так, если в исследовании EUROTAC, изучавшем эффективность эрлотиниба на европейской популяции больных раком легкого с наличием мутации EGFR, медиана времени без прогрессирования составила 9,7 месяца [9], то в аналогичном исследовании OPTIMAL в азиатской популяции тот же показатель составил 13,1 месяца. Подобным же образом различается эффективность эрлотиниба для женщин и мужчин. Причина этого феномена не изучена. Эффективность ИТК первого поколения в прямых сравнительных исследованиях не изучалась. Опубликованы результаты непрямого сравнительного анализа данных исследований OPTIMAL (эрлотиниб) и IPASS (гефитиниб), в котором указывается на более высокую эффективность эрлотиниба в отношении выживаемости без прогрессирования и его более высокая ценовая эффективность по сравнению с гефитинибом [10, 11].

Еще в более широком диапазоне варьируется эффективность ИТК при различных мутациях EGFR. Делеция в 19-м экзоне (Del19) и точечная мутация L858R составляют 44,8 (2573/5741) и 39,8% (2283/5741) от всех мутаций EGFR соответственно [12–16]. Эффективность гефитиниба, эрлотиниба или афатиниба оценена в нескольких проспективных исследованиях ИТК [9, 17–22], частота ОО составила приблизительно 60%, время до прогрессирования – 9–13 месяцев. Условно Del19 и L858R можно отнести к одной чувствительной к ИТК группе. Длительность ответа на терапию при точечной мутации L858R в 21-м экзоне ниже, чем при делеции в 19-м экзоне. Мета-анализ семи рандомизированных исследований, сравнивавших ИТК с химиотерапией (ХТ) на основе платины, продемонстрировал, что отношение рисков (ОР) для выживаемости без прогрессирования (ВБП) при опухолях с Del19 было на 50% больше (ОР=0,24, 95% доверительный интервал [ДИ] – 0,20–0,29), чем при опухолях с L858R (ОР=0,48, 95% ДИ – 0,39–0,58) [23].
Эффективность ИТК при редких мутациях в 18-м и 20-м экзонах изучена недостаточно. Сводные сведения об эффективности ИТК при редких мутациях приведены в табл. 2.
Вставочные мутации в 20-м экзоне, по данным различных авторов, составляют от 5,8 до 9% от всех мутаций EGFR и являются третьими по частоте после Del19 и L858R [24, 25]. Выявление мутаций в 18-м и 20-м экзонах в целом нельзя назвать отрицательным предиктором ответа на ИТК EGFR. Однако вероятность ответа на терапию существенно ниже, чем при «классических» мутациях. Причем при мутациях в 20-м экзоне частота ОО колеблется в широком диапазоне от 8 до 86%. Наш опыт указывает на возможность достижения ОО у пациентов с мутацией в 20-м экзоне р.K806R.
Клинический пример 1
Никогда не курившая пациентка 63 лет обратилась за медицинской помощью, предъявив жалобы на кашель, появление объемного образования в области волосистой части головы. После обследования, включая компьютерную томографию (КТ) органов грудной клетки, брюшной полости, остеосцинтиграфию, магнитно-резонансную томографию (МРТ) головного мозга, был установлен диагноз: периферический рак (аденокарцинома) верхней доли левого легкого T2N2M1b с метастазами во внутригрудных лимфатических узлах, костях скелета, головном мозге, IV стадия. Выполнено молекулярно-генетическое исследование, при котором обнаружена вставочная мутация р.K806R в 20-м экзоне гена EGFR. Больной начата терапия эрлотинибом в дозе 150 мг/сут, проведено радиохирургическое лечение метастазов в головном мозге. При контрольном обследовании через 3 месяца после начала лечения достигнут частичный регресс опухоли, который сохраняется после 6 месяцев терапии. Больная удовлетворительно переносит лечение, сыпи и диареи не отмечено.
Отсутствие проспективных исследований и сложность их организации в связи с редкостью встречаемых мутаций затрудняют получение объективной информации об эффективности ИТК для этой популяции пациентов. Поскольку определение редких мутаций в рутинной практике не осуществляется, значительное число пациенток, потенциально способных ответить на лечение, ИТК не получают. Определение мутаций EGFR позволяет в ограниченной популяции, составляющей не более 15% всех больных НМРЛ, получать с высокой вероятностью ответ на терапию ИТК. Если обратиться к исследованию BR.21, то мутации EGFR были обнаружены у 17% больных [26], а уровень контроля заболевания (ПО–полный ответ+ЧО–частичный ответ+СЗ–стабилзация заболевания) составил 45% [27]. Таким образом, если при назначении эрлотиниба учитывать только наличие активирующих мутаций, теоретически около 22% пациентов, потенциально способных ответить на лечение, его не получат. Вероятно, значительную долю ответивших на лечение, но не имевших «классических» мутаций, составляют больные с редкими мутациями EGFR. Многие авторы подчеркивают, что расширение объема молекулярно-генетических исследований для идентификации большего количества мутаций EGFR в рутинной практике экономически не оправдано. Клиническая характеристика пациентов с редкими, в т.ч. с вставочными, мутациями в 20-м экзоне существенно не отличается от таковой больных с Del19 и L858R. По данным Arcila и соавт., лица женского пола составляют 67%, никогда не курившие – 48%, азиатской расы – 12%. Имеется тенденция к увеличению доли никогда не куривших, но отсутствуют различия по возрасту, полу, расе по сравнению с «классическими» мутациями (включая EGFR экзон 19 del, L858R, L861Q, и мутации G719) [25].
С учетом объективных трудностей с идентификацией пациентов с редкими мутациями схожесть демографических характеристик пациентов обеих групп представляется целесообразным использовать клинические предикторы эффективности ИТК для идентификации больных, имеющих наибольшие шансы на терапии ИТК. В 2011 г. опубликованы данные российского многоцентрового исследования по изучению возможности использования клинических предикторов для отбора больных НМРЛ на терапию эрлотинибом, в котором определено две группы больных, вероятность контроля заболевания при назначении им эрлотиниба превысила 75%.
Это «аденокарцинома у женщин» (независимо от статуса курения) и никогда не курившие пациенты (независимо от морфологической структуры НМРЛ) [28]. В это исследование вошли 10 пациентов без «классических» мутаций EGFR, в 4 (40)% случаях достигнут ОО, в 6 – стабилизация заболевания.

Появление новых ИТК EGFR второго и третьего поколений в перспективе требует необходимости расширения линейки определяемых мутаций, что диктуется наличием корреляции между локализацией мутации и ответом на терапию различными ИТК.
В нескольких работах опубликованы данные о большей эффективности ИТК первого поколения (эрлотиниб, гефитиниб) к опухолям с наличием вставочной мутации в 20-м экзоне по сравнению с ИТК второго поколения (афатиниб) [29–33]. Эффективность афатиниба, вероятно, выше эрлотиниба и гефитиниба при наличии мутаций в 18-м экзоне, включая G719X, L861Q и S768I (ОО – 77,1%; контроль болезни – 84,2%; ВБП – 10,7 месяца) [31, 34]. Исходя из опубликованных данных, при обладании точной информацией о мутации эрлотиниб можно рассматривать как терапевтическую опцию при наличии мутаций в 20-м экзоне, а афатиниб – при мутациях в 18-м экзоне [25, 29, 35–39].
Таргетная терапия в первой линии диссеминированного НМРЛ
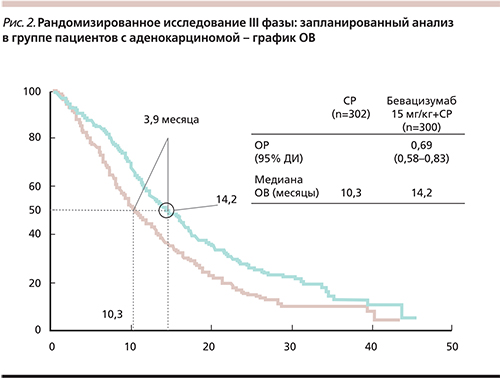
Стандартные платиновые комбинации при раке легкого к концу ХХ в. полностью себя исчерпали. Появление новых противоопухолевых химиотерапевтических препаратов создало дополнительные возможности, однако ни одна из известных комбинаций не имела преимуществ перед другими. Только появление таргетной терапии внесло существенные изменения в эффективность проводимого лечения. Одним из первых таргетных препаратов, зарегистрированных при НМРЛ, стал бевацизумаб. В рандомизированном исследовании III фазы E4599 добавление бевацизумаба к ХТ по схеме паклитаксел+карбоплатин (CP) привело к статистически значимому увеличению общей выживаемости (ОВ) пациентов (рис. 2). В группе пациентов с аденокарциномой медиана ОВ впервые преодолела одногодичный порог и достигла 14,2 месяца, почти на 4 месяца превысив медиану при стандартной ХТ [42].
Применение бевацизумаба повлияло на частоту ОО, увеличив его с 15 до 35%. Достижение ОО не может являться единственной целью лечения, однако оно весьма важно для пациентов с выраженными симптомами заболевания, а также при наличии неконтролированного плеврального или перикардиального выпота.
Клинический пример 2
Пациент мужского пола, курильщик (более 30 лет). Возраст – 58 лет. На фоне общего благополучия отметил быстронарастающую одышку при минимальных нагрузках. При КТ – опухоль правого легкого, правосторонний гидроторакс, при эхокардиографии (Эхо-КГ) – гидроперикард. Больному выполнена биопсия надключичных лимфоузлов. При гистологическом исследовании – умеренно дифференцированная аденокарцинома. Установлен окончательный диагноз: периферический рак (умеренно-дифференцированная аденокарцинома) нижней доли правого легкого T4N3M1 с метастазами в лимфатических узлах средостения, шейно-надключичных с обеих сторон, плевре справа, перикарде, обоих легких, IV стадия.
 Пациенту выполнено дренирование правой плевральной полости, удаление 1700 мл серозно-геморрагической жидкости, в тот же день под контролем ультразвукового исследования – дренирование полости перикарда, удаление 550 мл геморрагического содержимого. При цитологическом исследовании клетки аденокарциномы найдены в плевральной и перикардиальной жидкости. Через установленные дренажи удаление жидкости из плевральной полости и перикарда проводили 2 раза в неделю. Больному начато проведение ХТ по схеме: пеметрексед 500 мг/м2, карбоплатин AUC-5, бевацизумаб 7,5 мг/кг.
Пациенту выполнено дренирование правой плевральной полости, удаление 1700 мл серозно-геморрагической жидкости, в тот же день под контролем ультразвукового исследования – дренирование полости перикарда, удаление 550 мл геморрагического содержимого. При цитологическом исследовании клетки аденокарциномы найдены в плевральной и перикардиальной жидкости. Через установленные дренажи удаление жидкости из плевральной полости и перикарда проводили 2 раза в неделю. Больному начато проведение ХТ по схеме: пеметрексед 500 мг/м2, карбоплатин AUC-5, бевацизумаб 7,5 мг/кг.
В результате лечения достигнут частичный регресс первичной опухоли и метастазов во внутригрудных лимфоузлах. Полностью разрешился опухолевый перикардит и плеврит (рис. 3).
Отмечено улучшение общесоматического статуса, пациент полностью восстановил трудоспособность. Время до прогрессирования составило 11,5 месяца. Токсичность: нейтропения Gr II, флеботромбоз.
Необходимо отметить, что бевацизумаб в исследовании E4599 испытуемые получали до прогрессирования заболевания. Роль бевацизумаба в качестве поддерживающей терапии не изучалась в рандомизированных исследованиях. Однако Nadler в 2011 г. опубликовал работу, в которой проведен ретроспективный анализ результатов лечения 498 пациентов неплоскоклеточным НМРЛ. Из них 403 пациента в первой линии получили платиносодержащую ХТ+бевацизумаб. После завершения комбинированного этапа 154 больных получали и 249 не получали бевацизумаб до прогрессирования заболевания. Медиана ОВ и ВБП была выше в группе пациентов, получавших бевацизумаб до прогрессирования заболевания (медиана ОВ – 20,9 и 10,2 месяца; медиана ВБП – 10,3 и 6,5 месяца соответственно).
Использование таргетной терапии без селекции пациентов существенно снижает эффективность данных препаратов для конкретных больных и может дискредитировать саму идею персонализированного подхода к лечению. А применение ИТК в первой линии терапии НМРЛ – тому классический пример. В исследовании III фазы TORCH [40] первичные пациенты НМРЛ были рандомизированы в 2 группы: цисплатин+гемцитабин или эрлотиниб. При прогрессировании заболевания производилась смена режима терапии на противоположный. Исследование было остановлено после набора 760 больных вследствие более низкой выживаемости в группе пациентов, изначально получавших эрлотиниб (медиана 10,8 против 7,7 месяца, ОР=1,40; 95% ДИ – 1,13–1,73). Ситуация кардинально меняется, если в первой линии терапии эрлотиниб применяется больными НМРЛ с наличием активирующих мутаций EGFR.
В исследовании EURTAC 174 пациента европейской расы с НМРЛ с наличием мутаций EGFR были рандомизированы в 2 группы: эрлотиниб или платиносодержащая ХТ [9]. Медиана ВБП была достоверно выше в группе больных, получавших эрлотиниб, по сравнению с ХТ (9,7 против 5,2 месяца, ОР=0,37; 95% ДИ – 0,27–0,54; р<0,0001). В настоящее время ряд исследований очевидным образом продемонстрировал преимущество ИТК, включая эрлотиниб и гефитиниб [18, 19] в 1-й линии терапии, по сравнению с ХТ. В целом в настоящее время не вызывает сомнений тот факт, что наиболее эффективным лечением больных НМРЛ с мутацией EGFR в 1-й линии являются ИТК. Совокупные данные оценки ВБП 27 исследований эрлотиниба (n=731), 54 исследований гефитиниба (n=1802) и 20 химиотерапевтических исследований (n=984) показали, что в группе пациентов, получавших эрлотиниб, ВБП составила 12,4 месяца (95% ДИ – 11,6–13,4); для гефитиниба ВБП – 9,4 (95% ДИ – 9,0–9,8); для ХТ ВБП – 5,6 месяца (95% ДИ – 5,3–6,0). ВБП для эрлотиниба и гефитиниба была существенно больше, чем для ХТ (р=0,000 и р=0,000 соответственно) [41].
С учетом высокой эффективности эрлотиниба для больных с наличием мутаций EGFR и авастина в общей популяции представляет интерес комбинация антиангиогенной и анти-EGFR-терапии. В 2015 г. опубликован мета-анализ нескольких клинических исследований, сравнивавших ХТ+бевацизумаб с ХТ, а также комбинации эрлотиниба и бевацизумаба – с монотерапией эрлотинибом.
В мета-анализ включено 5 исследований эрлотиниб+бевацизумаб. Результаты указывают, что высокие дозы бевацизумаба (15 мг/кг) статистически значимо улучшают ВБП и ОО (ОРвбп=0,71, 95% ДИвбп – 0,64–0,79; рвбп<0,001; ОО – 1,89, 95% ДИоо – 1,61–2,22; роо<0,001 соответственно), и одновременно продлевают ОВ, хотя различия не достигли достоверного уровня (ОР=0,90, 95% ДИ – 82–0,99; р=0,06). Низкие дозы бевацизумаба не оказали влияния на ОВ [44].
Приобретенная резистентность к ингибиторам тирозинкиназы. Виды прогрессирования и их влияние на клиническую практику Несмотря на высокую эффективность ИТК, медиана времени ответа на терапию составляет около года.
В настоящее время идентифицировано несколько различных механизмов резистентности к ИТК EGFR. Часть из них, возможно, связана с гетерогенностью опухоли, вследствие чего наиболее чувствительные клетки погибают под воздействием эффективного лечения, а резистентный клон продолжает пролиферировать, формируя опухоль, не чувствительную к лечению. Однако значительная часть случаев развития обусловлена появлением вторичной мутации T790M, амплификацией EGFR, HER2, MET, появлением мутации BRAF V600E, активацией альтернативных сигнальных путей, таких как PIK3CA (рис. 4) [45]. По данным различных авторов, в 6–12% случаев встречается феномен эпителиально-мезенхимальной трансформации, в нашем случае – приобретение опухолью иммуногистохимических черт неэпителиальной опухоли, чаще мелкоклеточного рака легкого (МРЛ). Интересен тот факт, что в трансформированной опухоли обнаруживается мутация EGFR, ранее определявшаяся в первичной опухоли, а сама опухоль отвечает на классическую ХТ, используемую для лечения МРЛ [46].
В настоящее время разрабатываются новые подходы, направленные на блокирование вторичных мутаций и альтернативных сигнальных путей за счет комбинации таргетных препаратов и разработки новых, таких как осимертиниб [47].
Клинически прогрессирование на ИТК можно разделить на несколько типов [48]:
- Появление множества новых быстрорастущих образований (системное прогрессирование).
- Появление новых медленноувеличивающихся образований.
- Появление единственного нового или рост только одного образования (олигопрогрессирование).
- Изолированное прогрессирование в головном мозге (рис. 5).
Клиническое течение заболевания после диагностики прогрессирования напрямую влияет на выбор лечебной тактики. Быстрое лавинообразное прогрессирование требует немедленной смены режима терапии.
При медленном, бессимптомном прогрессировании можно рассмотреть вариант продления приема ИТК до момента, когда объем опухолевой массы начинает угрожать появлением симптомов болезни, или появлением явных признаков ускорения прогрессирования заболевания. При появлении единственного прогрессирующего очага возможно проведение локального лечения (хирургическое или лучевая терапия) с продолжением терапии ИТК. Изолированное прогрессирование в головном мозге может объясняться недостаточной способностью препаратов проникать через гемато-энцефалический барьер. В этом случае возможно проведение локального лечения метастазов в головном мозге с продолжением терапии ИТК. Подобный клинический подход был оценен Weickhardt и соавт. Были исследованы 38 пациентов ALK (Anaplastic lymphoma kinase)+НМРЛ, получавших лечение кризотинибом, и 27 с мутацией EGFR, получавших эрлотиниб. Медиана времени до прогрессирования на кризотинибе составила 9, на эрлотинибе – 13,8 месяца. Из 51 25 пациентам было возможно проведение локального лечения. Лучевая терапия проведена в 24 случаях, в 1 – хирургия. Медиана времени для повторного прогрессирования (ВБП-2) – 6,2 месяца [49].
Клинический пример 3
Больная 76 лет. Никогда не курила. Диагноз: периферический рак (аденокарцинома) T4N2M1b с множественными метастазами в обоих легких. Больной было проведено 5 курсов ХТ по схеме карбоплатин AUC-5, паклитаксел 135 мг/м2. В результате проведенного лечения достигнут частичный регресс опухоли. Длительность ответа составила 11 месяцев. Выполнено молекулярно-генетическое исследование, выявлена мутация в 19-м экзоне EGFR. Пациентке начата таргетная терапия эрлотинибом в дозе 150 мг/сут. Достигнут полный регресс первичной опухоли и метастазов (рис. 6).
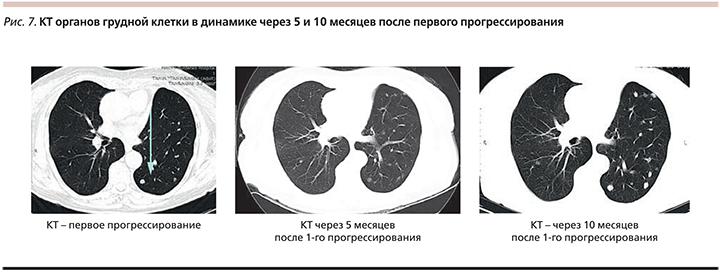
Длительность ответа составила 23 месяца, когда впервые было обнаружено прогрессирование опухолевого процесса – появление метастазов в левом легком. Больной продолжена терапия эрлотинибом. При тщательном мониторировании течения опухолевого процесса, по данным КТ (каждые 2 месяца), у больной отмечено очень медленное увеличение размеров и незначительное нарастание числа очагов в легких без проявления симптомов болезни (рис. 7).
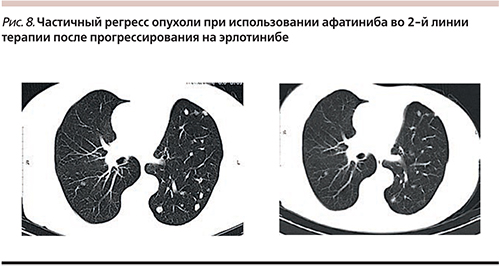
Через 10 месяцев после первого прогрессирования, учитывая нарастание опухолевой массы, принято решение о смене терапии. С учетом возраста, сопутствующей патологии и наличия у больной мутации в 19-м экзоне принято решение о проведении терапии афатинибом. Через 4 месяца терапии достигнут частичный регресс опухоли (рис. 8).
Заключение
- Не все мутации EGFR одинаковы.
- Эффективность ИТК зависит от локализации мутации. Редкие мутации в 18-м и 20-м экзонах могут отвечать на терапию ИТК первого поколения.
- При опухолях с «классическими» мутациями в первой линии терапии ИТК эффективнее ХТ в отношении ВБП и частоты ОО.
- Добавление бевацизумаба к первой линии терапии (ХТ или эрлотиниб) увеличивает ВБП, уровень ОО, ОВ.
- Клинические предикторы (женский пол+аденокарцинома, никогда не курившие больные) позволяют эффективно идентифицировать пациентов, способных отвечать на терапию эрлотинибом.
- Необходимо учитывать характер прогрессирования в выборе лечебной тактики после прогрессирования на фоне ИТК.


