Введение
Согласно мировой статистике в 2018 г., немелкоклеточный рак легкого (НМРЛ) сохраняет лидирующую позицию в структуре онкологической заболеваемости, составляя 11,6% от всех новых случаев злокачественных новообразований. Показатели летальности от НМРЛ также являются наиболее высокими, превышая 18% от всех смертельных исходов, вызванных злокачественными опухолями [1].
Нерешенная проблема раннего выявления НМРЛ обусловливает возможность выполнения радикального хирургического вмешательства лишь у 20–30% впервые диагностированных пациентов. К сожалению, хирургическое лечение не позволяет избегать развития рецидивов и отдаленных метастазов у 30–70% больных. Пятилетняя выживаемость остается крайне неудовлетворительной, варьируясь от 60% при IA до 20% при IIIA- стадии НМРЛ [2].
Попытки элиминации микрометастазов с помощью периоперационной цитостатической терапии платиносодержащими дуплетами обеспечивают улучшение показателей общей выживаемости (ОВ) на 4–5% по сравнению с радикальным хирургическим лечением. Однако высокая частота побочных эффектов 3-й степени, превышающая 60%, значительно ограничивает рутинное применение периоперационной химиотерапии (ХТ). Таким образом, необходимость поиска новых терапевтических подходов для больных ранними стадиями НМРЛ не вызывает сомнений и стимулирует активное изучение данной проблемы [2].
Высокая эффективность ингибиторов иммунных точек контроля (ИИТК) в лечении распространенного НМРЛ обусловила проведение ряда клинических исследований в отношении резектабельных стадий данного заболевания. Исследования последних лет продемонстрировали существование иммуносупрессивного микроокружения опухоли уже при I стадии НМРЛ, что позволяет ожидать высокого терапевтического потенциала ИИТК при их назначении на предоперационном этапе [3].
Возможные преимущества и недостатки неоадъювантной иммунотерапии (НАИТ)
Привлекательность проведения НАИТ определяется рядом факторов. В первую очередь к ним относятся уменьшение стадии заболевания по критериям TNM и увеличение возможности выполнения R0-резекции. Не менее значимыми факторами являются элиминация микрометастазов, оценка эффективности ИИТК in vivo, а также увеличение выживаемости без прогрессирования (ВБП) и ОВ. К основным аргументам применения ИИТК в предоперационном периоде относится наличие интактной первичной опухоли, являющейся источником неоантигенов. Наличие различных опухолевых антигенов необходимо для формирования стойкого противоопухолевого иммунного ответа и механизмов иммунологической памяти. Активированные цитотоксичные CD8+-T-лимфоциты, вызывая повреждение клеток опухоли, обеспечивают высвобождение еще большего числа неоантигенов. Сохранение нативных структур перитуморальной лимфатической системы также обеспечивает возможность эффективного взаимодействия между опухолью и иммунной системой. Кроме того, предполагается, что активированные Т-клетки, высвобождаясь в кровеносные и лимфатические сосуды, могут эффективно воздействовать на микрометастазы.
К преимуществам неоадъювантного применения ИИТК относится и возможность патоморфологического исследования удаленной опухоли и регионарных лимфатических узлов с целью оценки эффективности проведенного лечения in vivo для каждого пациента, что позволяет максимально персонализировать его лечение [3, 4].
Сохраняется ряд нерешенных вопросов в отношении НАИТ. В первую очередь недоказанной остается возможность увеличения показателей БРВ и ОВ больных, подвергавшихся предоперационной иммунотерапии. Во-вторых, существует опасность значительной отсрочки радикального хирургического лечения из-за развития клинически значимых иммуноопосредованных нежелательных явлений (ИоНЯ), таких как гепатит, пульмонит, эндокринные или неврологические осложнения. Возможно повышение риска осложнений оперативного вмешательства. Кроме того, существует определенная вероятность первичной резистентности опухоли к ИИТК, которая может повлечь за собой невозможность выполнения радикальной операции из-за прогрессирования злокачественного процесса. Также следует помнить о риске «перелечивания» при назначении НАИТ всем пациентам без учета индивидуальных характеристик опухоли и больного. Открытыми остаются вопросы оптимальной оценки эффективности НАИТ и выявления прогностических и предиктивных биомаркеров. Таким образом, глубокое и всестороннее изучение эффективности и безопасности НАИТ с целью обеспечения максимальной клинической пользы для определенных когорт пациентов остается крайне актуальным разделом современной онкологии [3, 4].
Завершенные клинические исследования II фазы
1. Монотерапия ИИТК
Первым проспективным клиническим исследованием эффективности и безопасности НАИТ II фазы было CheckMate-159, проведенное P. Forde et al. [5]. Результаты данного пилотного исследования эффективности двух введений ниволумаба с интервалом в 2 недели были представлены в 2018 г. В 2015–2016 гг. 22 пациента с резектабельными стадиями НМРЛ (IB-, II-, IIIA-стадии) получили не менее одного введения препарата в дозе 3 мг/кг массы тела. Выполнение радикального хирургического вмешательства планировалось не позднее 4 недель после первой инфузии ниволумаба. Развитие умеренной иммуноопосредованной токсичности было отмечено у 5 (23%) из 22 больных, не сопровождалось отсрочкой оперативного лечения. При выполнении стандартной оценки эффективности НАИТ по системе RECIST у 2 (10%) пациентов был зарегистрирован частичный регресс, у 18 (86%) – стабилизация и у 1 (5%) – прогрессирование НМРЛ. Из 20 больных, подвергшихся радикальному хирургическому лечению, уменьшение стадии заболевания по данным патоморфологического исследования определялось у 8 (40%). Большой патоморфологический ответ (БПО), характеризующийся сохранением не более 10% жизнеспособных опухолевых клеток, был отмечен в 45% случаев (у 9 из 20 пациентов). Трое больных имели полный патоморфологический ответ (ППО). В первичных опухолях с БПО при патоморфологическом исследовании определялась выраженная лимфоцитарная и макрофагальная инфильтрация наряду с признаками некроза и фиброза. Следует отметить, что БПО отмечался как в PD-L1-позитивных, так в PD-L1-негативных опухолях. В то же время в данном исследовании достижение БПО чаще ассоциировалось с высокими показателями мутационной опухолевой нагрузки ТМВ (Tumor mutational burden). Авторы описали характерное для ИИТК отсутствие корреляции данных радиологического и патоморфологического исследований. Так, несмотря на увеличение размеров первичной опухоли и/или регионарных лимфатических узлов по данным предоперационной компьютерной томографии, у двух пациентов были зарегистрированы БПО и ППО. БРВ больных через 12 месяцев наблюдения составило 80%, через 18 – 73%, через 24 месяца – 69%.
Результаты сходного по дизайну исследования LCMC3 (2 введения атезолизумаба с последующим радикальным хирургическим вмешательством) 101 больного НМРЛ I–IIIA-стадий были представлены на ASCO-2019. По данным радиологического исследования, в 7% случаев был отмечен частичный регресс, в 88% – стабилизация, в 5% – прогрессирование заболевания. Также обращало на себя внимание отсутствие ассоциации между радиологическими и патоморфологическими данными: частота БПО составила 18%, ППО – 5%. В данном исследовании в отличие от CheckMate-159 высокий уровень экспрессии PD-L1 (≥50%) коррелировал с достижением ответа [6].
НАИТ пембролизумабом в клиническом исследовании II фазы ТОР1501 наряду с приемлемым профилем токсичности обеспечила достижение БПО у 28% больных IB–IIIA-стадий НМРЛ [7].
2. Комбинация ИИТК и платиносодержащих дуплетов
Синергизм цитостатиков и ИИТК отчетливо реализуется при применении комбинации препаратов в лечении распространенных стадий НМРЛ. Повреждение клеток опухоли сопровождается высвобождением неоантигенов, уменьшением продукции иммуносупрессирующих субстанций и стимуляцией экспрессии PD-L1, т.е. обеспечивает благоприятные условия для формирования иммунного ответа с помощью ИИТК.
Высокий терапевтический потенциал данной лечебной опции подтверждается многообещающими результатами многоцентрового исследования II фазы NADIM, в котором изучалась эффективность и безопасность комбинации карбоплатина, паклитаксела и ниволумаба с последующей адъювантной терапией ниволумабом в течение 12 месяцев больных НМРЛ IIIA-стадии. Уменьшение стадии НМРЛ удалось достичь в 93% случаев. Сорок один (89%) из 46 пролеченных пациентов подвергся радикальному хирургическому лечению в объеме R0-резекции. Ни в одном из случаев не было отмечено отсрочки или невозможности выполнения оперативного лечения из-за ИоНЯ или прогрессирования заболевания. У подавляющего числа участников (34/83% из 41 больного) исследования были зарегистрированы ППО и БПО (ППО у 24/71% из 41 больного). Аналогично исследованиям НАИТ в монорежиме не выявлено корреляции между данными радиологической и патоморфологической оценок эффекта. ОВ больных при медиане наблюдения 18 месяцев составила 93,5% [8].
3. Комбинация ИИТК
Результаты исследования II фазы NEOSTAR были представлены на ASCO-2019. Сорок четыре пациента с резектабельным НМРЛ I–III стадий были рандомизированы в 2 группы, получавших НАИТ (23 больных – ниволумаб, 21 больной – комбинацию ниволумаба и ипилимумаба). Общая частота БПО и ППО составила 25% (17% в группе монотерапии ниволумабом и 33% в группе комбинированной терапии). ППО был зарегистрирован в 18% случаев (9% в группе монотерапии ниволумабом, 29% в группе комбинированной терапии). У 20% пациентов отмечено достижение объективного ответа (по системе RECIST – Response evaluation criteria in solid tumours). По результатам настоящего исследования большая эффективность НАИТ коррелировала с высокой экспрессией PD-L1. НАИТ не оказывала негативного влияния на сроки выполнения радикального оперативного вмешательства и течение послеоперационного периода [9].
Текущие клинические рандомизированные исследования III фазы
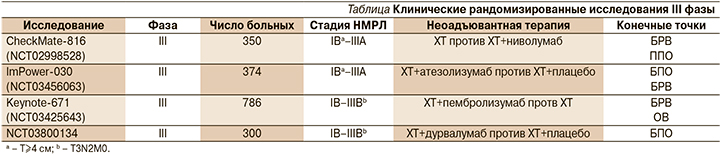
Многообещающие результаты клинических исследований II фазы стимулировали дальнейшее изучение возможностей НАИТ в ходе крупных рандомизированных исследований, конечными точками которых являются как ВБП и ОВ, так и БПО в качестве суррогатного маркера выживаемости (см. таблицу). Получение окончательных результатов ожидается не ранее 2025 г. [4].
Нерешенные вопросы НАИТ: оценка эффективности и безопасности, поиск суррогатных маркеров
Безусловным подтверждением эффективности НАИТ является увеличение ОВ больных резектабельными стадиями НМРЛ. Однако использование показателя ОВ в качестве основной конечной точки клинического исследования весьма проблематично, т.к. требует включения большого числа пациентов и значительного, зачастую многолетнего периода наблюдения для выявления достоверных различий между изучаемыми группами.
С целью оптимизации процесса изучения новых лекарственных препаратов в неоадъювантном режиме производится поиск суррогатных конечных точек, не требующих длительного наблюдения и коррелирующих с показателями ОВ. В исследованиях НАИТ подобными суррогатными маркерами эффективности являются ППО и БПО. Так, в исследовании NEOSTAR достижение объективного ответа (по системе RECIST) коррелировало с частотой БПО (p≤0,001).
Как уже отмечалось ранее, уникальный механизм действия ИИТК сопровождается несоответствием между радиологическим и патологическим ответами на НАИТ. Такие варианты радиологических ответов, как псевдопрогрессирование или длительная стабилизация с отсроченным уменьшением размеров таргетных очагов, значительно затрудняют применение традиционного метода компьютерной томографии для объективной оценки эффекта НАИТ и планирования хирургического этапа лечения. Напомним, что в исследовании СheckМate-159 частота объективного ответа по системе RECIST составила всего 10%, в то время как частота БПО достигла 45%. С целью оптимизации оценки ответа опухоли на применение ИИТК разработаны критерии irRECIST. Ряд экспертов считают, что предпочтительным методом визуализации является ПЭТ-КТ (Позитронно-эмиссионная компьютерная томография), отражающая пролиферативную активность и резидуальный объем жизнеспособной опухолевой ткани [10]. Не вызывает сомнений необходимость дальнейших исследований для подтверждения возможности использования таких показателей, как БПО, ППО, критерии irRECIST или ПЭТ-КТ, в качестве суррогатных маркеров БРВ и ОВ больных, подвергшихся НАИТ.
Второй крайне важной задачей, стоящей перед исследователями НАИТ, является идентификация предиктивных биомаркеров. Список потенциальных предикторов ответа включает такие биомаркеры, как уровень экспрессии PD-L1, опухолевая мутационная нагрузка (TMB), дефицит системы репарации неспаренных оснований dMMR (mismatch repair deficiency), микросателлитная нестабильность (MSI), ряд специфичных сигнальных путей (например, NRAS/KRAS), наличие иммунных клеток с специфическим фенотипом (например, TIL, T-reg), биомаркеры, ассоциированные с жидкостной биопсией (циркулирующие CD45/CD8+-Т-лимфоциты, циркулирующие опухолевые клетки – СТС, циркулирующая опухолевая ДНК – ctDNA), ряд других циркулирующих молекулярных субстанций (экзосомы, цитокины, факторы воспаления) [11]. В частности, в исследовании II фазы NEOSTAR было показано, что пациенты, ответившие на НАИТ, имели более высокий уровень экспрессии PD-L1 до начала лечения по сравнению с пациентами, не достигшими ответа (p=0,015). В то же время результаты ряда других исследований (CheckMate 159, LCMC3) отрицают наличие корреляции частоты БПО с уровнем экспрессии PD-L1, тем самым демонстрируя сохранение ограничений использования данного параметра в качестве эффективного предиктора эффекта НАИТ.
Многообещающей методикой неинвазивного мониторирования эффекта НАИТ представляется жидкостная биопсия. В исследовании CheckMate-159 была определена корреляция между достижением БПО и экспансией опухоль-специфических Т-лимфоцитов в кровяное русло. Кроме того, авторы обнаружили уменьшение числа активированных Т-клеток в периферической крови пациентов с отсутствием БПО или прогрессированием заболевания. Таким образом, содержание опухоль-специфических Т-лимфоцитов в периферической крови может служить потенциальным предиктивным биомаркером при проведении НАИТ.
Циркулирующая ДНК (ctDNA) определяется в периферической крови у 50–95% больных резектабельным НМРЛ, что позволяет предполагать возможность динамического контроля ее уровня для предсказания эффективности НАИТ. Сочетание элиминации ctDNA и экспансии опухоль-специфических Т-лимфоцитов в периферическую кровь, по-видимому, может отражать реализацию эффекта предоперационной терапии ИИТК на доклиническом этапе [12]. Однако убедительных доказательств наличия корреляции между уровнями ctDNA и опухоль-специфических Т-клеток в периферической крови и БПО и/или показателями выживаемости больных до настоящего времени не получено. Кроме того, рутинное применение данной методики лимитировано высокой вероятностью технических погрешностей, связанных со сбором образцов крови, условиями ее хранения, скоростью центрифугирования и т.п.
Заключение
Не вызывает сомнений представление о том, что неоадъювантная терапия ИИТК открывает новую эру лечения больных резектабельными стадиями НМРЛ. Полученные к настоящему времени результаты клинических исследований II фазы демонстрируют возможность достижения БПО у 22–45% больных, получающих ИИТК, и у 50–83% больных, получающих комбинации цитостатиков и ИИТК. Обнаруженное в пилотных исследованиях сочетание высокой эффективности и приемлемого и управляемого профиля токсичности НАИТ обусловило инициацию многоцентровых рандомизированных клинических исследований III фазы [13]. Ожидается, что анализ результатов проводимых в настоящее время исследований сможет дать ответы на ряд нерешенных вопросов относительно предоперационного назначения ИИТК. К числу подобных вопросов относятся выбор оптимального режима и длительности неоадъювантной терапии, сроки выполнения и объем хирургического вмешательства, минимизация рисков отсрочки оперативного лечения из-за сохранения ИоНЯ, идентификация надежных прогностических и предиктивных факторов, выделение целевой когорты больных, имеющих наибольшую пользу от проведения НАИТ. Решение поставленных задач позволит существенно улучшить результаты лечения больных НМРЛ на ранних стадиях [14, 15].


