Вработе CORE-2016 – VII Ежегодной международной конференции экспертов в области почечно-клеточного рака (Conference Of Renal cancer Expert) приняли участие известные ученые и специалисты из крупных научных центров, лабораторий и организаций Австра-лии, Бразилии, Великобритании, Германии, Греции, Испании, Италии, Канады, Нидерландов, России, США, Франции, Швейцарии, Южной Кореи и Японии. Общее число участников конференции превысило 300 человек, и CORE-2016 прошла в полном соответствии с научной программой. Общее количество докладов, представленных на конференции, составило 24, включая 11 пленарных и 13 секционных. Россию представляла докт. мед. наук М.И. Волкова (Москва, ФГБНУ «РОНЦ им. Н.Н. Блохина»), возглавившая сессию по периоперационной терапии пациентов с метастатическим почечно-клеточным раком (мПКР), доклад которой вызвал неподдельный научный интерес.
Работа конференции охватывала такие проблемы ПКР, как таргетная терапия, новые иммунотерапевтические подходы к лечению, биомаркеры, коррекция побочных осложнений, качество жизни пациентов, лучевая терапия в комбинации с системной. Особое внимание было уделено важности взаимодействия между хирургами, клиницистами и лучевыми терапевтами. Конференция продемонстрировала участникам реальный уровень лекарственного обеспечения при ПКР и проблематику, связанную с разработкой новых препаратов и внедрением их в клиническую практику во всем мире.
В рамках программы конференции были сделаны следующие доклады:
1. Профессор Bernard Escudier (Institut Gustave Roussy, Франция) отметил эволюцию, произошедшую за последние годы в плане иммунотерапевтического подхода к лечению мПКР (от интерлейкина-2 до ингибиторов чекпоинтов с вакцинами). Таргетная терапия позволила значительно улучшить результаты лечения, но не позволяет достигать полного ответа и в конечном итоге способствует развитию резистентности. Большие надежды связывают с новыми иммунотерапевтическими подходами (ингибиторы чекпоинтов/вакцины), особенно в комбинации с таргетными препаратами. Однако добавление вакцины IMA901 к сунитинибу в первой линии терапии мПКР не улучшило отдаленные результаты (IMPRINT phase 3 clinical trial, NCT01265901).
2. Профессор David McDermott (Harvard Medical School, США) осветил вопросы в области иммунотерапии мПКР, не получившие на данный момент ответа. В частности, они касались эффективности и безопасности применения комбинаций ингибиторов чекпоинтов и таргетных препаратов.
В исследовании I фазы CheckMate-016 по изучению комбинаций ниволумаба с сунитинибом, пазопанибом и ипилимумабом проводилась оценка комбинации ниволумаба (N) и ипилимумаба (I) в различных дозовых режимах: N 3 мг/кг+I 1 мг/кг (N3+I1), N 1 мг/кг+I 3 мг/кг (N1+I3) или N 3 мг/кг+I 3 мг/кг (N3+I3). Комбинация (N+I) позволяет повышать эффективность лечения, увеличивая при этом токсичность. Набор пациентов в группу (N3+I3) был прерван из-за крайне высокой токсичности. Объективный ответ и медиана времени без прогрессирования в группах (N3+I1) и (N1+I3) составили 38 и 43%, 33 и 36 недель соответственно. Токсичность 3–4-й степеней отмечена в 34 и 64% случаев соответственно. В основном токсичность была представлена колитами, диареей, повышением уровней АЛТ, АСТ, липазы, амилазы (NCT01472081). Необходимо дальнейшее изучение данных режимов. Исследование I фазы, продемонстрировавшее эффективность и переносимость комбинации атезолизумаба (анти-PD-L1) и бевацизумаба, способствовало проведению исследования III фазы по сравнению комбинации данных препаратов с сунитинибом (NCT02420821). Также проводится исследование III фазы по сравнению комбинации авелумаба (анти-PD-L1) и акситиниба с сунитинибом (NCT02684006). Предварительные результаты I–II фаз исследования комбинации пембролизумаба и пазопаниба продемонстрировали высокую гепатотоксичность, необходим поиск другого режима. В то же время комбинация акситиниба и пебролизумаба продемонстрировала высокую эффективность и приемлемую токсичность (исследование Ib-фазы) [1]. Для разработки новых препаратов интерес представляют такие мишени, как TIM3 (T-cell immunoglobulin, mucin domain) и Lag3 (агонист MHCII), играющие ключевую роль в регуляции иммунного ответа.
3. Проф. Sumanta Pal (City of Hope, США) описал некоторые молекулярные характеристики ПКР, такие как ассоциация папиллярного ПКР I типа с альтерациями гена MET, папиллярного ПКР II типа – c NRF2-ARE и потерей гена CDKN2A [2]. При раке из собирательных трубочек наличие геномных альтераций NF2 может быть ассоциировано с чувствительностью к эверолимосу, а геномных альтераций SMARCB1 – с чувствительностью к ингибитору EZH2 [3]. В ходе исследования RECORD 3 по сравнению сунитиниба и эверолимуса в 1-й и 2-й линиях было проведено незапланированное изучение корреляции времени без прогрессирования и геномных альтераций в опухоли до начала лечения. Выявлена предиктивная значимость генов KDM5C и PBRM1 для сунитиниба и эверолимуса соответственно. Также установлено отрицательное прогностическое значение BAP1 на фоне как сунитиниба, так и эверолимуса [4]. Прогностическое значение имеют активационные мутации m-TOR и инактивационные мутации TSC1/2 на фоне ингибиторов m-TORС1 [5]. Высокий соматический мутационный статус коррелирует с лучшим ответом на ниволумаб, что может быть объяснено появлением неоантигенов и MANAs и влиянием на микроокружение опухоли. Мутационный статус неоантигенов и MANAs обладает предиктивной значимостью для ответа на ниволумаб [6]. Сунитиниб увеличивает уровень AXL в ткани ПКР. Повышенная экспрессия AXL и MET коррелирует с худшими показателями общей выживаемости. Ингибиторы AXL и MET могут помочь в преодолении резистентности вследствие длительного приема сунитиниба [7]. Activin receptor-like kinase 1 (ALK1) – новая мишень ангиогенеза, вовлеченная в созревание и стабилизацию сосудов. В настоящий момент проходит рандомизированное исследование II фазы (DART) по изучению комбинации далантерцепта – белка, связывающего рецептор ALK1, с акситинибом и акситинибом в монорежиме у больных мПКР [8].
4. Проф. Robert Motzer (MSKCC, США) отметил существенный недостаток в прогностической модели Heng и соавт. (IMDC). А именно отсутствие в исследовании когорты пациентов, леченных пазопанибом, поскольку на момент исследования (2009) данный препарат не был еще зарегистрирован. Испанские ученые провели исследование SPAZO, которое подтвердило валидизированность данной модели относительно пациентов, получавших пазопаниб. Также был отмечен лучший токсический профиль пазопаниба относительно сунитиниба, что было подтверждено в исследовании PISCES.
5. Профессор Thomas Powles (Barts Cancer Institute, Великобритания) указал на важность титрования дозы препаратов для достижения большей эффективности и лучшей переносимости. Как было показано Rini и соавт., показатели общей выживаемости значительно выше в группе с титрованием дозы акситиниба, чем в группе фиксированной дозы акситиниба: 42,7 против 30,0 месяцев [9].
6. Проф. Michael Staehler (Ludwig Maximilians University Munich, Германия) доложил результаты применения стереотаксической радиохирургии в отношении пациентов с ПКР. Как известно, ПКР является радиорезистентной опухолью. Однако при подаче высоких фракционных доз значимость стереотаксической радиохирургии (SBRT) значительно возрастает при ведении пациентов как с первичным очагом, так и с олигометастатическим процессом (интакраниальным и экстракраниальным). Радиочувствительность SBRT основана на церамидном пути, который активируется только при подаче высоких фракционных доз [10].
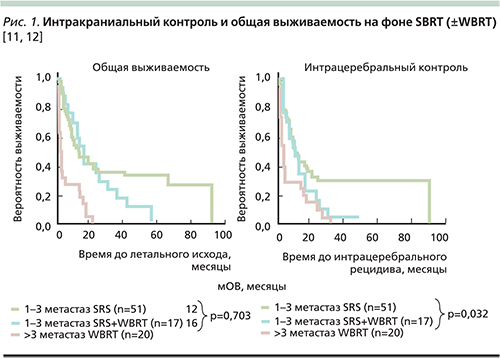
Помимо прямого эффекта SBRT может индуцировать иммунологически опосредованный абскопальный эффект, который может возрасти при комбинировании с таргетными препаратами. В настоящий момент проводится ряд проспективных исследований в данном направлении. SBRT улучшает локальный контроль по сравнению со стандартными фракционными схемами. Добавление облучения всего головного мозга к SBRT позволяет улучшать интракраниальный контроль, но не повышает общую выживаемость (рис. 1).
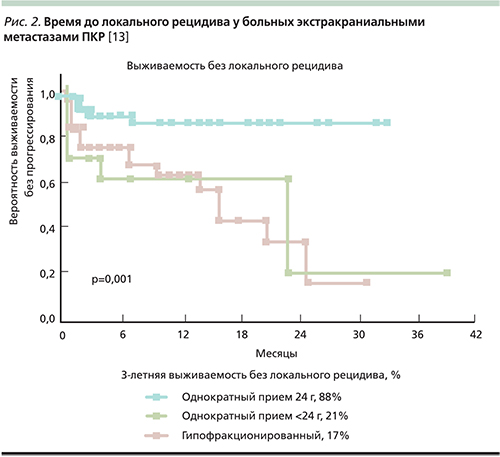
SBRT позволяет также продлевать время до локального рецидива (Local Relapse-Free Survival, LRFS) у больных с экстракраниальными проявлениями ПКР (рис. 2). При этом многофакторный анализ позволил определить предикторы повышения LRFS: высокие однократные дозы (24 против <24 Гр), однократные дозы против гипофракционирования.
В заключение следует отметить, что представленные на конференции доклады продемонстрировали важность мультидисциплинарного подхода к решению проблем в области ПКР.



