Сосудистые заболевания головного мозга представляют собой одну из наиболее актуальных проблем клинической неврологии. Согласно эпидемиологическим исследованиям, заболеваемость инсультом среди взрослого населения России – одна из самых больших в мире и составляет 3,4 новых случаев на 1000 населения в год. В нашей стране инсульт находится на втором месте среди причин смертности, уступая лишь сердечно-сосудистой патологии. Среди выживших исключительно велика доля пациентов, частично или полностью утративших трудоспособность и самостоятельность в быту. В России инсульт является наиболее частой причиной развития стойкой инвалидизации: 31% пациентов, перенесших инсульт, нуждаются в посторонней помощи, еще 20% не могут самостоятельно ходить и лишь 8% могут вернуться к прежней работе [1, 2].
Не менее велика встречаемость и клиническая значимость хронических форм нарушений мозгового кровообращения. Как известно, сосудистая деменция находится на втором месте после болезни Альцгеймера и отвечает за 10–25% случаев слабоумия в пожилом возрасте [3, 4]. Учитывая, что распространенность слабоумия в пожилом и старческом возрасте – не менее 5–10% [4, 5], можно сделать вывод, что 0,5–2,5% лиц старше 60 лет страдают сосудистой деменцией. При этом следует учитывать, что деменция – это наиболее поздние стадии хронического сосудистого поражения головного мозга. Почти всегда деменции предшествуют менее тяжелые (недементные) когнитивные расстройства, частота которых в 2–3 раза больше частоты деменции [6, 7]. Таким образом, можно предположить, что распространенность хронических форм нарушений мозгового кровообращения может достигать 10% среди лиц старше 60 лет.
В патогенезе как острых, так и хронических нарушений мозгового кровообращения основную роль играют ишемические механизмы. Согласно статистике, ишемический инсульт (ИИ) развивается в 3–4 раза чаще геморрагического [1, 2]. Хроническая ишемия головного мозга представляет собой один из ведущих механизмов формирования хронического сосудистого прогрессирующего безынсультного поражения головного мозга (дисциркуляторной энцефалопатии), хотя нередко сочетается с повторными церебральными микрокровоизлияниями. Учитывая общность патогенетических механизмов, некоторые подходы к ведению пациентов с острой и хронической церебральной ишемией могут и должны быть единообразными.
Принципиально существует две основные терапевтических стратегии преодоления ишемии и гипоксии головного мозга: реперфузия и нейропротекция.
Под реперфузией понимается быстрое, до возникновения необратимых изменений, восстановление кровотока в ишемизированной зоне головного мозга. Данная стратегия наиболее хорошо себя зарекомендовала в лечении ИИ.
Нейропротекция представляет собой создание метаболической защиты головного мозга от ишемии и гипоксии с помощью препаратов, влияющих на конечные механизмы непосредственного повреждения нейронов и повышающих выживаемость нейронов в неблагоприятных условиях.
Острые нарушения мозгового кровообращения
Главным патогенетическим событием острого нарушения головного мозга по ишемическому типу является закупорка по той или иной причине церебральной артерии, что приводит к локальному снижению перфузии.
В норме за 1 минуту через 100 мл мозгового вещества протекает 60–80 мл крови. Этот показатель представляет собой жесткую константу, которая поддерживается различными нейрофизиологическими механизмами (ауторегуляция мозгового кровотока). Как известно, нейроны головного мозга не имеют запасов глюкозы и кислорода, поэтому даже кратковременное снижение церебральной перфузии ниже 60 мл/100 мл мозгового вещества в минуту вызывает функциональный паралич нейронов. При этом снижение показателя перфузии ниже 10–15 мл/100 мл мозгового вещества в минуту приводит к прямой аноксической деполяризации нейрональных мембран и быстрой, в течение 5–10 минут, гибели нейронов по механизму некроза [8].
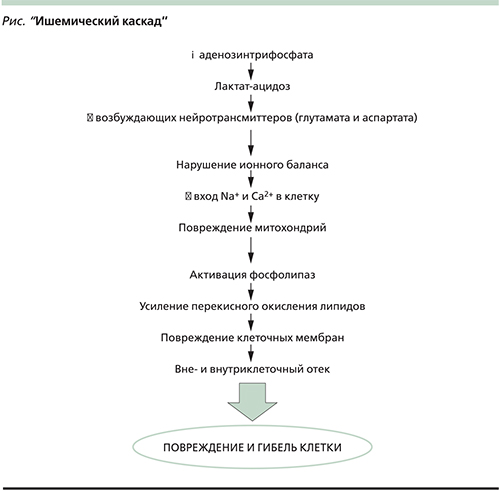
Некротизированные нейроны составляют т.н. ядерную зону ишемии, которая обычно относительно невелика. Ядерная зона ишемии окружена пенумброй (зона ишемической полутени), которая в несколько раз превышает по объему ядерную зону. В зоне ишемической полутени церебральная перфузия снижается менее 60 мл, но более 10–15 мл на 100 мл мозгового вещества в минуту. В данной зоне необратимые изменения в нейронах развиваются по механизму апоптоза в результате сложной цепи последовательных патологических реакций на клеточном уровне (см. рисунок). Этот процесс растянут во времени и занимает 6–12 часов [8]. Таким образом, в течение первых часов после закупорки церебральной артерии бóльшая часть нейронов ишемизированного очага сохраняет жизнеспособность. Целью как реперфузионной, так и нейропротективной терапии является уменьшение степени повреждения и повышение выживаемости нейронов зоны ишемической полутени, соответственно уменьшение зоны необратимого ишемического повреждения (инфаркта) мозга и остаточного неврологического дефицита.
В настоящее время реперфузионная терапия в остром периоде ИИ полностью доказала свою эффективность. Внутривенное введение активатора тканевого плазминогена в первые 3–4,5 часа после возникновения нейроваскулярного синдрома достоверно снижает выраженность остаточного неврологического дефекта. Разработаны также методики внутриартериального тромболизиса и хирургической экстракции тромба. Внутриартериальный тромболизис более сложен с технической точки зрения, т.к. требует ангиографического контроля. Его проводят в специализированных центрах, обычно при неэффективности внутривенного введения тромболитического препарата. По мнению ряда авторов, внутриартериальный тромболизис может быть эффективным за пределами 4,5-часового терапевтического окна, однако это нуждается в дальнейших подтверждениях. Хирургическая экстракция тромба проводится при наличии соответствующей технической оснащенности у пациентов с закупоркой проксимальных отделов крупных церебральных артерий [1, 2].
В то время как эффективность реперфузионной терапии ИИ в настоящее время абсолютно доказана и ни у кого не вызывает серьезных сомнений, результаты исследований возможных нейропротективных стратегий оказались противоречивыми. Теоретически точкой приложения нейропротективной терапии может стать одна или несколько из последовательных патологических реакций на клеточном уровне, приводящих к апоптозу нейронов зоны ишемической полутени (т.н. ишемический каскад, см. рисунок). Нейропротективная терапия призвана остановить или замедлить указанные реакции. Однако очевидно, что нейропротективная терапия сама по себе (без реперфузии) не способна поддерживать жизнеспособность нейронов всю оставшуюся жизнь. На фоне нейропротективных препаратов более реалистично рассчитывать на увеличение терапевтического окна или на повышение клинической эффективности реперфузионной терапии.
Исходя из современных представлений об основных событиях т.н. ишемического каскада [8], нейропротективные свойства ожидаемы от представителей следующих фармакологических групп:
- блокаторы НМДА(N-метил-D-аспартат)-рецепторов к глутамату;
- блокаторы кальциевых каналов;
- антиоксиданты;
- мембранопротективные препараты.
Нейропротективный эффект указанных препаратов ожидаем в первые часы после развития церебральной ишемии, до возникновения необратимых изменений.
К сожалению, результаты проведенных к настоящему времени клинических исследований не смогли окончательно убедить международное научное сообщество в нейропротективных свойствах какого-либо конкретного лекарственного препарата. Однако за последние 15–20 лет большое внимание врачей и исследователей привлекает препарат с мембранопротективным эффектом цитиколин. Данный препарат прошел ряд весьма серьезных и организованных по всем правилам доказательной медицины клинических исследований, а также успешно применяется на практике у пациентов в остром и восстановительном периодах инсульта.
Цитиколин (цитидин-5-дифос-фохолин) является аналогом эндогенного вещества, которое служит источником для синтеза фосфолипидов клеточных, в т.ч. нейрональных, мембран: фосфатидилхолина, сфингомиелина, а также основного структурного фосфолипида внутренней мембраны митохондрий – кардиолипина. Как известно, целостность клеточной мембраны является главным залогом ее жизнеспособности: различные неблагоприятные воздействия приводят к гибели клетки, нарушая целостность ее мембраны. На фоне поступления экзогеннного цитиколина активируется синтез нейрональных мембран, т.е. репаративный процесс, противостоящий повреждению клетки. Таким образом, использование цитиколина позволяет изменить существующее соотношение сил между повреждающим воздействием и репаративным процессом в пользу нейрорепарации.
Экспериментальные работы (in vitro) подтвердили мембранопротективный эффект цитиколина. Было показано, что на фоне использования данного препарата действительно повышается выживаемость нейронов в условиях ишемии и гипоксии.
К настоящему времени опубликованы результаты нескольких крупных международных рандомизированных исследований применения цитиколина в остром и раннем восстановительном периодах инсульта. Так, в работе W.M. Clark и соавт. (1997) 259 пациентов с ИИ получали данный препарат перорально в различных дозах (500, 1000 и 2000 мг/сут) или плацебо в течение 12 недель. Обязательным условием включения был прием первой дозы цитиколина в течение первых суток от возникновения неврологической симптоматики. Было показано, что на фоне использования цитиколина в дозах 500 и 2000 мг/сут выраженность неврологического дефицита и степень инвалидизации были достоверно меньшими по сравнению с плацебо [9]. По данным других авторов (S. Warach и соавт.) на фоне применения цитиколина на 12-й неделе после ИИ уменьшение объема инфаркта мозга, по данным нейровизуализации, отмечалось достоверно чаще, чем на фоне плацебо (61,1 и 53,2% соответственно; р<0,05) [10]. Однако не во всех исследованиях цитиколина при ИИ удалось продемонстрировать влияние данного препарата на выраженность остаточного неврологического дефицита [11].
Наиболее масштабным международным исследованием цитиколина при острой церебральной ишемии был ICTUS (Invasive versus ConservativeTreatment in Unstable Coronary Syndromes). В рамках данного проекта были рандомизированы 2298 пациентов. В группе активной терапии цитиколин применяли в первые 24 часа от возникновения неврологической симптоматики и далее в течение 6 недель в дозе 1000 мг каждые 12 часов. При этом в первые 3 дня пациенты получали цитиколин внутривенно, а далее – перорально. К сожалению, в целом различие между терапевтическими группами после проведенной терапии не достигало статистической значимости, что, вероятно, объясняется значительной гетерогенностью пациентов. В то же время цитиколин достоверно превосходил плацебо у пациентов с нетяжелым инсультом: балл по американской Шкале инсульта Национального института здоровья (NIHSS – National Institute of Health Stroke Scale) менее 14, у лиц старше 70 лет и у пациентов, не получавших тромболитическую терапию. Проведенный впоследствии мета-анализ, включивший 4 проведенных исследования цитиколина при ИИ, подтвердил эффективность данного препарата в отношении функционального восстановления при его применении в начале терапии в первые 24 часа после развития неврологической симптоматики (отношение шансов=1,14, 95% доверительный интервал – 1,0–1,3) [12].
Хроническая недостаточность мозгового кровообращения
Последние десятилетия характеризовались значительной ревизией представлений о патогенетических механизмах, клинических проявлениях и подходах к терапии хронической недостаточности мозгового кровообращения (ХНМК). Прежде избыточное внимание уделялось механическим препятствиям кровотоку из-за атеросклероза магистральных артерий головы или липогиалиноза сосудов небольшого калибра. Сейчас возможность развития хронической церебральной гипоперфузии вследствие указанных причин подвергается все бóльшим сомнениям. В то же самое время накапливаются знания о роли повреждения и дисфункции эндотелия церебральных сосудов. Показано, что связанная с артериальной гипертензией гемодинамическая перегрузка сосудистой стенки, а также такие факторы, как гиперлипидемия, гипергликемия, повышенное содержание никотина, приводят к повреждению и нарушению функции эндотелиоцитов, преобладанию вазоконстрикторных реакций сосудов небольшого калибра и значительному обеднению капиллярного русла. Кроме того, следствием повреждения эндотелия церебральных сосудов, с одной стороны, и высокого перфузионного давления, с другой, может быть повышение проницаемости гематоэнцефалического барьера и пропотевание сыворотки крови в глубинные отделы белого вещества головного мозга. Предполагается, что указанные выше механизмы лежат в основе формирования диффузных изменений белого вещества (лейкоареоза) при артериальной гипертензии и других сосудистых заболеваниях головного мозга [13–18].
Однако развитие синдрома хронического прогрессирующего сосудистого поражения головного мозга связано не только с развитием лейкоареоза. Современные клинико-нейровизализационные сопоставления свидетельствуют, что на каждый симптомный инсульт приходится 4–5 т.н. немых инфарктов. В подавляющем большинстве случаев речь идет о небольших (лакунарных) инфарктах диаметром менее 10–15 мм вследствие гипертензивной или иной микроангиопатии. «Немые» инфаркты развиваются без характерной клиники инсульта, тем не менее не являются полностью бессимптомными. В клинической картине у пациентов с повторными «немыми» инфарктами могут выявляться когнитивные и эмоциональные расстройства, характерные для синдрома «дисциркуляторной» энцефалопатии [19–21].
Исходя из вышеизложенного, использование «сосудорасширяющих» средств для лечения и профилактики ХНМК имеет небольшие перспективы. Более предпочтительной стратегией является уменьшение эндотелиальной дисфункции и снижение риска повторных лакунарных инфарктов.
С этой целью необходимо воздействовать на причины, вызвавшие хроническое цереброваскулярное заболевание, такие как артериальная гипертензия, гиперлипидемия и др. Поэтому задачей первостепенной важности в лечении пациентов с ХНМК является адекватный контроль базисного сосудистого заболевания: проведение по соответствующим показателям антигипертензивной, антитромбоцитарной и гиполипидемической терапии.
В последние годы подверглись значительной ревизии также представления о характерных клинических проявлениях ХНМК. Прежде большое внимание уделялось субъективным неврологическим симптомам (жалобы на головную боль, головокружение, шум в голове и др.), вестибулярным расстройствам и т.н. очаговой микросимптоматике. Однако в настоящее время установлено, что в значительном проценте случаев указанные симптомы не отражают сосудистое заболевание мозга, а связаны с сопутствующей патологией или представляют собой весьма часто встречающийся вариант возрастной нормы [22]. В то же время наиболее надежным коррелятом как очагового, так и диффузного (лейкоареоз) сосудистого поражения головного мозга являются когнитивные нарушения. Их специфическая особенность состоит в преобладании нарушений концентрации и внимания, снижении темпа познавательной деятельности, нарушении управляющих функций (планирование и контроль) при относительной сохранности памяти на текущие события, а также гнозиса и речи [23–25]. Поэтому в качестве основного индикатора эффективности проводимой терапии хронической сосудистой мозговой недостаточности большинство экспертов рассматривают динамику указанных специфических для цереброваскулярной патологии когнитивных симптомов.
К настоящему времени имеется достаточное число подтверждений, что своевременно начатая антигипертензивная терапия способствует уменьшению риска прогрессирования когнитивных нарушений и развития деменции [26–32]. При этом решающее значение имеет возраст начала терапии и длительность ее применения: чем моложе были пациенты в начале наблюдения и чем продолжительнее проводилась терапия, тем более существенно снижался риск деменции [26–32]. В то же время не было показано преимуществ какого-либо определенного класса антигипертензивных препаратов [26–32]. Однако предпочтительны препараты с длительным периодом полувыведения, т.к. они не увеличивают суточной вариабельности АД. Следует также отметить, что, согласно современным рекомендациям, темпы достижения целевых показателей АД могут существенно варьироваться в зависимости от индивидуальной переносимости [33]. Не нужно стремиться к полному контролю артериальной гипертензии у пациентов с гемодинамически значимым стенозом магистральных артерий головы, т.к. повышенный уровень артериального давления в этих случаях может быть рефлекторным ответом на церебральную гипоперфузию.
Эндотелиопротективным действием обладают также гиполипидемические препараты из группы статинов. В настоящее время доказана эффективность данных препаратов для профилактики повторного ИИ. Предполагается также наличие у статинов профилактического действия в отношении прогрессирования когнитивных расстройств. Однако результаты исследования PROSPER (Prospective Study of Pravastatin in the Elderly at Risk) не смогли этого подтвердить [34]. Впрочем, следует отметить, что в цитируемой работе для когнитивного тестирования использовалась краткая шкала оценки психического статуса (КШОПС). Эта шкала не является оптимальной для диагностики и оценки выраженности сосудистых когнитивных нарушений. Поэтому целесообразны дальнейшие наблюдения с использованием более подходящих методик.
Третья стратегия этиопатогенетической терапии цереброваскулярных заболеваний – это антитромбоцитарная, или антикоагулянтная, терапия. Последняя обычно используется пациентами с кардиэмболическим подтипом ИИ в анамнезе. Влияние антитромбоцитарной или антикоагулянтной терапии на темп прогрессирования сосудистых когнитивных расстройств, как и влияние статинов, изучено недостаточно. Так, профилактический эффект ацетилсалициловой кислоты (АСК) анализировался в исследовании «Аспирин в лечении бессимптомного атеросклероза»: 3350 пациентов в возрасте от 50 до 75 лет наблюдались в течение 5 лет. По окончании наблюдения не было зафиксировано достоверных различий по когнитивным показателям между группой АСК (100 мг/сут) и плацебо [35]. Не было показано преимуществ перед плацебо и при использовании других антитромбоцитарных препаратов (комбинация АСК и дипиридамола медленного высвобождения, клопедогрел) [36]. Однако приведенные выше работы также имеют существенные методологические ограничения, т.к. использовали в качестве диагностического инструмента КШОПС.
Исходя из современных представлений о патогенезе хронической сосудистой мозговой недостаточности, пациентам с данным неврологическим расстройством, безусловно, показана нейропротективная терапия. Она потенциально способна уменьшить объем локального повреждения головного при острых нарушениях мозгового кровообращения без клиники инсульта (немых инфарктах). Нейропротективная терапия также позволяет увеличивать выживаемость нейронов в условиях хронической ишемии и гипоксии, которая лежит в основе формирования лейкоареоза. Таким образом, оба основных механизма повреждения головного мозга при хронической цереброваскулярной патологии являются показанием к проведению нейропротективной терапии.
Как уже говорилось выше, при острых нарушениях мозгового кровообращения в качестве эффективного нейропротективного препарата хорошо зарекомендовал себя цитиколин. Имеется также значительный опыт его клинического применения пациентами с хроническими цереброваскулярными заболеваниями. В данной ситуации также имеют огромное клиническое значение мебранопротективные и репаративные свойства цитиколина как источника фосфолипидов для синтеза клеточных мембран. Кроме того, цитиколин активирует ацетилхолинергическую систему головного мозга. Как известно, ацетилхолинергическая церебральная система тесно связана с процессами внимания и памяти. ХНМК сопровождается ацетилхолинергической недостаточностью вследствие нарушения целостности ацетилхолинергических проводящих путей. Указанные пути проходят в перивентрикулярной зоне белого вещества больших полушарий, которая наиболее подвержена хроническому ишемическому поражению при артериальной гипертензии и микроангопатии иной этиологии. Развивающаяся ацетилхолинергическая недостаточность обусловливает многие когнитивные симптомы цереброваскулярной патологии.
Кроме того, хорошо известна высокая коморбидность хронических цереброваскулярных заболеваний и болезни Альцгеймера (БА) у пожилых людей [37]. Так, по данным Н.Н. Яхно и соавт., уже на II стадии дисциркуляторной энцефалопатии когнитивные симптомы, характерные для начальных стадий БА, выявляются приблизительно у 40% пациентов [38]. Как известно, ацетилхолинергическая недостаточность представляет собой основной нейрохимический субстрат когнитивных нарушений при БА. Таким образом, применение препаратов с ацетилхолинергической активностью показано как при «чистых» сосудистых когнитивных нарушениях, так и при сочетании ХНМК с сопутствующим нейродегенеративным процессом.
Положительный эффект цитиколина в отношении сосудистых когнитивных нарушений был показан как в рамках международных рандомизированных исследований, так и в повседневной клинической практике. Так, в мета-анализе M. Fioravanti и соавт. (2005) были представлены результаты 7 клинических исследований эффективности применения цитиколина при хронической сосудистой мозговой недостаточности, в которых участвовали несколько сот пациентов [39]. Было показано, что на фоне использования данного препарата отмечается достоверное улучшение показателей памяти, концентрации внимания, активности познавательной деятельности и когнитивных функций в целом. Одновременно была зафиксирована положительная динамика в эмоционально-поведенческой сфере в виде регресса тревожно-депрессивных расстройств. Различия цитиколина и плацебо были не только статистически, но и клинически значимыми, т.к. сопровождались достоверным улучшением клинического статуса в целом.
Особого интереса заслуживает опыт применения цитиколина при умеренных когнитивных нарушениях. Следует подчеркнуть, что терапевтические стратегии лечения деменции и недементных когнитивных нарушений различны: при деменциях приоритетным является уменьшение выраженности симптомов, а при умеренных когнитивных нарушениях – нейропротекция и профилактика прогрессирования имеющихся расстройств. Будучи препаратом с выраженным нейропротективным эффектом, цитиколин может занимать важно место в лечении недементных когнитивных расстройств. В настоящее время в мире отсутствует общепринятый протокол ведения пациентов с подобными расстройствами. Однако имеющийся клинический опыт свидетельствует о целесообразности использования цитиколина у данной когорты пациентов. Так, A. Agnoli и соавт. (1989) назначали цитиколин пожилым пациентам с нарушениями памяти, но без деменции. Было показано достоверное улучшение результатов КШОПС, слухо-речевой памяти и концентрации внимания [40]. Сходные результаты были получены P.A. Spiers и соавт., которые также назначали цитиколин пожилым лицам с недементными когнитивными расстройствами. Было показано, что препарат способствует клиническому улучшению, причем максимальный эффект был зафиксирован у пациентов с изначально более низкими когнитивными способностями [41]. Об эффективности цитиколина в виде монотерапии или в сочетании с нимодипином у пожилых лиц с когнитивными нарушениями сообщает также X.A. Alvarez (1999) [42].
Положительный эффект цитиколина при когнитивных нарушениях отмечается при любом способе применения препарата (внутривенно, внутримышечно, перорально). В большинстве приведенных выше исследований дозировки препарата составили 600–1000 мг/сут.
Высокая клиническая эффективность цитиколина и его востребованность в практической деятельности неврологов и врачей других специальностей привели к появлению на российском фармацевтическом рынке воспроизведенных лекарственных форм данного препарата. К таким воспроизведенным лекарственным формам относится Нейпилепт (ЗАО «ФармФирма «Сотекс»). Основой для производства Нейпилепта является итальянская субстанция. Препарат выпускается в виде раствора для внутривенного и внутримышечного введения концентраций 125 и 250 мг/мл.
Имеющиеся в настоящее время данные свидетельствуют о терапевтической эквивалетности Нейпилепта и оригинального цитиколина. Так, было проведено сравнительное многоцентровое исследование эффективности и безопасности применения Нейпилепта и цитиколина в лечении пациентов с ИИ. В исследовании участвовали 152 пациента с ИИ в бассейне сонных артерий, которые получали ту или иную форму цитиколина. Было показано, что Нейпилепт и оригинальный цитиколин не имеют существенных различий по профилю эффективности, безопасности и переносимости. Поэтому Нейпилепт, как и оригинальный цитиколин, может использоваться на практике при острой и хронической церебральной ишемии [43].
Таким образом, нейропротективная терапия показана как при острой, так и при хронической церебральной ишемии. Необходимы дальнейшие исследования эффективности нейропротективных препаратов с различными механизмами действия.


