Актуальность проблемы кислотозависимых заболеваний, к числу которых относятся язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, синдром Золлингера–Эллисона, хронический панкреатит (ХП) и функциональная диспепсия, обусловлена их значительной распространенностью, низкой выявляемостью и склонностью к часто рецидивирующему течению при неадекватном лечении.
Так, например, выявляемость ХП в структуре заболеваний органов пищеварения составляет 5,1–9,0 % [1]. При этом следует отметить отчетливую тенденцию к росту первичной заболеваемости ХП, увеличенной в Европе с 4–8 случаев на 100 тыс. населения в год в 1998 г. до 25 на 100 тыс.
в 2007-м [2]. В России распространенность ХП среди взрослых составляет 27,4–50,0 случаев на 100 тыс. населения [3]. Закономерным следствием этого стал двукратный рост числа больных острым и хроническим панкреатитом за последние 30 лет [4]. Данное обстоятельство обусловлено главным образом сохранением значимости основных этиологических факторов ХП (злоупотребление алкоголем, широкая распространенность заболеваний желудка, двенадцатиперстной кишки и желчевыделительной системы), а также совершенствованием лабораторных и инструментальных методов его диагностики [5]. Прогредиентность клинического течения ХП подтверждается увеличением частоты случаев госпитализации больных с осложненным течением заболевания в хирургические стационары и возрастанием частоты развития панкреатогенного сахарного диабета [6]. С другой стороны, принципиально важно, что ХП зачастую выступает в качестве предракового заболевания с высокой вероятностью развития аденокарциномы поджелудочной железы (ПЖ) [7]. Показано, что 20-летний анамнез заболевания повышает риск развития рака ПЖ в 5 раз. Настораживает также рост распространенности ХП в России среди лиц молодого возраста и подростков: за последние 10 лет уровень заболеваемости вырос в 4 раза [5, 8].
Не менее важным является тот факт, что при ХП ранние осложнения (гнойно-септические; кровотечения из изъязвлений пищевода, желудка и двенадцатиперстной кишки; тромбоз в портальной системе; стеноз холедоха и двенадцатиперстной кишки) развиваются в 30 % случаев, а поздние осложнения (стеаторея и другие признаки мальдигестии и мальабсорбции; энцефалопатия; анемия; локальные инфекции; артериопатия нижних конечностей, остеомаляция) – в 70–85 %, причем летальность при осложнениях составляет до 5,5 % [9].
Еще одной социально значимой медицинской проблемой является совершенствование подходов к диагностике и лечению заболеваний, ассоциированных с метаболическим синдромом, что обусловлено ранней инвалидизацией и высокой смертностью при развивающихся впоследствии сосудистых катастрофах [1, 9]. В основе данной категории заболеваний, частым проявлением которых на уровне органов пищеварения является ХП [3, 8], лежит, как правило, первичное формирование нарушений углеводного обмена и дислипопротеидемии атерогенного профиля. Между тем вплоть до настоящего времени патогенетические взаимосвязи ХП и формирующихся метаболических нарушений остаются недостаточно изученными. Следует признать, что, несмотря на частое обнаружение феномена инсулинорезистентности у больных ХП, в большинстве случаев механизм его развития остается неясным.
Таким образом, изучение состояния углеводного и липидного обменов у больных ХП и разработка новых методов адекватной коррекции выявленных изменений являются чрезвычайно актуальными для современной медицины, составив предмет данного исследования.
Целью настоящей работы стало изучение метаболических изменений у больных ХП на фоне приема селективного М-холинолитика гиосцина бутилбромида.
Материал и методы
В анализируемую выборку были включены 105 пациентов с рецидивирующей формой ХП (РФХП), средний возраст которых составлял 45,9 ± 12,6 года (43,2 ± 13,5 – у мужчин, 48,6 ± 11,7 – у женщин). Для обеспечения этнической однородности наблюдаемой группы в исследование включены только европеоиды.
Критерии исключения:
1. Выраженная сопутствующая патология: декомпенсация сахарного диабета, заболеваний сердечно-сосудистой системы, хроническая обструктивная болезнь легких с проявлениями дыхательной недостаточности, хроническая почечная недостаточность, хронические гепатиты различной этиологии, хроническая печеночная недостаточность.
2. Тяжелые сопутствующие гастроэнтерологические заболевания и их осложнения: заболеваний органов пищеварения: признаки желудочно-кишечного кровотечения, перфорация или пенетрация, стеноз антрального отдела желудка или пилородуоденальной зоны, рак желудка,
органические поражения кишечника (опухоли, дивертикулез), воспалительных заболеваний кишечника (болезнь Крона, неспецифический язвенный колит и пр.).
3. Длительное применение гепатотоксических препаратов, в т. ч. по жизненным показаниям.
4. Системные заболевания соединительной ткани.
5. Применение стероидных гормонов.
6. Наличие аллергических реакций
на компоненты исследуемого препарата.
7. Наличие психических (эндогенных) расстройств.
Больные были разделены на две группы: основную – РФХП-1 (58 пациентов), в которой в составе комплексной терапии в качестве антисекреторного и спазмолитического препарата применялся гиосцина бутилбромид (Бускопан) в суточной дозе 60 мг в 3 приема, а также полиферментные
препараты в стандартной дозировке в течение 21 дня, и группу сравнения – РФХП-2 (47 пациентов), в которой назначалась только стандартная терапия: спазмолитики (дротаверина гидрохлорид), антисекреторные средства (омепразол) и полиферментные препараты в стандартных дозировках.
Соотношение мужчин и женщин в обеих группах было сопоставимым: 54 (63,5 %) и (36,5 %) – в основной, 55 (56,7 %) и 42 (43,3 %) – в контрольной. Все больные проходили стационарное обследование и лечение в клинике 2-й кафедры терапии Военно-медицинской академии,
Санкт-Петербург.
Всем больным в динамике проводилось исследование следующих показателей:
• оценка выраженности болевого абдоминального и диспепсического синдромов путем самонаблюдения с использованием визуально-аналоговой шкалы (ВАШ): 0 – отсутствие симптома, 5 – максимальная его выраженность;
• биохимические параметры крови: аланинаминотрансфераза, аспартатаминотрансфераза, билирубин, щелочная фосфатаза, γ-глутаминтранспептидаза, амилаза, глюкоза, калий;
• фенотипирование липопротеидов сыворотки крови: общий холестерин (ОХС), холестерин липопротеидов низкой плотности (ЛПНП), холестерин липопротеидов высокой плотности (ЛПВП), коэффициент атерогенности (КА);
• уровни инсулина и кортизола;
• ЭКГ;
• ультразвуковое исследование органов брюшной полости;
• психологический статус;
• микробный пейзаж кала;
• оценка качества жизни по опроснику SF-36;
• электрогастроинтестинография для исследования миоэлектрической активности желудочно-кишечного тракта;
• трансэндоскопическая топическая экспресс-рН-метрия.
Результаты и обсуждение
В клинической картине больных ХП превалировал болевой абдоминальный синдром (средний балл в группе РФХП-1 – 3,05 ± 0,6 и РФХП-2 – 2,95 ± 0,35 по ВАШ). Среди диспепсических проявлений доминировали вздутие живота, послабление и учащение стула (табл. 1). Выраженность
таких симптомов, как чувство горечи во рту и тошнота, была незначительной в обеих группах. Все пациенты отмечали снижение аппетита, ухудшение общего самочувствия, снижение активности.
Таблица 1. Средние показатели клинических проявлений у больных РФХП.
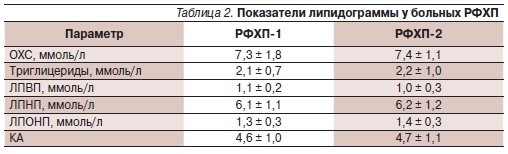
Изучение липидного обмена у пациентов в обеих группах (табл. 2) демонстрирует значительные нарушения фактически всех показателей липидограммы. Так, содержание ОХС было выше референтных величин и составило в группах РФХП-1 и РФХП-2 7,3 ± 1,8 и 7,4 ± 1,1 ммоль/л соответ-
ственно. КА при этом отражал характер изменений липидограммы: 4,6 ± 1,0 – в РФХП-1, 4,7 ± 1,1 – в РФХП-2. Обращал на себя внимание высокий уровень ЛПНП в обеих группах (6,1 ± 1,1 и 6,2 ± 1,2 ммоль/л соответственно).
Особый интерес в нашем исследовании представляло состояние углеводного обмена и эндокринной функции ПЖ. Как следует из данных, представленных в табл. 3, уровни глюкозы и инсулина натощак достоверно не различались в обеих группах. Необходимо отметить достоверное увеличение уровня инсулина в обеих группах по отношению к референтным величинам, что указывает на раннее формирование гиперинсулинемии у пациентов с РФХП. С учетом показателей липидного обмена можно говорить о развернутой картине метаболического синдрома у данной категории больных, что безусловно должно находить свое отражение в адекватных подходах к терапии данного состояния и учитываться врачами при выборе тактики ведения этих пациентов.
Таблица 3. Динамика показателей углеводного обмена у больных РФХП.
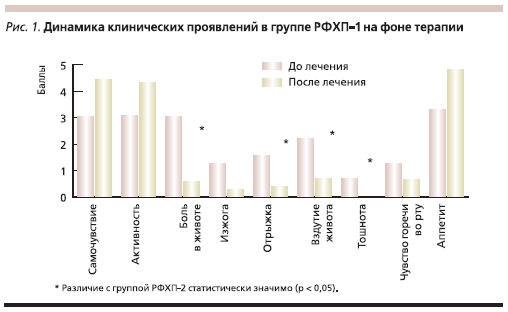
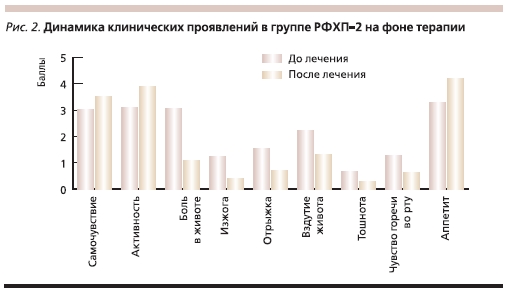
Эффективность терапии оценивалась по скорости и выраженности регресса клинических симптомов желудочной и кишечной диспепсии, а также болевого абдоминального синдрома. Как было установлено в процессе исследования, регресс симптомов заболевания наблюдался у пациентов обеих групп (рис. 1, 2). Однако в группе РФХП-1 отмечено достоверно более выраженное снижение интенсивности болевого абдоминального синдрома, купирование которого в группе РФХП-1 достигалось уже к 3–4-м суткам терапии. Аналогичные изменения отмечены в обеих группах по динамике выраженности тошноты, а также металлического привкуса во рту. При этом уменьшились либо исчезли жалобы на вздутие живота, урчание в кишечнике, а также восстановились нормальная консистенция и частота стула (табл. 4).
Структурно-функциональное состояние панкреатобилиарной системы оценено на основании анализа результатов ультразвукового исследования (табл. 5).
Таблица 4. Динамика клинических проявлений диспепсического и абдоминального синдромов у больных РФХП.
Таблица 5. Динамика показателей структурно-функционального состояния панкреатобилиарной системы у больных РФХП.
Как следует из представленных данных, наибольшие изменения претерпевают параметры, характеризующие моторно-эвакуаторную функцию желчевыделительной системы: уменьшается степень выраженности признаков дискинезии желчного пузыря, активируется его сократительная функция, о чем свидетельствуют уменьшение размеров пузыря, улучшение пассажа желчи. Таким образом, применение гиосцина бутилбромида в комплексной терапии РФХП сопровождается улучшением функционального состояния желчевыводящих путей.
Таблица 6. Динамика содержания ферментов ПЖ в плазме крови у больных РФХП.
Исследование динамики содержания ферментов ПЖ в плазме крови у больных РФХП указывает на достоверное снижение уровней амилазы и трипсина на фоне лечения в обеих группах (табл. 6). Обращает на себя внимание более значимый прирост ингибитора трипсина в группе РФХП-1 по отношению к группе РФХП-2.
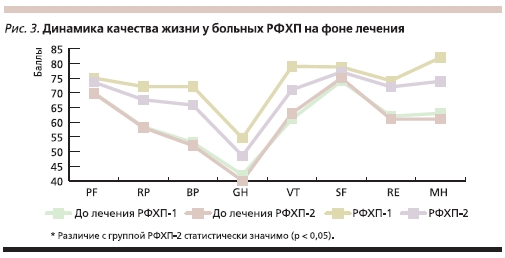
При оценке динамики показателей качества жизни, изначально сниженных практически у всех пациентов, отмечено статистически значимое улучшение как в первой, так и во второй группе таких характеристик, как интенсивность боли (показатель BP) и общее состояние здоровья (показатель GH, рис. 3). В группе больных, кроме того, отмечено достоверное улучшение по показателям VT (жизненная активность) и МН (психическое здоровье).
Положительная клиническая динамика и улучшение качества жизни имели место у больных на фоне ряда метаболических изменений.
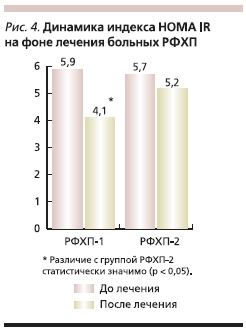
На рис. 4 представлена динамика индекса инсулинорезистентности HOMA IR на фоне лечения. Отмечено достоверное уменьшение данного показателя у пациентов группы РФХП-1, что свидетельствует о снижении периферической инсулинорезистентности, в то время как в группе РФХП-2 данный показатель имел лишь тенденцию к снижению.
Двухнедельная терапия гиосцина бутилбромидом привела к достоверному снижению уровня кортизола в группе больных ХП. Известно, что содержание кортизола повышается при боли, эмоциональном и психическом стрессе, поэтому снижение его концентрации на фоне положительной клинической динамики (прежде всего купирования болевого абдоминального синдрома) можно расценить как физиологическую реакцию организма на устранение стрессирующих факторов.
Таблица 7. Динамика содержания липидов в сыворотке крови больных РФХП до и после лечения.
Анализ динамики показателей, характеризующих липидный обмен, позволил выявить у больных обеих групп снижение уровня как ОХС, так и его атерогенных фракций (табл. 7). В частности, имело место снижение уровня ЛПНП и повышение концентрации ЛПВП. Также в обеих группах снижался уровень триглицеридов.
Обсуждение
В ходе проведенного исследования нам удалось выявить формирование развернутой картины метаболического синдрома у пациентов с рецидивирующей формой ХП, которое выражалось в развитии дислипопротеидемии атерогенного профиля и гиперинсулинемии натощак как проявлений инсулинорезистентности. Данные изменения, по-видимому, обусловлены изменением функционального состояния инсулярного аппарата ПЖ. С другой стороны, выявленные метаболические изменения могут являться основой для формирования рецидивирующей формы ХП и прогрессирования заболевания [1].
Теоретическое признание принципов системности, целостности и гомеостатической обусловленности развития патологии все чаще вступает в противоречие с традиционным подходом, используемым в лечении. При этом со стороны практических врачей зачастую преобладают эмпирические или схематические попытки повлиять на внешние признаки заболевания путем назначения симптоматической терапии, как правило обладающей определенной нозоспецифичностью. Эти усилия, несмотря на ситуационную положительную эффективность, в большинстве случаев являются
паллиативными, поскольку не обеспечивают нивелирование стойких нарушений гомеостаза, сопровождающих развитие практически любого патологического процесса. Между тем организм человека обладает огромным энергетическим и адаптационнокомпенсаторным потенциалом, моби-
лизация которого является стержневым фактором в достижении положительного прогноза течения заболевания. Таким образом, формируется точка зрения о необходимости разработки новых методов лечения, имеющих метаболическую направленность и оказывающих позитивное влияние на ключевые метаболические процессы, участвующие в поддержании гомеостаза.
Анализ полученных клинических и метаболических изменений позволил определить, что оптимальным методом коррекции как моторных нарушений, так и расстройств углеводного и липидного обменов у больных РФХП является включение в состав базовой терапии селективного М-холинолитика гиосцин бутилбромида.
Положительное влияние гиосцина бутилбромида на состояние углеводного обмена обусловлено блокирующим действием на М3-холинорецепторы, поскольку было установлено, что эти рецепторы участвуют в регуляции секреции инсулина [8].
Вывод
Результаты проведенного нами исследования свидетельствуют, что селективный, преимущественно М3-холинолитический, эффект гиосцина бутилбромида сопровождается положительной динамикой показателей углеводного и жирового обменов у больных ХП. При этом отмечается статистически достоверное снижение индекса инсулинорезистентности НОМА IR, уровня холестерина и ЛПНП, что сочетается со снижением уровня кортизола (р < 0,05). В совокупности со спазмолитическим и антисекреторным эффектами препарата данные изменения благотворно отражаются на клиническом течении заболевания и способствуют достоверному сокращению сроков регресса болевого абдоминального и диспепсического синдромов.



