Введение
Инфекция Helicobacter pylori (H. pylori) является одной из самых распространенных среди людей. В индустриально развитых странах от 20 до 50% взрослого населения инфицированы данным микроорганизмом. В свою очередь в развивающихся странах показатель инфицированности превышает 80% [1, 2]. В настоящий момент данная инфекция рассматривается как важный этиопатогенетический компонент ряда заболеваний гастродуоденальной зоны (хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, аденокарцинома и MALT-лимфома желудка) [1, 3]. Однако за последнее время появляется все больше исследований, демонстрирующих возможную прямую или опосредованную связь между H. pylori и возможностью формирования ряда внегастральных заболеваний.
С позиций доказательной медицины накапливаются данные об ассоциации инфекции H. pylori с идиопатической железодефицитной анемией (ЖДА) и идиопатической тромбоцитопенической пурпурой [4]. Не случайно, согласно рекомендациям Маастрихта-4, показано проведение эрадикационной терапии (ЭТ) всем пациентам, страдающим хронической ЖДА неясной этиологии, после получения от них положительных результатов тестов на H. pylori (уровень доказательности: 1а; класс рекомендаций: А) [5, 6].
ЖДА – не только широко распространенное во всем мире состояние, но и серьезный фактор риска развития дополнительных осложнений со стороны различных органов и систем, в первую очередь со стороны ЖКТ. При этом нередко ЖДА рассматривают как вторичный симптом, осложняющий клиническую картину и диагностику, не уделяют должного внимания, а порой и совершенно упускают из виду [7]. В целом, по данным Всемирной организации здравоохранения, во всем мире сегодня насчитывается 1,6 млрд больных ЖДА и 3,6 млрд пациентов со скрытым дефицитом железа [8], что в свою очередь подчеркивает важное медико-социальное значение своевременной диагностики и лечения.
К настоящему времени было продемонстрировано, что у H. pylori-позитивных больных имеется более низкий уровень сывороточного ферритина и железа по сравнению с H. pylori-негативными больными [9], причем у больных с атрофическим гастритом, ассоциированным с H. pylori-инфекцией, данные показатели «железного» статуса бывают наиболее низкими [10]. H. pylori представляет собой вирулентный агент, который поглощает и использует для своей жизнедеятельности значительное количество железа [10]. Так же как и другие грамотрицательные бактерии, этот микроорганизм вступает в сложные конкурентные взаимоотношения за железо. С этой целью им используется синтезируемый сидерофор фенолятного или гидроксоматного типа, который в дальнейшем соединяется с ферратом сидерофилов с последующей экстракцией железа с поверхности клеток. Возможен непосредственный лизис клеток под воздействием продуцируемых H. pylori уреазы и муциназы с извлечением железа макроорганизма (человека), переваривания гемоглобина и усвоения (ассимилирования) гема с образованием сидерофор, позволяющих извлекать железо макроорганизма [11]. Наличие на слизистой оболочке желудка H. pylori способствует развитию ЖДА у взрослых и детей [12]. Наличие H. pylori-инфекции в сочетании с ЖДА чаще сопровождается поражением всей слизистой оболочки желудка и развитием пангастрита [10]. Проводимая пероральная ферротерапия восстанавливает и поддерживает нормальный уровень железа, однако после ее прекращения анемия вновь возвращается.
В целом механизмы взаимоотношения ЖДА и инфекции H. pylori во многом остаются еще не ясными. В частности, по-прежнему открыт вопрос: почему среди пациентов, страдающих от H. pylori-инфекции, ЖДА выявляется далеко не у всех? Ряд исследователей предполагают, что для роста и пролиферации H. pylori требуется железо организма хозяина, а некоторые штаммы обладают специфической особенностью нарушать метаболизм железа путем связывания его со своей наружной мембраной [13]. При этом, по данным исследователей, штаммы CagA, а также возможные мутации в бактериальных генах служат фактором вирулентности в плане поглощения железа. Инфицирование CagA штаммами ведет к более выраженным атрофическим изменениям слизистой оболочки желудка (СОЖ), сопровождающимся снижением секреции желудочного сока и повышением внутрижелудочной pH, а также концентрации гастрина в сыворотке [14]. Противоречивость данных, которая присутствует в ряде работ по изучению эффективности терапии ЖДА у пациентов с H. pylori, может быть связана прежде всего с неоднородностью географической распространенности и различности в штаммах инфекта. Так, данные одного из последних мета-анализов показывают большую эффективность и оправданность проведения предварительной ЭТ и последующего лечения препаратами железа пациентов Азиатско-Тихоокеанского региона, чем пациентов стран Северной Америки [15].
Вышеперечисленные данные безусловно делают актуальным вопрос комплексного изучения ассоциаций инфекции Н. pylori и ЖДА как на патогенетическом, так и на клиническом уровне.
Целью нашего исследования было изучение патогенетических и клинических проявлений инфекции Н. pylori у больных ЖДА, а также оценка их возможной взаимосвязи с вариантами течения заболевания, длительностью анамнеза, полом и возрастом больных.
Материал и методы
Для реализации вышеизложенной цели нами были обследованы 120 пациентов разных возрастных категорий (от 18 до 70 лет), инфицированных H. pylori, которые в последующем были разделены на две группы. В основную группу вошли 70 пациентов, инфицированных H. pylori и страдавших ЖДА. В свою очередь в зависимости от проводимой терапии пациенты основной группы были случайным образом разделены на 2 однородные подгруппы:
- основная группа (70 человек) – пациенты с ЖДА, ассоциированной с контаминацией СОЖ H. pylori:
- 1а-подгруппа (35 человек): пациенты, получавшие ЭТ: амоксицилин (1000 мг 2 раза в день), кларитромицин (500 мг 2 раза в день), эзомепразол 20 мг 2 раза в день, продолжительностью 10 дней (согласно рекомендациям Маастрихт-4). Кроме того, по завершении курса антихеликобактерной терапии пациентам назначались препараты 2-валентного железа в сочетании с аскорбиновой кислотой;
- 1б-подгруппа (35 человек): пациенты, получавшие терапию только препаратами 2-валентного железа в сочетании с аскорбиновой кислотой;
- контрольная группа составила 50 человек – пациентов, инфицированных H. pylori, получавших указанную выше ЭТ.
Для постановки диагноза использовались традиционные клинические методы обследования, лабораторной диагностики (клинический анализ крови, клинический анализ мочи, биохимический анализ крови, электрокардиография, копрологическое исследование). Кроме этого были использованы специализированные инструментальные методы исследования (эзофагогастродуоденоскопия, ультразвуковое исследование органов брюшной полости). Все пациенты, включенные в исследование, были H. pylori-позитивными. Обследование проведено с помощью дыхательного карбамид-теста с использованием системы Хелик-тест до начала лечения. На основании анализа полученных показателей в исследование включены только пациенты с идиопатической ЖДА неясной этиологии, не связанной с хроническими или острыми кровопотерями. Оценка эффективности коррекции ЖДА произведена путем мониторирования показателей гемоглобина (Hb), цветового показателя, общей железосвязывающей способности сыворотки (ОЖСС), ферритина и сывороточного железа. Статистический анализ проведен при использовании программы Statistica® 8.0 (StatSoft, США) с помощью непараметрических и параметрических критериев. Различия считались достоверными при р<0,05.
Результаты и обсуждение
На основании анализа жалоб пациентов выявлено, что основной причиной первичного обращения их за медицинской помощью было заболевание органов ЖКТ (хронический гастродуоденит, язвенная болезнь двенадцатиперстной кишки, рефлюкс эзофагит и пр.), ассоциированное с H. pylori-инфекцией (63,3% больных [76 человек)]). Лишь в 30% случаев причиной обращения послужила ЖДА (36 человек). Основную часть данных больных составили женщины детородного возраста с длительностью хронической ЖДА по данным анамнеза от 2 до 10 лет, как правило, рефрактерной к оральному приему препаратов железа. Так, большинство пациентов, страдавших ЖДА, отмечали, что периодически принимали препараты железа. В среднем курсами около месяца 2–3 раза в году. На фоне прекращения приема препаратов железа у этих больных отмечалось постепенное регрессирование симптоматики ЖДА и изменение лабораторных показателей крови.
Остальные пациенты (6,6% [8 человек]) жалоб на момент включения в исследование активно не предъявляли, до этого препаратов железа не принимали, а признаки ЖДА выявлены были у них впервые в ходе обследования.
Изучив анамнез каждого больного, удалось выяснить, что железодефицитное состояние могло стать следствием различных диетических ограничений (5 человек), предшествовавшей беременности и последующей лактации (7 человек), или периода, сопровождавшегося интенсивным ростом, занятиями спортом (10 человек).
В отношении 22 пациентов четкой причины, вызвавшей железодефицитные состояния на момент включения в исследование, выявлено не было. Продолжительность заболевания, ассоциированного с хеликобактериозом, у пациентов основной группы составила от нескольких дней до 20 лет. В группе сравнения пациенты страдали хеликобактерной инфекцией от момента выявления изменений СОЖ до верификации H. pylori и начала ЭТ несколько дольше. В среднем от нескольких дней до 30 лет.
Особое внимание отведено выявлению т.н. симптомов тревоги, при появлении которых пациентам проводилось дополнительное углубленное всестороннее обследование. В исследование не включались пациенты с тяжелой сопутствующей гастроэнтерологической патологией или осложнениями заболеваний органов пищеварения, органических поражений (опухоли, дивертикулез) на момент включения в исследование, а также заболеваниями, сопровождавшимися обильной кровопотерей, приводящей к постгеморрагической анемии (ЖКТ-кровотечения, менометрорагии и др.); а также больные с выраженной сопутствующей патологией (декомпенсация заболеваний сердечно-сосудистой системы, патологии легких с признаками дыхательной недостаточности, хроническая почечная недостаточность, хронические гепатиты различной этиологии, хроническая печеночная недостаточность), лица с выраженными психическими расстройствами.
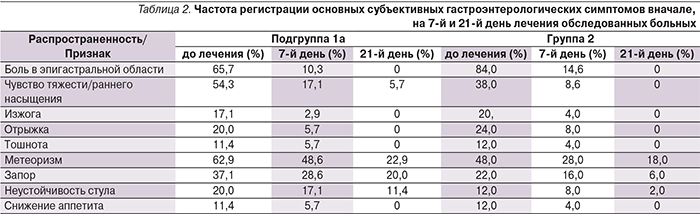
Основной жалобой гастроэнтерологического характера, заставлявшей больных обращаться за медицинской помощью, был болевой абдоминальный синдром, который наиболее выражен среди пациентов группы сравнения (84% группа 2; 65,7% подгруппа 1а). В основной же группе ведущими были проявления синдрома желудочно-кишечной диспепсии, прежде всего чувство раннего насыщения/переполнения в эпигастральной области (54,3% подгруппа 1а; 38% группа 2) и метеоризм (62,85% подгруппа 1а; 48% группа 2). Наличие изжоги и отрыжки как проявлений гастроэзофагеальной регургитации отмечено в среднем на уровне 17,14–20% и 20–24% соответственно (табл. 2).
При анализе проявлений сидеропенического и анемического синдромов обращает на себя внимание в целом схожесть и однородность жалоб наших пациентов двух подгрупп (табл. 3). После анализа полученных лабораторных показателей особое внимание уделялось оценке и рандомизации пациентов с целью формирования двух однородных подгрупп по степени тяжести анемии и выраженности нарушений обмена железа (табл. 4). В крови всех обследованных больных также отмечены изменения, характерные для ЖДА, такие как микроцитоз эритроцитов, анизохромия; наличие как гипо-, так и нормохромных эритроцитов; а также пойкилоцитоз. Проведенный анализ полученных лабораторных данных ЖДА средней степени тяжести выявил у 6 пациентов подгруппы 1а и у 7 пациентов подгруппы 1б, у всех остальных определена анемия легкой степени тяжести.
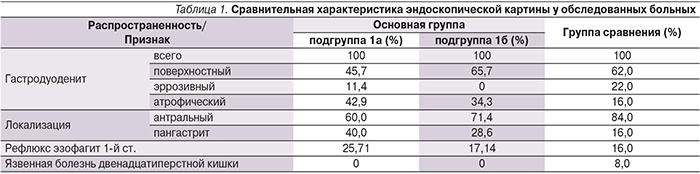
Комплексная оценка эндоскопической картины выявила как присутствие общих для обеих групп признаков поражения СОЖ, так и наличие определенных различий, которые частично могут объяснить некоторые описанные выше особенности клинической картины. В частности, четко отмечается взаимосвязь между выраженностью воспалительно-атрофических изменений СОЖ, с одной стороны, и данными анамнеза заболевания, с другой (табл. 1).
После оценки и анализа полученных данных пациентам подгруппы 1а и группы 2 проводился описанный выше курс ЭТ. После его завершения пациентам подгруппы 1а назначалось лечение комбинированным препаратом железа с аскорбиновой кислотой, дозировка и длительность лечения определены с учетом степени тяжести выраженности ЖДА. Пациентам подгруппы 1б назначалось лечение препаратом железа в комбинации с аскорбиновой кислотой. В последующем для оценки эффективности проводимой терапии нами оценивались показатели динамики клинических данных (субъективная оценка ощущения пациентом выраженности болевого, диспепсического синдромов; синдромов железодефицита (анемического/сидеропенического); а также динамики основных лабораторных и инструментальных показателей (данные общего анализа крови на 28-й и 56-й день после начала лечения; биохимических показателей на 28-й день; контроль эндоскопической картины на 21-й день после завершения ЭТ, эффективность эрадикации H. pylori (по данным дыхательного карбамид-теста).

В целом анализ гастроэнтерологических симптомов на 7-й и 21-й день после начала ЭТ не выявил существенных различий между пациентами обеих групп (табл. 2).
На фоне проведенной ЭТ основные субъективные гастроэнтерологические симптомы у большинства больных регрессировали уже на 7-й день лечения. Тяжесть и продолжительность болевого синдрома коррелировали с эндоскопической картиной СОЖ. Так, дольше всего абдоминальный болевой синдром сохранялся у пациентов группы 2 с язвенной болезнью двенадцатиперстной кишки, по данным эзофагогастродуоденоскопии (4 человека), однако к 21-му дню терапии болевые ощущения были купированы у всех пациентов обеих групп. Симптомы диспепсии дольше сохранялись у пациентов основной группы, что, вероятно, связано с преобладанием у этих больных более выраженных атрофических изменений СОЖ. При анализе данных симптомов к 21-му дню терапии их регресс отмечен у всех пациентов 2-й группы и сохранялись они лишь у 2 человек подгруппы 1а (7,4%), при этом их выраженность, по оценке пациентов, значительно сократилась. Явления тошноты и снижения аппетита, наблюдаемые у больных до начала лечения, также были полностью купированы к 21-му дню лечения. При этом анализ анемического и сидеропенического синдромов, который проводился на 14-й и 28-й день лечения пациентов двух подгрупп, показал, что более ранний ответ на терапию был достигнут в подгруппе пациентов, прошедших предварительный курс ЭТ H. pylori (табл. 3).
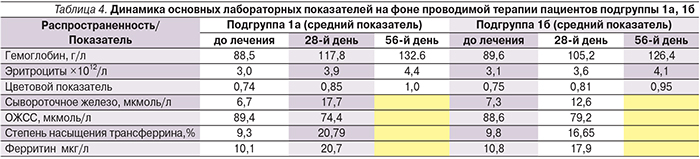
Для оценки коррекции железодефицита производился контроль показателей общего анализа крови на 28-й и 56-й день от начала терапии, а также динамики биохимичеких показателей на 28-й день от начала лечения. Согласно анализу полученных данных, можно отметить, что субъективные симптомы анемии удавалось купировать несколько быстрее (у отдельных пациентов подгруппы 1а уже на 10-й день лечения; подгруппы 1б к 18-му), чем лабораторные, особенно среди пациентов, прошедших предварительный курс ЭТ (табл. 4).
Период приема железосодержащих препаратов сопровождался достоверным (р<0,05) увеличением уровня Hb и эритроцитов. Так, на 28-й день лечения средний показатель Hb среди пациентов подгруппы 1а составил 117,8 г/л (+29,3г/л), среди пациентов подгруппы 1б – 104,2 г/л (+15,6г/л). К 56-му дню лечения все больные достигли целевых значений, соответствовавших нормальному показателю уровня Hb. Динамика цветового показателя на 28-й и 56-й день исследования была также значимой во всех подгруппах и заключалась в возрастании этого показателя на 0,09 и 0,1 соответственно в подгруппе 1а и на 0,06 и 0,014 соответственно в подгруппе 1б. При этом среди больных подгруппы 1а целевые показатели были достигнуты большинством пациентов уже к 28-му дню терапии (р<0,05). Также отмечено достоверное снижение ОЖСС и повышение уровня ферритина и сывороточного железа, что говорит о повышении уровня железа в сыворотке крови у пролеченных от хеликобактериоза пациентов и более раннем начале его депонирования в организме (р<0,05). При этом среди пациентов, прошедших предварительный курс антибиотикотерапии, данные показатели были выше.
При контрольной эзофагогастродуоденоскопии на 21-й день после завершения ЭТ отмечено заживление всех язвенных и эрозивных дефектов СОЖ у пациентов с язвенной болезнью двенадцатиперстной кишки в виде формирования белого рубца. Также при контрольном обследовании не было выявлено признаков выраженного гастродуоденита. Картина поверхностного воспаления СОЖ отмечалась у 13 пациентов 1а-подгруппы (37,14%) и 16 пациентов 2-й группы (32%). При этом признаки атрофического гастрита, выявленные на фоне воспалительных явлений СОЖ у части пациентов (42,85 и 16,0% соответственно в основной и контрольной группах), какой-либо существенной динамики не претерпели.
Проведенный нами после ЭТ дыхательный тест позволил оценить ее эффективность, которая составила в 1а-подгруппе 80,0% (28 человек) и 82% (41 человек) в контрольной группе. Различия оказались недостоверными (р>0,05), однако уровень эффективности классической тройной схемы ЭТ согласуется с данными крупных исследований в Европе, демонстрирующих, что данный протокол эффективен в 75–80% случаев [16, 17], хотя его эффективность прогрессивно снижается, коррелируя с антибиотикорезистентностью в этом регионе мира [18, 19].
На фоне проводимой терапии не было выявлено клинически значимых побочных явлений, требующих отмены назначаемых препаратов. Наиболее частые жалобы, на которые обращали внимание наши пациент, – это нестабильный стул, склонность к запорам, изменение окраски кала на фоне терапии препаратами железа.
Заключение
Патогенетической основой терапии ЖДА являются препараты железа. Железо относится к жизненно важным микроэлементам, т.к. стимулирует процессы дыхания на клеточном уровне, участвует в формировании гема, а также ряда ферментов, в т.ч. рибонуклеотид-редуктазы, участвующей в синтезе дезоксирибонуклеиновой кислоты.
Наличие H. pylori-инфекции у пациентов может приводить к развитию различной патологии со стороны как органов ЖКТ, так и внегастральных проявлений, в т.ч. ЖДА. При этом проявление железодефицита не всегда можно объяснить осложнениями основных заболеваний органов ЖКТ, вызванных H. pylori (кровотечения при язвенной болезни желудка, двенадцатиперстной кишки и пр.).
Исходя из полученных нами данных, можно сделать следующие выводы:
У пациентов, страдающих ЖДА и H. pylori-инфекцией, преобладают жалобы диспепсического характера, что, по-видимому, связано с более выраженными атрофическими и дисмоторными процессами в желудке.
Основную часть данных больных составляют женщины детородного возраста с длительностью хронической ЖДА, по данным анамнеза, от 2 до 10 лет, как правило, рефрактерной к оральному приему препаратов железа, этиология которой не связана с постгеморрагическими либо алиментарными причинами. При этом, по данным анамнеза, состояние железодефицита у таких больных может длиться более 10 лет, а попытки терапии и компенсации запасов железа не всегда достигают успеха. Несмотря на это, большинство из этих пациентов редко проходят полное всестороннее обследование, в т.ч. на определение H. pylori. При эндоскопическом обследовании у больных чаще выявляются явления пангастрита и атрофических изменений СОЖ, что может свидетельствовать о более длительном персистировании у них инфекции H. pylori.
В связи с этим всем пациентам с идиопатической ЖДА неясной этиологии должно проводиться комплексное лабораторное и инструментальное обследование с обязательным тестом на H. pylori.
Проведение ЭТ у лиц, страдающих хронической ЖДА, позволяет достигать более быстрого ответа на лечение пероральными препаратами железа, что подтверждается лабораторными показателями, объективными данными и более быстрым купированием основных клинических жалоб и проявлений.
Наличие ЖДА в анамнезе в целом не снижает эффективность проводимой ЭТ.
Опираясь на рекомендации Маастрихта-4, всем больным ЖДА неясной этиологии после выявления H. pylori рекомендовано проведение ЭТ до начала лечения препаратами железа.
H. pylori-ассоциированный гастрит необходимо рассматривать как возможную причину хронической ЖДА, рефрактерную к лечению пероральными препаратами железа. Проведение ЭТ данной категории пациентов может улучшить у них ответ на последующую терапию препаратами двухвалентного железа в сочетании с аскорбиновой кислотой. Это позволяет скорректировать проявление ЖДА при минимизации возможных побочных эффектов.


