Введение
Пролапс гениталий (ПГ) – распространенное патологическое состояние с пиком заболеваемости, приходящимся на шестую декаду жизни. Ощущение инородного тела во влагалище, нарушения мочеиспускания и дефекации, декубитальные язвы и диспареуния, обусловленные ПГ, причиняют выраженный дискомфорт, оказывают негативное влияние на качество жизни пациенток. Хирургическая коррекция ПГ является одним из наиболее частых показаний к оперативному вмешательству на органах малого таза у женщин. Существует множество способов оперативной коррекции ПГ, однако единых рекомендаций по хирургическому лечению опущения женских половых органов до сих пор не разработано.
Одним из методов оперативной коррекции ПГ является сакрокольпопексия (СКП). За прошедшие 50 лет эта методика претерпела значительные изменения. Изначально применявшаяся в основном для лечения рецидивного ПГ и выполнявшаяся по открытой методике, на сегодняшний день СКП осуществляется преимущественно из лапароскопического доступа и может быть использована для устранения опущения матки и свода влагалища [1].
Выполнение СКП лапароскопическим доступом привело к значительному снижению риска осложнений, связанных с традиционной открытой методикой. Осуществление процедуры с помощью роботической системы daVinci (Intuitive Surgical, Inc., Sunnyvale, CA) позволяет в еще большей степени снизить травматичность вмешательства, уменьшить риск развития осложнений и сократить послеоперационное время нахождения пациентки в стационаре.
В настоящем клиническом наблюдении мы приводим опыт лечения пациентки с ПГ, которой было выполнено оперативное лечение в объеме робот-ассистированной (РА) СКП.
Описание клинического случая
Пациентка Б. 46 лет обратилась в нашу клинику в октябре 2013 г. с жалобами на ощущение инородного тела во влагалище, диспареунию, периодически возникающую необходимость ручного пособия при мочеиспускании. Указанные жалобы беспокоили пациентку в течение 2 последних лет, усугубление симптоматики отмечалось в течение последнего года. В анамнезе у пациентки двое родов крупными плодами (4000 и 4500 г), сопровождавшихся разрывами влагалища и эпизиотомией во время первых родов.
При осмотре в кресле у пациентки выявлено опущение передней стенки влагалища, при натуживании находящейся на уровне гименального кольца, и неполное выпадение матки – шейка матки (ШМ) при натуживании выходила за пределы гименального кольца на 2 см (точка С+2 см). Указанные изменения соответствуют третьей стадии ПГ по классификации POP-Q (рис. 1).

Пациентке было выполнено ультразвуковое исследование мочевой системы, по данным которого патологических изменений не выявлено. По данным УЗИ органов малого таза имелась миома матки 7–8 недель. Пациентка была консультирована гинекологом – противопоказаний к оперативному лечению не выявлено.
С целью восстановления нормальной анатомии дна малого таза принято решение выполнить пациентке СКП с роботической ассистенцией. Учитывая молодой возраст пациентки, отсутствие заинтересованности в поддержании фертильности, а также с профилактической целью решено выполнить пациентке симультанную ампутацию матки.
Ход операции
Под комбинированной анестезией пациентка помещена в позицию Тренделенбурга с ногами, разведенными до 50–60° и несколько согнутыми в коленях. Интраоперационно мочевой пузырь был дренирован по уретре специально разработанным катетером, предусматривающим возможность орошения слизистой мочеиспускательного канала лекарственными препаратами в послеоперационном периоде [10]. С помощью иглы Вереша наложен пневмоперитонеум с давлением 12 мм вод. ст., в брюшную полость установлены троакары. Расположение роботических троакаров следующее: 12-мм порт для камеры помещен по срединной линии на 2 см выше пупка; два 8-мм порта располагаются симметрично, с двух сторон по среднеключичной линии на уровне пупка; третий 8-мм порт устанавливается в левой подвздошной области по среднеключичной линии. 12-мм ассистентский порт размещается по передней подмышечной линии на 3 см выше гребня правой подвздошной области. Рабочая консоль робота размещена у ножного конца стола, между ног пациентки.
Первым этапом операции выполнена надвлагалищная ампутация матки. Процессу выделения матки стоит уделять особое внимание, дабы избежать травмы мочевого пузыря или мочеточников, которые могут привести к развитию таких осложнений, как мочеполовые свищи, мочевой перитонит, уринома, острый обструктивный пиелонефрит и др.
После визуализации ШМ тело матки отсечено с использованием электрокоагуляции. Крестцово-маточные связки как важная часть поддерживающего аппарата органов таза сохранены. ШМ ушита непрерывным швом викрилом 2-0 (Coated VICRYL® (polyglactin 910) Suture Ethicon Endo-Surgery (Europe) GmbH, Johnson & Johnson, Norderstedt, Germany). Тело матки удалено из брюшной полости с использованием морцеллятора (рис. 2).
Выполнена мобилизация сигмовидной кишки, после чего визуализирован мыс крестца. Произведено рассечение покрывающих его тканей вплоть до надкостницы крестца. В продольном направлении выделено приблизительно 4 см поверхности крестца (рис. 3).
Через ассистентский порт в брюшную полость проведен Y-образный полипропиленовый сетчатый протез, сформированный из прямоугольного сетчатого протеза (GYNECARE GYNEMESH® Ethicon Endo-Surgery (Europe) GmbH, Johnson & Johnson, Norderstedt, Germany). Выполнена апроксимация ШМ, и протез укорочен до длины, позволяющей без натяжения поддерживать выбранное положение ШМ.
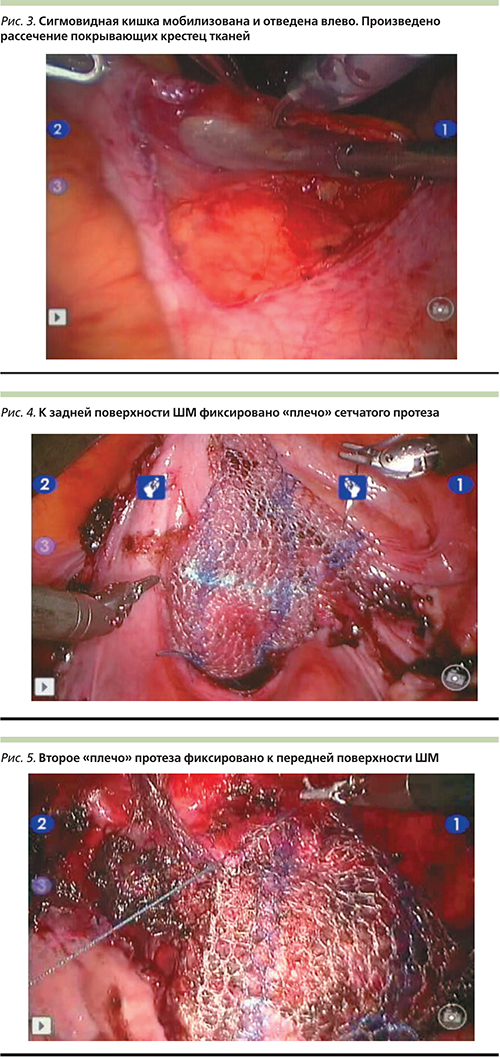
Одно «плечо» Y-образного протеза фиксировано 6 узловыми швами этибондом 2-0 (ETHIBOND EXCEL® Polyester Suture Ethicon Endo-Surgery (Europe) GmbH, Johnson & Johnson, Norderstedt, Germany) к задней поверхности шейки матки (рис. 4). Аналогично выполнена фиксация второго «плеча» протеза к передней поверхности ШМ (рис. 5).
Оставшаяся свободная часть протеза фиксирована к надкостнице мыса крестца несколькими швами этибондом 2-0 (рис. 6).
Завершающим этапом операции выполнена экстраперитонизация синтетического протезирующего устройства непрерывным швом викрилом 3-0 (рис. 7).
Результаты
Продолжительность операции составила 125 минут. Кровопотеря – 50 мл. Не было отмечено каких-либо осложнений, связанных с анестезией или непосредственно с оперативным вмешательством. Время пребывания в стационаре после операции составило 3 суток.
Уретральный катетер удален на вторые сутки после операции.
При контрольном обследовании через месяц определялось высокое стояние ШМ (что соответствовало расположению точки С-8 см в соответствии с классификацией POP-Q). Опущения передней или задней стенок влагалища не отмечалось. Также не было выявлено развившегося de novo недержания мочи.
Обсуждение
ПГ является частым состоянием, клинические проявления которого выявляются у 30% женщин в возрасте 50–89 лет. Необходимость оперативной коррекции ПГ возникает у 11% женщин в возрасте до 80 лет [2, 3].
Методики лечения пролапса женских половых органов широко варьируются: от применения пессариев до выполнения реконструктивно-пластических операций с применением различных синтетических протезирующих устройств. Единых рекомендаций по лечению ПГ до сих пор не разработано, и решение о выборе того или иного способа коррекции этой патологии должно приниматься строго индивидуально, с учетом особенностей клинической картины, предпочтений и ожиданий пациентки.
СКП является методикой оперативной коррекции 2 типов ПГ – опущения матки или свода влагалища. Цели СКП – устранить ПГ и восстановить нормальную анатомию и функцию влагалища. Во время этой процедуры производится апроксимация свода влагалища, дна матки или ШМ до их естественного положения с последующей фиксацией к надкостнице мыса крестца с использованием синтетического протезирующего устройства.
Имеются исследования, сравнивающие эффективность трансабдоминального и влагалищного доступов выполнения СКП. По данным Maher и соавт., субъективная и объективная оценки эффективности коррекции ПГ трансабдоминальным доступом (94 и 76% соответственно) были несколько выше, чем при использовании влагалищного доступа (91 и 61% соответственно) [4]. Однако трансабдоминальный доступ был ассоциирован с большей длительностью операции, большей стоимостью и более длительным периодом реконвалесценции.
Активное развитие эндоскопической техники в конце XX в. сделало возможным выполнение CRG лапароскопическим доступом. Nasti и соавт. провели сравнение результатов стандартной открытой и лапароскопической СКП [5]. Результаты хирургического лечения были одинаковыми в обеих группах, однако частота осложнений была значительно выше в группе открытой CRG (20,0 против 12,7%).
С момента своего появления СКП с роботической ассистенцией успела зарекомендовать себя как эффективная методика коррекции ПГ, обладающая всеми преимуществами минимально-инвазивной техники. Так, Barboglio и соавт. описывают опыт выполнения 127 РА СКП с осуществлением при необходимости надвлагалищной ампутации матки [6]. Через год после оперативного лечения рецидива апикального пролапса не было выявлено ни у одной пациентки, опущение передней стенки влагалища было диагностировано у 7 (5,5%) женщин. По данным опросников Pelvic Floor Distress Inventory-20 и Pelvic Floor Impact Questionnaire-7, отмечено значительное улучшение субъективной оценки качества жизни. В другой работе Ploumidis и соавт. сообщают о 97 пациентках, перенесших РА СКП [7]. Авторами отмечена высокая долгосрочная эффективность методики в сочетании с низким риском интра- и послеоперационных осложнений.
Спорным остается вопрос о необходимости симультанной ампутации матки. В большинстве стран мира ампутация матки является стандартной процедурой при коррекции ПГ, несмотря на то что опущение матки является следствием, а не причиной пролапса. Многие женщины отказываются от ампутации матки, аргументируя это желанием сохранить фертильность и верой в важную роль матки для получения сексуального удовлетворения. Также не соглашаются с рутинным выполнением ампутации матки и некоторые авторы [8, 9]. Однако при выраженном опущении матки и отсутствии заинтересованности пациентки в сохранении органа данная процедура может быть выполнена.
Заключение
СКП с роботической асистенцией демонстрирует высокий уровень безопасности и воспроизводимости, а также высокую эффективность данной операции у пациенток с опущением гениталий. Необходимо отметить, что роботическая хирургия не лишена недостатков. К ним можно отнести отсутствие обратной связи, довольно длительный процесс установки консоли пациента, а также высокую стоимость обучения и внедрения роботической техники. Те ни менее, обладая всеми преимуществами минимально-инвазивной техники, роботическая система совершеннее традиционной лапароскопической и открытой методик за счет улучшенной 3D-визуализации всех анатомических структур, тщательной и «бережной» диссекции, нивелирования тремора, прецизионного прошивания необходимых структур, минимальной тракции и смещения окружающих органов и тканей. Эти преимущества позволяют снизить травматичность вмешательства, уменьшить риск развития осложнений и сократить послеоперационное время нахождения пациентки в стационаре до нескольких суток, обеспечивая при этом прекрасный косметический эффект.
Работа выполнена при поддержке РНФ, соглашение № 16-15-00233


