Редкие (орфанные) заболевания (англ. rare disease, orphan disease) – заболевания, затрагивающие небольшую часть популяции. Единого международного определения орфанных болезней нет. Нет и общего для всех стран критерия «редкости» заболевания. В США редкими считают болезни с распространенностью 1 случай на 1500 человек, в Европе – 1 на 2000, в Японии — 1 на 50 тыс., в Австралии — 1 человек менее чем на 2000 жителей страны, в России – 1 на 10 тыс. человек. Однако эти цифры можно считать условными, т.к. для разных заболеваний они могут меняться в связи с появлением новых данных или в зависимости от географического положения и состава популяции. Орфанными называют не просто малораспространенные заболевания – это хронические тяжелые или угрожающие жизни болезни, которые могут приводить к инвалидности, сокращению продолжительности жизни. Классифицировать их непросто: некоторые редкие недуги не имеют даже кода в международном классификаторе болезней. К орфанным относят почти все генетические заболевания – они передаются по наследству и сопровождают человека всю жизнь.
Для большинства редких заболеваний не существует эффективного лечения, однако при сегодняшнем уровне фармакологической индустрии производится множество лекарственных препаратов, позволяющих улучшить качество и продолжительность жизни пациентов. Как правило, пациенты с разными редкими заболеваниями сталкиваются с одними и теми же вопросами. В первую очередь это проблемы, связанные с диагностикой конкретного заболевания, поиском квалифицированного специалиста и достоверной информации о заболевании. Отсутствие определенного диагноза существенно затрудняет тактику лечения и прогноз заболевания. В случае наследственного заболевания диагноз необходим для прогноза в отношении вероятности рождения других больных в данной семье. В связи с вышеизложенным во всем мире признается необходимость принятия соответствующих мер на государственном уровне, т.к. решение вопросов, связанных с диагностикой, лечением и социальным обеспечением пациентов с редкими заболеваниями, а также проведение специализированных научно-исследовательских программ невозможны без поддержки и финансирования со стороны государства. Уровень такой поддержки в разных странах варьируется, при этом в некоторых государствах существуют специальные государственные программы, направленные на поддержку данной категории больных. Сотни редких заболеваний уже можно диагностировать различными методами анализа биологических образцов (биохимическими, иммунологическими, цитогенетическими, молекулярно-генетическими и др.). Создание специализированных регистров по отдельным заболеваниям позволяет проводить поиск причин и изучать их клинические особенности. Единая информационная база, которой могут пользоваться как исследователи, так и врачи, позволяет обмениваться информацией и повышает эффективность усилий в решении задач диагностики и лечения пациентов.
Впервые в российском законодательстве определение понятия «орфанные болезни» было дано в 2011 г. в Федеральном законе «Об основах охраны здоровья граждан в Российской Федерации». В этом документе редкие (орфанные) они определяются как заболевания, имеющие распространенность не более 10 случаев на 100 тыс. населения (или 1 случай на 10 тыс.). По разным оценкам, в России насчитывается от 300 тыс. до 5 млн человек, страдающих редкими болезнями. Отсутствие более точной статистики связано с тем, что само понятие орфанного заболевания введено совсем недавно. Кроме того, в 2012 г. Правительством РФ был утвержден перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности, представленный 24 нозологиями и размещенный в открытом доступе на официальном интернет-портале правовой информации (pravo.gov.ru) [1]. Также были утверждены правила ведения Федерального регистра лиц, страдающих редкими (орфанными) заболеваниями, обозначенными в перечне. По данным Минздрава, в настоящее время разработаны 24 стандарта оказания помощи пациентам с редкими заболеваниями, угрожающими жизни и приводящими к инвалидности. Основная часть финансовой нагрузки по лечению орфанных больных из списка ложиться на региональные бюджеты.

Одним из орфанных заболеваний, представленных в регистре, является наследственный ангиоотек (НАО) – заболевание указано как дефект системы комплемента (D 84.1). На сегодняшний день проблемы гиподиагностики данного заболевания, относящегося к первичным иммунодефитам, стоят очень остро. С клиническими проявлениями данной патологии на первичном этапе сталкиваются педиатры, врачи общей практики, хирурги, отоларингологи. В связи со скудной информацией о НАО постановка диагноза, к сожалению, может занять многие годы. В данной статье мы бы хотели осветить общие сведения о данном заболевании и затронуть вопросы лекарственного обеспечения этой категории больных.
Определение, патогенез и клиническая картина
НАО – редкое, потенциально жизнеугрожающее, генетически детерминированное заболевание, связанное с дефицитом или снижением функции С1-ингибитора (C1INH), характеризующееся рецидивирующими отеками глубоких слоев дермы различной локализации, которые сохраняются от нескольких часов до нескольких дней и в большинстве случаев проходят бесследно без дополнительной терапии [2]. К характерным особенностям отеков при НАО относится отсутствие зуда, гиперемии кожи, сопутствующей крапивницы, а также эффекта от лечения глюкокортикостероидами (ГКС) и антигистаминными средствами. НАО относится к первичным иммунодефицитам без инфекционного синдрома; в патогенезе данного заболевания основную роль играют нарушения в системе комплемента. Распространенность 1:50 тыс. Для данного заболевания в большинстве случаев характерен аутосомно-доминантный тип наследования. Около 25% больных не имеют семейной истории ангиоотеков (мутации de novo) [2]. Достоверных данных о распространенности НАО среди населения России нет, что обусловлено низкой выявляемостью данного заболевания и отсутствием достаточной информированности врачей об этом заболевании.
На сегодняшний день выделяют 2 формы НАО [3–6]: 1) НАО вследствие недостаточности C1INH и 2) НАО с нормальными или почти нормальными антигенными и функциональными уровнями C1INH.
НАО вследствие недостаточности C1INH представлен двумя типами ангиоотеков и подразделяется на основании антигенного уровня C1INH: НАО типа 1 (НАО-1) характеризуется низкими антигенными и функциональными уровнями C1INH, в то время как НАО типа 2 (НАО-2) возникает вследствие дисфункции C1INH и характеризуется нормальным (или) повышенным антигенным, но пониженным функциональным уровнем C1INH.
В свою очередь существует два подтипа НАО с нормальным уровнем C1INH: НАО, возникающий по причине мутации фактора XII свертываемости крови, и НАО, возникающий по неизвестной причине. Первый подтип ранее называли эстрогензависимым вариантом ангиоотека, на сегодняшний день выделяют группу пациентов с рецидивирующим ангиоотеком и семейным анамнезом заболевания, у которых была выявлена мутация в гене, кодирующем XII фактор свертываемости крови, локализованная в V хромосоме [3–4]. Наличие указанного генетического дефекта влечет за собой нарушение кининового профиля, что приводит к повышению продукции брадикинина. На сегодняшний день имеются скудные данные о подтипе НАО, возникающего по неизвестной причине, по той же причине он не внесен в официальную классификацию [2, 4].
Брадикинин является медиатором, ответственным за возникновение ангиоотека у пациентов с НАО [7]. Далее, говоря о НАО, мы будем учитывать, что на сегодняшний день эта группа изолированных ангиоотеков классифицируется как брадикининовые ангиоотеки. Брадикинин – это олигопептид, вырабатываемый при активации контактной системы, который может потенциально повышать сосудистую проницаемость путем связывания со своим рецептором (BKR2) на эндотелиальных клетках сосудов. В зависимости от фармакологических свойств выделяют 2 подтипа рецепторов к брадикинину: BKR1 и BKR2. Брадикинин расщепляется из высокомолекулярного кининогена калликреином плазмы, который физиологически продуцируется из зимогена посредством активации фактора XII свертываемости крови при активации контактной системы. Механизм, который приводит к активации контактной системы in vivo, на сегодняшний день не изучен. В свою очередь С1INH на нескольких этапах участвует в контроле активации контактной системы, являясь важным ингибитором фактора XII и калликреина плазмы. При пониженном уровне или нарушении функции C1INH может возникнуть выброс брадикинина с образованием ангиоотека [7, 8].
После воздействия инициирующего фактора недостаточность C1INH ведет к неадекватной выработке брадикинина – повышается сосудистая проницаемость, вызывая расширение сосудов, сокращение висцеральной гладкой мускулатуры и последующий выход жидкости в ткани, вызывающий незудящий отек. Таким образом, в плазме пациентов с брадикининовыми ангиоотеками наблюдается высокий уровень брадикинина ввиду недостаточности C1INH.
Обычно НАО дебютирует в первые 2 десятилетия жизни – чаще в пубертатном периоде. Частота приступов – в значительной степени варьирующийся показатель. Чаще всего симптомы заболевания начинают беспокоить пациента в детстве [5], но более активно заболевание обычно проявляется в период полового созревания [9].
К потенциальным триггерам обострения относятся механическая травма, интенсивность которой может быть разной – от легкого сдавления одеждой или легкого ушиба до перелома кости; хирургическое вмешательство; малоинвазивные диагностические процедуры; экстракция зуба; лекарственные препараты (ингибиторы АПФ; оральные контрацептивы, содержащие эстроген; препараты гормональной заместительной терапии), инфекции, стресс, алкоголь. Для изолированных брадикининовых ангиоотеков характерна определенная динамика симптомов: отеки достаточно медленно нарастают в течение 12–36 часов и разрешаются в течение 2–5 дней, а абдоминальные симптомы исчезают в течение 12–24 часов.
Клинические проявления НАО характеризуются рецидивирующими отеками различной локализации: кожи лица (губы, периорбитальная область), шеи, туловища, конечностей, слизистых оболочек верхних отделов дыхательных путей, желудочно-кишечного (приступообразная боль в животе) и урогенитального трактов. Приступы могут длиться от 72 до 96 часов и часто протекают в тяжелой форме, тем самым снижая дееспособность, качество жизни пациентов, и могут быть сопряжены со значительными осложнениями и риском смерти [5, 9].
Рецидивирующие периферические и абдоминальные отеки характеризуют около половины всех приступов, но у более чем 50% пациентов в течение жизни происходит хотя бы один приступ со стороны верхних дыхательных путей с риском асфиксии. Многие атаки начинаются с продрома или ауры – обычно это дрожь, покалывание, слабость, разбитость, мраморность кожи. Зуд и крапивница для НАО не характерны, однако примерно треть всех случаев ангиоотека сопровождается гигантской кольцевидной эритемой (erithemaannulare), обильными бледными высыпаниями мультиформного характера без зуда, жжения и местной гиперемии. Продромальный период предшествует приступу за несколько часов или за день (продолжительность предшествующих симптомов – до 1 дня) у 50% пациентов с НАО [5].
Диагностика
Лабораторными критериями диагноза НАО являются:
- уровни антигена C1INH, составляющие <50% от нормы (при двух отдельных определениях) у пациента в возрасте старше года вне приступа;
- уровни функциональной активности C1INH <50% от нормы (при двух отдельных определениях) у пациента в возрасте старше года вне приступа;
- мутация гена C1INH, приводящая к нарушению синтеза и/или функции соответствующего белка.
Кроме того, проводится скрининг (родителей, братьев, сестер, детей пациента с НАО), включающий [2]:
- исследование уровня С4 компонента комплемента;
- исследование концентрации и функциональной активности C1INH;
- генетическое обследование.
При приеме пациента с проявлениями рецидивирующих отеков без явлений крапивницы практическому врачу можно рекомендовать задать больному следующие 6 вопросов:
1. Что провоцирует Ваши отеки?
Триггеры, вызывающие отеки при НАО: механические травмы; стоматологические, диагностические и хирургические манипуляции; лекарственные препараты, перечисленные выше; инфекции; алкоголь; психоэмоциональный стресс?
2. Как быстро нарастает и уходит Ваш отек?
У пациентов наблюдается самостоятельно проходящий невоспалительный ангиоотек без уртикарной сыпи; медленно нарастающий и длящийся более 12 часов.
3. Поддается ли отек лечению ГКС и антигистаминными препаратами?
Проявления НАО не купируются применением ГКС и антигистаминных препаратов.
4. Бывает ли у Вас спонтанно проходящая боль в животе? Были ли Вы неоднократно госпитализированы с диагнозом «острый живот»?
У пациентов наблюдается спонтанно проходящая боль в животе неясной этиологии, которая часто рецидивирует и нередко длится более 6 часов, может сопровождаться яркими диспепсическими симптомами. Характерен т.н. географический живот вследствие множества оперативных вмешательств.
5. Когда впервые появились симптомы отеков или болей в животе?
Обычно НАО дебютирует в первые 2 десятилетия жизни – чаще в пубертатном периоде.
6. Страдает ли кто-либо из ваших родственников подобными симптомами?
При НАО характерен семейный анамнез рецидивирующего ангиоотека, и/или болей в животе, и/или отека гортани.
Если больной отвечает на перечисленные 6 вопросов утвердительно, с большой вероятностью перед вами пациент, страдающий орфанным заболеванием, сопряженным с дефицитом в системе комплемента.
Лечение
Лечение НАО можно разделить на лечение приступов (лечение по необходимости) и профилактическое лечение (краткосрочное и долгосрочное). У всех пациентов с недостаточностью C1INH должен быть составлен индивидуальный план по методам купирования ангиоотеков и долгосрочной профилактике приступов.
Профилактика приступов НАО
В рамках профилактических мероприятий необходимо выявление триггерных факторов приступов:
- инфекции (например, Helicobacter pylori);
- эстрогены: контрацептивы и заместительная гормональная терапия;
- лекарственные препараты: ингибиторы АПФ или блокаторы рецепторов ангиотензина;
- физический и эмоциональный стресс (жара/холод, чрезмерная физическая нагрузка) [9].
Решение о начале лечения должно приниматься в результате сотрудничества пациента и врача.
Стандартно используемые при ангиоотеке средства терапии, такие как адреналин, ГКС или антигистаминные средства, абсолютно не эффективны при лечении пациентов с брадикининовыми ангиоотеками.
Долгосрочная профилактика приступов. В качестве длительной базисной терапии НАО используют препараты из группы аттенурованных андрогенов и ингибиторы фибринолиза [10–12] (табл. 1).
При назначении препаратов нужно помнить, что и эффективность воздействия, и побочные эффекты 17α-алкилированных андрогенных стероидов дозозависимы [10–12]. Таким образом, у всех пациентов назначенные дозы базисного препарата должны медленно титроваться по направлению к наименьшим возможным, способным контролировать заболевание. Основным ориентиром при подборе дозы является клиника заболевания – отсутствие рецидивов. Лабораторные тесты неинформативны и не являются ориентиром для дозирования.
Краткосрочная профилактика приступов. Оперативные вмешательства, малоинвазивные диагностические процедуры, стоматологические манипуляции могут послужить причиной приступа ангиоотеков. Вследствие этого пациенты с НАО нуждаются в специальной подготовке перед оперативными вмешательствами (экстракции зубов, эндоскопические исследования, полостные операции и др.).
С целью профилактики рекомендуется назначать даназол из расчета 10 мг/кг/сут (максимальная суточная доза – 600 мг) за 5 дней до и в течение 2 дней после вмешательства или блокаторы фибринолиза за 2 дня до и в течение 2 дней после вмешательства: аминокапроновая кислота (8–12 г/сут в 3–4 приема внутрь) или транексамовая кислота (1–3 г/сут в 2–3 приема) [5]. При срочных операциях за час до или непосредственно перед вмешательством назначаются инфузии 300–400 мл свежезамороженной плазмы (СЗП). Краткосрочную профилактику можно проводить посредством введения 1000–2000 ЕД концентрата С1INH или в отсутствие такового – инъекции 2 доз (10 мл/кг для детей) плазмы или СЗП, обработанной методом «растворитель/детергент», за несколько (до 6) часов до начала запланированной процедуры [5]. Ввиду отсутствия исследований по оценке сравнительной эффективности этих препаратов при краткосрочной профилактике рекомендации основаны на экспертном мнении и небольших неконтролируемых наблюдательных исследованиях [5]. Для проведения процедур неотложной помощи и для беременных пациенток предпочтительно введение концентрата C1INH [14]. Доза препарата при кратко-срочном лечении по необходимости (C1INH, экаллантид или икатибант) должна быть доступна в готовом виде, в частности при проведении стоматологических процедур или операций, в рамках которых требуется интубация.
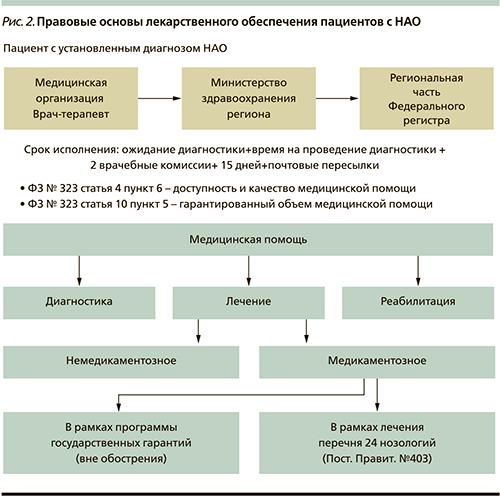
Лечение острого приступа НАО
В настоящее время для лечения НАО рекомендованы и применяются на практике в различных странах препараты, представленные в табл. 2. Эти препараты эффективны и безопасны как для лечения острых атак, так и для краткосрочной профилактики приступов ангиоотеков [2, 6]. Эффективность препаратов максимальна, если их вводить в начале приступа.
В РФ чаще всего при лечении приступа НАО применяют СЗП, которая содержит C1INH из расчета 10–15 мл/кг/сут. По сравнению с андрогенами СЗП более дорогая и связана с риском инфицирования (гепатиты В и С, ВИЧ-инфекция), но в целом считается более эффективной в предотвращении или минимизации атак [9]. Международные рекомендации указывают, что СЗП должна использоваться для лечения приступов НАО, когда другое проверенное эффективное лечение недоступно. СЗП, как правило, эффективна при лечении острых приступов ангиоотека; однако иногда эффект не проявляется или даже может произойти резкое утяжеление симптомов [15]. Также, согласно рекомендациям, при остром приступе НАО необходимо увеличить дозу базисной терапии даназолом.
В РФ для купирования острых атак НАО зарегистрирован Икатибант (Фиразир) – специфический антагонист В2-рецепторов брадикинина (в т.ч. для самостоятельного введения пациентами). Вводится подкожно в острую фазу отека по 3 мл (шприц в комплекте с инъекционной иглой).
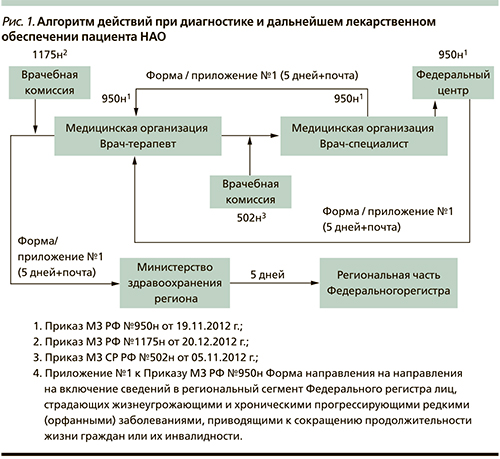
Алгоритм действий врача при установлении диагноза НАО
Сегодня как пациенты с НАО, так и врачи, наблюдающие данную категорию больных, сталкиваются с широким кругом проблем, связанных с отсутствием должного лекарственного обеспечения. Не будем забывать о том, что как препараты базисной терапии, так и препараты, предназначенные для купирования острой атаки НАО, необходимы пациентам по витальным показаниям и их нехватка сопряжена с вполне осязаемой возможностью летального исхода.
Итак, какие действия должен предпринять врач, подтвердивший диагноз НАО у конкретного пациента? Внесение сведений о больном НАО в регистр пациентов является самым первым и обязательным шагом для получения законодательно гарантированной льготной медицинской помощи по месту жительства (рис. 1). Сведения из регистра передаются в местные органы здравоохранения и Минздрав РФ и служат основанием для получения в дальнейшем льготной медицинской помощи, в т.ч. лекарственного обеспечения.
Согласно Постановлению Правительства РФ от 26.04.2012 г. № 403 и Приказу МЗ РФ от 19.11.2012 г. № 950н, для выполнения задачи по регистрации сведений о пациентах в каждом субъекте РФ должен быть определен медицинский работник, ответственный за ведение регионального сегмента Федерального регистра.
Лечащий врач или врач, впервые поставивший диагноз, направляет сведения о пациенте с НАО работнику, ответственному за ведение регистра пациентов в данном регионе.
В направлении врач указывает следующие сведения:
- паспортные данные больного;
- данные полиса обязательного медицинского страхования (ОМС);
- страховой номер индивидуального лицевого счета (СНИЛС);
- наименование учреждения, где впервые пациенту поставили диагноз;
- сведения о выписанных пациенту лекарственных препаратах и др.
Расходы на лечение любого орфанного заболевания очень велики, и без государственной поддержки этим больным не обойтись. К сожалению, ситуация с лекарственным обеспечением пациентов с НАО разнится в зависимости от субъекта РФ. К примеру, в Екатеринбурге для обеспечения пациентов с НАО и другими орфанными заболеваниями создана и успешно реализуется региональная программа в рамках Территориальной программы государственных гарантий бесплатного оказания гражданам медицинской помощи. В некоторых же регионах единственным способом получения медицинской помощи для орфанных больных становится обращение в суд.
Правовая помощь пациентам с НАО
В нарушение порядка обеспечения лекарственными препаратами лиц, страдающих орфанными заболеваниями, в частности НАО (дефект в системе комплемента), имеют место случаи отказа в предоставлении необходимых препаратов по разным обстоятельствам. Для предотвращения необоснованных отказов пациентам следует руководствоваться следующими рекомендациями.
Во-первых, необходимо убедиться, что врачебная комиссия, возглавляемая руководителем медицинской организации или его заместителем, подтвердила наличие у вас заболевания (диагноз) и назначила необходимое лечение. Заключение консилиума носит лишь рекомендательный характер и не является основанием для окончательного решения о назначении лекарственного препарата. О различиях в полномочиях врачебной комиссии и консилиума врачей см. ст. 48 ФЗ от 21.11.2011 г. № 323-ФЗ (ред. от 08.03.2015 г.) «Об основах охраны здоровья граждан в Российской Федерации») и При-каз Минздравсоцразвития России от 05.05.2012 г. № 502н (ред. от 02.12.2013 г.) «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации».
Во-вторых, необходимо убедиться, что Ваши данные внесены в региональный сегмент федерального регистра пациентов, страдающих орфанными заболеваниями. Согласно Постановлению Правительства РФ от 26.04.2012 № 403 (ред. от 04.09.2012 г.) и Приказу МЗ РФ от 19.11.2012 г. № 950н это является обязательным условием для закупок лекарственных препаратов за счет средств бюджета региона, где Вы проживаете.
В-третьих, необходимо обратить внимание на такое основание отказа в лекарственном обеспечении, как отсутствие стандарта лечения соответствующего заболевания. Аргументируя свою позицию, можно сослаться на Письмо Министерства здравоохранения РФ от 8 июля 2013 г. N 21-6/10/2-4878, в котором сформулирована официальная позиция государственного органа о недопустимости отказа по данному основанию.
В-четвертых, следует помнить, что в соответствии со статьями 4 (п. 1–6), 5, 16, 44 и 83 ФЗ от 21.11.2011 г. № 323-ФЗ на органы власти субъектов РФ возложена обязанность по обеспечению граждан всеми лекарственными препаратами, предназначенными для лечения заболеваний, включенных в Перечень, утвержденный Постановлением Правительства РФ от 26.04.2012 г. № 403. Соответственно, отказ в обеспечении Вас лекарственными препаратами со ссылкой на нехватку или отсутствие в бюджете средств (при наличии установленного диагноза, назначенного лечения и записи в регистре пациентов) является незаконным, и при возникновении подобного рода конфликта, следует направлять требование в Департамент здравоохранения субъекта РФ на имя руководителя или заместителя руководителя. В случае если указанные действия не дадут результата, то, получив отказ в удовлетворении требований, необходимо обратиться в межрайонную прокуратуру с соответствующей жалобой или же в суд общей юрисдикции по месту жительства с заявлением о признании такого отказа незаконным и требованием обязать органы здравоохранения закупить необходимый препарат.
Правовые основы лекарственного обеспечения пациентов с НАО включают (рис 2):
Конституция РФ (принята всенародным голосованием 12.12.1993 г.), статья 41.
Федеральный закон от 21.11.2011 г. № 323-ФЗ (ред. от 21.07.2014 г.) «Об основах охраны здоровья граждан в Российской Федерации» (статья 16, 44, 83).
Постановление Правительства РФ от 26.04.2012 г. № 403 «О порядке ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента» вместе с Правилами ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента).
Приказ МЗ РФ от 19.11.2012 г. № 950Н «О формах документов для ведения регионального сегмента Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и порядке их представления» (вместе с «Порядком представления медицинскими организациями в уполномоченные органы исполнительной власти субъектов Российской Федерации направлений на включение сведений (внесение изменений в сведения) о лицах, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и извещений об исключении указанных сведений из региональных сегментов Федерального регистра»).
Письмо МЗ РФ от 08.07.2013 г. – О недопустимости отказа гражданам, страдающим редкими заболеваниями, в лекарственном обеспечении за счет средств бюджетов субъектов РФ.
Определение Конституционного суда РФ от 05.03.2013 г. № 345-О – Регионы обязаны обеспечивать пациентов с редкими заболеваниями дорогостоящими препаратами, при этом имеют право запрашивать федеральный центр о целевой финансовой поддержке.
Вместо заключения
Слово пациентам: Виктор Лебедь, член РОО пациентов (родителей) с первичным иммунодефицитом «Спасем иммунитет»: «Большинство пациентов с НАО еще на пути к правильному диагнозу. Жизнь этих людей наполнена особыми проблемами в быту, учебе, работе, личных отношениях. Нередки депрессии, чувство одиночества и даже безысходности. Поэтому одна из главных наших задач – помощь в выявлении таких пациентов путем повышения знаний и интереса к НАО у специалистов и общественности. Мы обладаем самой свежей информацией о заболевании, его симптомах, способах профилактики и лечения, опыте пациентов. Сведения публикуем на созданном нами русскоязычном сайте www.hereditary-angioedema.org, целиком посвященном НАО.
И самое главное – мы стараемся быть вместе, чтобы поддерживать друг друга. НАО – болезнь непростая, но не безнадежная. Просто надо научиться жить с ней».
Каждый год в последний день февраля по инициативе EURORDIS (Европейской организации по редким болезням) отмечают Международный День редких заболеваний. Дата выбрана не случайно: 29 февраля – самый «редкий» день в году.
16 го мая 2012 г. объявлен днем НАО. Этому дню посвящен вебсайт www.haeday.org, на котором есть возможность отправить улыбку-картинку всем пациентам и врачам, связанным с НАО, да и вообще всему миру.
HAEi (http://haei.org/ru) – Международная организация пациентов с недостаточностью C1-ингибитора (International Patient Organization for C1 Inhibitor Deficiencies) – это всемирная организация, призванная повысить степень осведомленности мировой общественности о проблемах людей с недостаточностью C1INH.
В РФ пока нет четко сформированного сообщества пациентов с наследственными ангиоотеками.


