Введение
Наследственный ангиоотек (НАО) – редкое потенциально жизнеугрожающее генетически детерминированное орфанное заболевание.
Первые случаи наследственного ангионевротического отека описаны Уильямом Ослером почти 140 лет назад, однако диагностика этого заболевания, впервые клинически проявляющегося в детском возрасте, до сих пор затруднена [1]. Задержка постановки диагноза НАО даже в развитых странах составляет не менее 5 лет, тогда как в РФ эта цифра колеблется от 13 до 20 лет. С учетом распространенности заболевания в общей популяции с частотой примерно 1:10 тыс.–150 тыс. человек и населения РФ 147 млн можно предположить, что с данным диагнозом в РФ должно быть от 2940 до 4900 человек, тогда как на сегодняшний день число зарегистрированных в федеральном регистре пациентов с НАО составляет около 300 человек [2]. Пациенты «без диагноза» годами наблюдаются у врачей различных специальностей, имея массу диагнозов, подчас самых невероятных, остаются без патогенетически обоснованной специализированной медицинской помощи, подвергаются необоснованным оперативным вмешательствам и, к сожалению, нередко погибают от фатальной асфиксии. Помимо низкой информированности врачебного сообщества о данном заболевании ключевой проблемой, не позволяющей адекватно помочь больным НАО, остается отсутствие организованного взаимодействия между специалистами различных профилей (аллергологи-иммунологи, педиатры, врачи скорой и неотложной медицинской помощи, терапевты, хирурги, стоматологи т.д.), которые могут столкнуться с пациентами данной категории [3]. Другим фактором, который приводит к запоздалой или гиподиагностике, служит отсутствие указаний в семейном анамнезе на НАО, что встречается в 25% случаев из-за генетической мутации de novо. Нам бы хотелось в этой статье обсудить особенности течения данного заболевания в детском и подростковом возрасте и привлечь внимание врачей-педиатров к этой проблеме.
Наследственные ангиоотеки
НАО – хроническое заболевание, относящееся к группе первичных иммунодефицитов с аутосомно-доминантным наследованием и неполной пенетрантностью, связанное с качественным или количественным генетически детерминированным дефектом генов, кодирующих синтез ингибитора эстеразы компонента комплемента C1, которое проявляется в виде рецидивирующих отеков кожи и слизистых оболочек дыхательных путей, желудочно-кишечного и урогенитального трактов. Код по Международной клинической классификации 10-го пересмотра:
- Д 84.1 – Дефект в системе комплемента.
Патогенез
Основным вазоактивным медиатором НАО является брадикинин. Именно данное обстоятельство обусловливает отсутствие терапевтического эффекта при использовании глюкокортикостероидов, антигистаминных препаратов. Дефицит ингибитора С1-эстеразы (С1-ИНГ) и ряда других факторов приводит к нарушению ингибирования С1r и C1s компонентов комплемента. Следствием является увеличение образования брадикинина из кининогена. Брадикинин взаимодействует с рецепторами к брадикинину 2-го типа на эндотелиальных клетках, что ведет к повышению проницаемости капилляров, экстравазации внутрисосудистой жидкости, в совокупности – к образованию отека.
Характерные особенности отека при НАО: отсутствие зуда, гиперемии кожи, сопутствующей крапивницы, отсутствие эффекта от лечения глюкокортикостероидами и антигистаминными препаратами.
Классификация НАО
Выделяют две формы НАО [4]:
I. НАО вследствие недостаточности C1-ИНГ, представленных двумя типами ангиоотеков и разделенных на основании антигенного уровня C1-ИНГ:
- НАО типа I характеризуется низкими антигенными и функциональными уровнями C1-ИНГ. Встречается среди 80–92% всех пациентов. Болезнь отличается абсолютным количественным дефицитом С1-ИНГ, при этом уровень С1-ИНГ варьируется в пределах 5–30% от нормальных значений;
- НАО типа II возникает вследствие дисфункции C1-ИНГ и характеризуется нормальным (или) повышенным антигенным, но пониженным функциональным уровнем C1-ИНГ.
В 15% случаев среди всех типов НАО выявляется структурный дефект, который отличается снижением функциональной активности С1-ИНГ, хотя уровень С1-ИНГ может оставаться в пределах или быть несколько выше нормы.
При НАО с дефицитом C1-ИНГ аутосомно-доминантное наследование происходит из-за мутации в гене SERPING1, и уже описано 748 мутаций, при которых большинство пораженных пациентов гетерозиготны [5]. Эта генетическая гетерогенность отчасти объясняет вариабельность клинических проявлений у этих больных. Различие между НАО типа I и II имеет диагностический характер. Клиническая картина и лечение одинаковы для обоих фенотипов.
II. НАО c нормальными или почти нормальными антигенными и функциональными уровнями C1-ИНГ:
- НАО с мутацией в гене XII фактора (HAE-FXII), который наследуется по аутосомно-доминантному типу с низкой пенетрантностью;
- НАО с мутацией в гене ангиопоэтина-1 (HAE-ANGPTI);
- НАО с мутацией в гене плазминогена (HAE-PLG);
- НАО с мутацией в гене кининоген-1 (KNG1);
- НАО с мутацией в белке миоферлин (MYOF);
- НАО с мутацией в гене гепарансульфат-глюкозамин 3-О-сульфотрансфераза-6 (HS3ST6) [6–11].
Однако у многих пациентов данной группы генных мутаций не обнаружено и патогенез заболевания остается неясным. Имеются клинические данные, согласно которым брадикинин может играть главную роль в большинстве типов НАО с нормальным уровнем С1- ИНГ, в первую очередь у пациентов с НАО-FXII и НАО-PLG [12, 13]. HАО-ANGPT1 и HАО-MYOF обусловлены мутациями, затрагивающими эндотелий сосудов [10]. НАО с нормальным C1-INH редко встречается среди детей, но в большинстве случаев начинается в подростковом возрасте [14]. В данной статье этот тип НАО не рассматривается.
Особенности клинического течения НАО
Несмотря на тот факт, что данное заболевание генетически обусловлено, его симптомы редко возникают у новорожденных и грудных детей, хотя самое раннее возникновение клиники заболевания описано у 4-недельного мальчика [15]. Несомненно, приступы могут впервые возникнуть в любом возрасте, но обычно появление симптомов НАО с дефицитом C1-ИНГ начинается в возрасте от 5 до 11 лет [16]. У половины женщин с НАО первые приступы развиваются в возрасте до 12 лет и 90% – к 23 годам. Среди пациентов мужского пола с НАО 50 и 90% имеют первые приступы в возрасте до 13 и 25 лет соответственно [17]. В целом в 50% случаев НАО-С1-ИНГ начало заболевания приходится на возраст около 10 лет с увеличением частоты и тяжести приступов в период полового созревания. Более того, существует прямая связь между ранним появлением симптомов и большей тяжестью заболевания на протяжении всей жизни [4].
Как уже отмечалось, при рождении и в раннем детском возрасте (за исключением редких случаев) НАО ничем себя не проявляет. Большинство первых атак у детей проявляются ангио-отеком (АО) кожи. Абдоминальные приступы часто могут оставаться нераспознанными у детей, т.к. боль в животе и диспепсические проявления часто встречаются в детском возрасте. При АО верхних дыхательных путей у детей может быстро развиваться асфиксия, вероятно из-за малого диаметра дыхательных путей.
Частота приступов – в значительной степени варьирующийся показатель. Отличительной чертой отеков при НАО служит постепенная динамика симптомов: отеки достаточно медленно нарастают в течение 12–36 часов и разрешаются в течение 2–5 дней, а абдоминальные симптомы исчезают в течение 12–36 часов.
Потенциальные триггеры обострения НАО: механическая травма, интенсивность которой может быть разной (от легкого сдавления одеждой или легкого ушиба и до перелома кости), хирургическое вмешательство, малоинвазивные диагностические процедуры, экстракция зуба, лекарственные препараты: ингибиторы ангиотензинпревращающего фермента (АПФ), пероральные контрацептивы, содержащие эстроген, препараты гормонозаместительной терапии, инфекции, стресс. У детей большинство приступов возникает из-за инфекций верхних дыхательных путей, механических травм и стресса. У подростков частыми триггерами АО служат менструация и овуляция [18].
Как и у взрослых, НАО-С1-ИНГ у детей характеризуется появлением рецидивирующих плотных безболезненных незудящих отеков, локализующихся практически на любых участках тела: верхних и нижних конечностях (руки, стопы, бедра и др.), на лице (периорбитальная область, губы), в полости рта (язык, мягкое небо), шее, туловище, конечностях, слизистых оболочках верхних отделов дыхательных путей и урогенитального тракта.
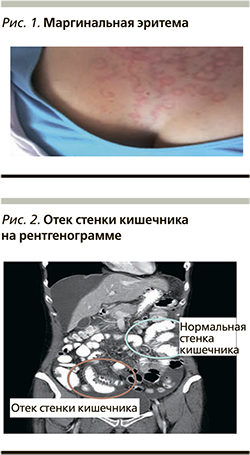 Характерно, что АО HАО-C1-ИНГ не сопровождается явлениями крапивницы, однако примерно 60% от всех случаев АО сопровождается кольцевидной, или маргинальной, эритемой (erithema annulare), обильными бледными высыпаниями мультиформного характера, не сопровождающимися зудом, жжением и местной гиперемией (рис. 1). В педиатрической популяции маргинальная эритема встречается в 42–58% случаев. Маргинальная эритема чаще присутствует в продромальный период приступов АО, однако у детей младшего возраста маргинальная эритема описывается как самостоятельное явление без последующего АО и как первое проявление НАО-С1-ИНГ [18]. Часто данные высыпания ошибочно диагностируются как крапивница, что приводит к неправильной постановке диагноза и назначению неадекватной терапии. Продромальный период предшествует приступу за несколько часов или за день (продолжительность действия предшествующих симптомов – до 1 дня) у 50% пациентов с НАО [19]. Также достаточно часто в период продрома встречаются гриппоподобные состояния, парестезии, усталость, нарушение пищеварения, неспецифическая сыпь и другие неспецифические симптомы.
Характерно, что АО HАО-C1-ИНГ не сопровождается явлениями крапивницы, однако примерно 60% от всех случаев АО сопровождается кольцевидной, или маргинальной, эритемой (erithema annulare), обильными бледными высыпаниями мультиформного характера, не сопровождающимися зудом, жжением и местной гиперемией (рис. 1). В педиатрической популяции маргинальная эритема встречается в 42–58% случаев. Маргинальная эритема чаще присутствует в продромальный период приступов АО, однако у детей младшего возраста маргинальная эритема описывается как самостоятельное явление без последующего АО и как первое проявление НАО-С1-ИНГ [18]. Часто данные высыпания ошибочно диагностируются как крапивница, что приводит к неправильной постановке диагноза и назначению неадекватной терапии. Продромальный период предшествует приступу за несколько часов или за день (продолжительность действия предшествующих симптомов – до 1 дня) у 50% пациентов с НАО [19]. Также достаточно часто в период продрома встречаются гриппоподобные состояния, парестезии, усталость, нарушение пищеварения, неспецифическая сыпь и другие неспецифические симптомы.
Периферические АО (подкожные отеки конечностей) – наиболее частая локализация АО у детей. Рецидивирующий, деформирующий, безболезненный и незудящий АО часто ошибочно принимается за аллергическую реакцию.
Вторым по частоте встречаемости вариантом проявлений НАО у детей являются абдоминальные атаки, вызванные отеком различных участков слизистой оболочки желудочно-кишечного тракта (ЖКТ). Развитию приступов абдоминальных отеков при НАО часто предшествуют ощущения спазмов в околопупочной области, слабость, тошнота, спастические боли в эпигастрии. Отек в области абдоминальных органов, как правило, сопровождается выраженным болевым абдоминальным синдромом, тошнотой, рвотой и диареей. У детей отек ЖКТ может имитировать «острый живот», причем оценить частоту отеков ЖКТ у детей трудно, т.к. «боли в животе» – распространенный симптом, особенно среди младенцев. Клинически болевой синдром проявляется в виде разлитой боли в брюшной полости, кишечных колик; данная клиника при неустановленном диагнозе часто приводит к ненужным лапаротомиям. Приступы могут длиться от 12 до 36 часов и могут проходить в тяжелой форме, что сопряжено со значительными осложнениями и риском смерти [20]. Острая боль в животе неизвестной этиологии является частой жалобой в педиатрической неотложной помощи, и HАО-C1-ИНГ должен быть среди заболеваний, рассматриваемых при дифференциальной диагностике. При ультразвуковом обследовании и компьютерной томографии отмечаются отек слизистой оболочки интестинальной стенки, а также свободная жидкость в брюшной полости (рис. 2), что, хотя и неспецифично для HАО-C1-ИНГ, может быть простым диагностическим инструментом для детей и полезным для установления диагноза, не связанного с острой хирургической патологией [18].
Поражение гортани при HAО-C1-ИНГ редко встречается у детей, однако это может быть первым признаком заболевания и опасным для жизни состоянием. Кроме того, асфиксия может развиваться быстрее, чем у взрослых, из-за меньшего диаметра дыхательных путей у детей [21]. Клиническая картина не отличается от отека верхних дыхательных путей воспалительной или аллергической этио-логии, однако он не поддается лечению кортикостероидами, антигистаминными препаратами и адреналином.
У детей отек может поражать и другие органы, включая половые органы, мочевой пузырь, почки, мышцы, суставы, перикард, плевру и центральную нервную систему, хотя и реже, чем у взрослых.
При вовлечении слизистых оболочек различных органов развивается следующая клиника: пищевода – дисфагия; желудка – тошнота, рвота; кишечника – боли в животе, клиника кишечной непроходимости; мочевого пузыря – дизурия, анурия; мозговых оболочек, внутреннего уха – тошнота, рвота, головокружение, менингеальные симптомы.
Атака НАО может характеризоваться сочетанием отека кожи, слизистых оболочек и поражения ЖКТ. Тяжесть симптомов наследственных отеков весьма вариабельна и не коррелирует с плазменным уровнем С1-ИНГ.
Диагностика
Диагноз НАО ставится на основании данных анамнеза, особенностей клинической картины, лабораторного обследования [4].
При постановке диагноза НАО-С1-ИНГ следует руководствоваться указанными выше характерными симптомами, семейным анамнезом (отсутствует в 25% случаев) и биохимическими тестами. Для лабораторного подтверждения диагноза НАО используется ряд тестов: определение концентрации С4-компонента системы комплемента, концентрации и функциональной активности ингибитора С1-эстеразы [4].
У пациентов с НАО-C1-ИНГ снижен уровень C4, который потребляется из-за активации классического пути комплемента без его физиологического ингибитора C1-ИНГ [22]. C4 является отличным скрининговым тестом для пациентов с дефицитом C1-ИНГ, т.к. почти 100% пациентов с HАО-C1-ИНГI/II имеют низкие уровни этого компонента с чувствительностью от 81 до 96% [4]. Исходя из вышесказанного, алгоритм диагностики рекомендует первоначальный скрининг с определением уровней компонента С4-комплемента в сыворотке или плазме. Если уровень ниже 50% от референтных значений, после исследования следует определить антигенный уровень C1-ИНГ, а затем при необходимости функциональную активность C1-ИНГ. В тех случаях, когда уровень С4 в норме, но клиническая картина свидетельствует в пользу НАО, тест следует повторить во время приступа АО, поскольку в этой ситуации уровень С4 неизменно снижен. Затем диагноз должен быть подтвержден свидетельством того, что уровни C1-I-ИНГ в сыворотке или плазме ниже 50% от референтных значений. При HAО-C1-ИНГ типа I, который имеют около 85% пациентов, уровни и функция C1-ИНГ в сыворотке низкие. При НАО-C1-ИНГ типа II уровни C1-ИНГ в норме или повышены, и для постановки диагноза требуется оценка функциональной активности C1-ИНГ, которую можно проводить с помощью иммуноферментного или хромогенного анализа, причем последний более чувствителен.
В соответствии с общепринятыми стандартами диагноз НАО базируется на двух последовательно установленных снижениях концентрации C4, концентрации (количественной) и/или функциональной активности С1-ИНГ. Длительность периода между исследованиями должна составлять 1–3 месяца [3].
Детям, как и взрослым, диагноз НАО-С1-ИНГ устанавливается по единому алгоритму, но есть некоторые нюансы. Согласно онтогенезу иммунной системы детей, система комплемента незрелая в течение первого года жизни, поэтому уровни С4 и С1-ИНГ в сыворотке крови, а также функциональная активность С1-ИНГ в детском возрасте физиологически низкие [23]. Концентрации C1-ИНГ в сыворотке достигают уровня взрослых в возрасте от 6 до 12 месяцев, а уровни C4 – в возрасте примерно 2–3 лет. По этой причине в отличие от того, что происходит у взрослых, C4 не является точным скрининговым инструментом для диагностики HAО-C1-ИНГ у детей в возрасте до 12 месяцев. Кроме того, в большинстве анализов комплемента отсутствуют подтвержденные референтные значения для детей [18]. Как и у взрослых, окончательный диагноз НАО-С1-ИНГ будет детям установлен только после двух лабораторных скрининговых тестов с соответствующими результатами, второй из которых следует проводить только после 1-го года жизни. Стоит отметить, что каждый ребенок в возрасте до 1 года с семейным анамнезом НАО-C1-ИНГ, даже если он не демонстрирует клинических проявлений заболевания, должен рассматриваться как имеющий НАО-C1-ИНГ до тех пор, пока этот диагноз не будет исключен [4, 23].
Кроме того, в арсенале методов диагностики НАО активно используются генетические исследования. При этом необходимо подчеркнуть, что установление генетического дефекта не обязательно для диагноза НАО.
У 5–10% больных НАО при проведении полноценного генетического исследования не обнаруживается мутаций. Объем обследования и его целесообразность определяет врач-аллерголог-иммунолог.
Создание безопасной среды для ребенка с НАО
Уход за детьми с НАО требует просвещения родителей, опекунов, учителей, воспитателей детского сада и медицинских работников в отношении заболевания, чтобы предотвратить тяжелые последствия НАО, улучшить качество жизни пациентов и их семей. Родители/опекуны должны получать письменную информацию, содержащую индивидуальный план ведения пациента, включая профилактические меры и план действий по лечению приступа [23]. Детей старшего возраста можно научить самостоятельно принимать лекарства дома, чтобы обеспечить быстрое и эффективное лечение во время приступов. Нужно помнить, что выявление и устранение провоцирующих факторов снижают риск приступов. Согласно этой линии рекомендаций, следует избегать физических нагрузок с большой вероятностью механической травмы, своевременно лечить инфекции; показана иммунизация больных и лиц, контактировавших с ними, особенно против вирусов гриппа и гепатита А и В. Следует избегать препаратов, повышающих уровень брадикинина, вызывающих или продлевающих приступ НАО, таких как ингибиторы АПФ, блокаторы рецепторов ангиотензина-II, эстрогены и глиптины. Подростки, нуждающиеся в контрацепции, должны получать только прогестагены. С другой стороны, такие триггеры, как напряженная физическая активность, часто связанная с механической травмой (футбол), и эмоциональные проблемы (стресс), являются неотъемлемым элементом детства и особенно подросткового возраста [24]. Ограничения предполагаемых триггеров должны быть индивидуальными и разумными, применяться вместе с использованием профилактических мер, где это необходимо, с целью избежать каких-либо ограничений в повседневной деятельности и образе жизни. Цель лечения НАО-1/2 в любом возрасте – нормализация жизни детей и повышение качества жизни.
Фармакотерапия
Лечение НАО за последние годы резко изменилось: появились новые и эффективные препараты для купирования приступов. В большинстве случаев прогноз НАО относительно благоприятный в плане выживаемости, при разумном лечении и профилактике приступы возникают крайне редко и не угрожают жизни больного. При этом всегда сохраняется риск отека гортани, что может приводить к асфиксии и летальному исходу.
Лечение НАО можно разделить на лечение приступов (лечение по необходимости) и профилактическое лечение, которое разделяется на краткосрочную профилактику (перед оперативными вмешательствами и стоматологическими манипуляциями) и долгосрочное профилактическое лечение (профилактика рецидивов).
Всем пациентам с недостаточностью С1-ИНГ должен быть составлен индивидуальный план по методам купирования АО и долгосрочной профилактике приступов. При этом необходимо учитывать тяжесть состояния, локализацию отеков, частоту рецидивов и ответ на проводимую терапию, сопутствующую патологию, удаленность от места, где возможно оказание экстренной помощи, возраст и пол пациента, а также способность родителей/опекунов оказать помощь ребенку самостоятельно.
Купирование атаки
Для лечения приступов на территории РФ доступны две группы препаратов: полученный из плазмы концентрат С1-ИНГ (Беринерт®) применяется с рождения, блокатор брадикининовых В2-рецепторов (Фиразир®) – с 2-летнего возраста.
Долгосрочная профилактика
Цель долгосрочной профилактики – снижение частоты и тяжести приступа. Следует отметить, что число атак в год не позволяет предсказывать тяжесть следующей атаки [4].
К доступным в настоящее время препаратам относятся аттенуированные андрогены, антифибринолитические средства и моноклональные антитела против калликреина (ланаделумаб). Первые два давно доступны, имеют меньшую стоимость и не требуют внутривенного доступа для их введения. Однако есть опасения по поводу их побочных эффектов и эффективности [1].
В РФ наиболее широко используемым аттенуированным андрогеном является даназол, однако его применение в отношении детей противопоказано из-за побочных эффектов, которые зависят от дозы и среди прочего включают вирилизацию и закрытие эпифизов [18]. Антифибринолитические средства, такие как транексамовая кислота, имеют меньше побочных эффектов, но их эффективность не доказана, однако они являются безопасным вариантом и чаще используются у детей с НАО с нормальным уровнем C1-ИНГ [12].
Совсем недавно в РФ был одобрен ланаделумаб (Такзайро®), человеческое моноклональное антитело против калликреина для долгосрочной профилактики у детей в возрасте 12 лет и старше [25]. Рекомендуемая начальная доза составляет 300 мг каждые 2 недели подкожно.
В отношении пациентов, которым на фоне лечения удалось добиться контроля приступов, можно рассмотреть возможность снижения дозы до 300 мг каждые 4 недели.
Местные реакции были наиболее частым побочным эффектом [25]. Ланаделумаб (Такзайро®) значительно изменил долгосрочную профилактику, поскольку, обладая отличным профилем безопасности, имеет подкожный путь введения [25, 26]. Тем не менее необходимы дополнительные исследования для оценки эффективности и безопасности для детей младшего возраста.
Краткосрочная профилактика
Оперативные вмешательства, малоинвазивные диагностические процедуры, стоматологические манипуляции могут служить причиной приступа АО. Вследствие этого больные НАО нуждаются в специальной подготовке перед оперативными вмешательствами (экстракции зубов, эндоскопические исследования, полостные операции и др.). С целью профилактики рекомендуется назначать С1-ИНГ (Беринерт®), он безопасен и эффективен для детей и подростков и является препаратом выбора для краткосрочной профилактики [4, 23]. Его применение показано за 1–2 часа до процедуры детям 10–30 МЕ на 1 килограмм массы тела. Доза должна быть выбрана с учетом клинических обстоятельств (например, типа процедуры и тяжести заболевания). Концентраты C1-ИНГ хорошо переносятся при лечении приступов НАО, а также при использовании их в качестве средства предоперационной профилактики. Также необходимо знать, что при развитии отека возможно введение дополнительной дозы препарата данной группы.
Возможно применение антифибринолитических средств: транексамовая кислота в дозе 25 мг/кг/сут, разделенной на 2–3 приема, за 5 дней до и через 2–5 дней после процедуры. Даже при профилактической терапии пациент должен иметь при себе препарат для лечения острого приступа, т.к. риск АО после этих процедур не может быть полностью устранен.
Заключение
За последние годы произошел заметный прогресс в изучении генетики и патофизиологии НАО, что позволило использовать более эффективные и безопасные методы лечения. Однако, несмотря на то что начало заболевания возникает в детстве, НАО остается неизвестным заболеванием, которое недостаточно диагностируется педиатрами. Цель этого обзора – повысить осведомленность о НАО среди этих специалистов, чтобы увеличить диагностическую выявляемость НАО у детей.


