Введение
Эндопротезирование суставов – одно из самых выдающихся достижений не только ортопедии, но и хирургии минувшего столетия в целом. Артропластика крупных суставов обеспечивает улучшение качества жизни больных, поэтому снижение числа послеоперационных осложнений – одна из ведущих задач современной ортопедии [1]. Основной и наиболее затратной проблемой с социально значимыми потерями при артропластике является развитие инфекционных осложнений [2, 3]. После первичного эндопротезирования частота развития инфекции протезированного сустава (ИПС) составляет 0,6–2,4% [4, 5]. Однако, несмотря на относительно низкую заболеваемость, инфекционные осложнения значительно ухудшают состояние больного, а финансовые затраты на их лечение остаются огромными.
Среди возбудителей ИПС лидирующие позиции во всем мире занимают стафилококки, в частности Staphylococcus aureus [6–8]. Большую проблему для выбора рациональной терапии представляют инфекции, вызванные метициллин-резистентными штаммами S. aureus, обладающими геном mecA (MRSA), который кодирует продукцию модифицированного пенициллин-связывающего белка, что обусловливает клиническую неэффективность всех β-лактамов и фенотипически проявляется резистентностью изолятов к метициллину. Выявление штаммов MRSA лишает арсенал клинициста не только многочисленной группы β-лактамных антибиотиков, но зачастую и антимикробных препаратов других групп за счет ассоциированной антибиотикорезистентности [9]. Повсеместная распространенность MRSA и частота их выявления постоянно растут: в США в 2000 г. частота выделения метициллинрезистентных штаммов S. aureus в отделениях интенсивной терапии составила 53%, что на 29% выше аналогичного показателя 1995–1999 гг. [10]. В России в травматолого-ортопедических отделениях устойчивость к метициллину выявлена у 42,1% изолятов S. aureus [11].
Многие годы препаратом выбора для лечения ИПС был и остается ванкомицин, однако за последние годы многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинрезистентными стафилококками, чувствительными к ванкомицину in vitro [12, 13]. В настоящее время перечень препаратов с высокой активностью в отношении MRSA расширен за счет линезолида, даптомицина и цефтаролина. Несмотря на то что инфекция костей и суставов не входит в перечень зарегистрированных показаний к применению указанных антибиотиков, каждый из них имеет определенный потенциал в лечении ИПС. И если по линезолиду, к примеру, уже накоплено много данных о его эффективности при лечении остеомиелитов и ИПС [14, 15], то в отношении даптомицина и цефтаролина еще только идет исследовательская работа.
Цель настоящего исследования: определить локальный статус антибиотикорезистентности ведущего возбудителя перипротезной инфекции – S. aureus, и оценить in vitro антимикробную активность даптомицина и цефтаролина в отношении изолятов MRSA с минимальной подавляющей концентрацией (МПК) ванкомицина более 1,5 мкг/мл.
Материал и методы
В исследование включены 815 штаммов S. aureus, выделенных из биологических материалов (тканевых биоптатов, аспиратов) и с компонентов удаленных конструкций (эндопротезов, цементных спейсеров) пациентов, проходивших лечение по поводу перипротезной инфекции в отделении гнойной остеологии в 2010–2013 гг. Бактериологическое исследование биоматериалов выполнено методом прямого посева на питательные среды. Исследование удаленных конструкций включало обязательную деструкцию биопленки с помощью ультразвуковой обработки с целью получения взвеси сессильных микробных клеток в качестве материала, подлежащего культуральному исследованию [16]. Видовую идентификацию штаммов выполняли с использованием микробиологического анализатора «Vitek-2» (BioMerieux). Тестирование резистентности к антибиотикам проведено дискодиффузионным методом с использованием агара Мюллера–Хинтон (BioMedical, Россия) и дисков, содержащих антибиотики: бензилпенициллин (BioMerieux, Франция), ванкомицин, гентамицин, клиндамицин, ко-тримоксазол, линезолид, моксифлоксацин, оксациллин, рифампицин, тетрациклин, фосфомицин, цефокситин, ципрофлоксацин и эритромицин (Oxoid, Великобритания). Кроме того, у 193 изолятов MRSA методом эпсилометрии (Е-тестов) (Oxoid, Великобритания) были определены МПК ванкомицина; из них у 27 штаммов MRSA с МПК ванкомицина ≥ 1,5мкг/мл, тем же методом (Е-тесты Oxoid, Великобритания) были определены МПК цефтаролина и даптомицина. Интерпретация результатов проведена в соответствии с критериями EUCAST, версия 1.3 [17].
Эпидемиологический анализ данных, полученных в результате исследования, выполнен с применением программы «Система микробиологического мониторинга “Микроб-2“» (© 1999–2013 МедПроект-3); статистическая обработка – с помощью MS Office Excel, 2007 (Microsoft, США); для статистического анализа полученных данных был использован Z-критерий стандартного нормального распределения для оценки разности между долями [18].
Результаты
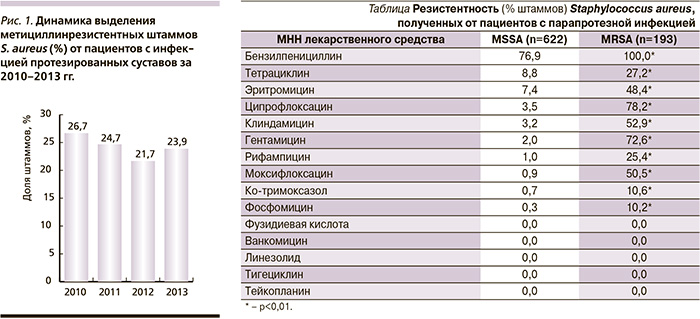
В общем пейзаже возбудителей ИПС за 2010–2013 гг. доля штаммов S. aureus составила 43,4%. Метициллинрезистентность имела место у 24,5% вошедших в исследование изолятов, что несколько ниже, чем указывается в научной литературе [10, 11]. За период исследования существенной динамики данного показателя не выявлено (рис. 1).
Все выделенные штаммы золотистых стафилококков (см. таблицу) были чувствительны к фузидиевой кислоте, ванкомицину, тейкопланину, тигециклину и линезолиду. В группе метициллинчувствительных стафилококков (MSSA) высокая резистентность наблюдалась только к бензилпенициллину, к другим препаратам были чувствительны более 90% штаммов MSSA. Однако в отношении штаммов MRSA тестируемые антибиотики демонстрировали гораздо меньшую активность (p<0,01) Устойчивость MRSA была высокой к гентамицину и ципрофлоксацину (72,6 и 78,2%), около половины изолятов были устойчивы к моксифлоксацину, клиндамицину, эритромицину. Антибиотиками, наиболее активными после гликопептидов, линезолида и тигециклина, были фосфомицин и ко-тримоксазол, к которым были чувствительны около 90% штаммов MRSA. Рифампицин и тетрациклин сохранили эффективность в отношении 74–75% метициллинрезистентных штаммов S. aureus.
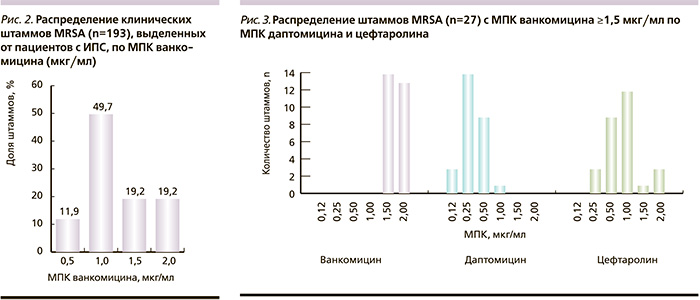
Несмотря на результаты дискодиффузионного метода, который определил все тестируемые штаммы как чувствительные к ванкомицину, методом Е-тестов установлена гетерогенность изолятов MRSA по уровню МПК ванкомицина (рис. 2). Штаммы с МПК, превышающей 2 мкг/мл, выявлены не были, однако не более 12% штаммов характеризовались МПК ванкомицина 0,5 мкг/мл. При этом доля изолятов MRSA с МПК, равной или превышающей 1,5 мкг/мл, составила почти 40%, из которых у половины МПК ванкомицина была 2 мкг/мл.
В ходе исследования мы установили, что среди штаммов с МПК ванкомицина ≥1,5 мкг/мл у 96,3% изолятов значения МПК даптомицина не превышали 0,5 мкг/мл (рис. 1), у 88,9% значения МПК цефтаролина были ≤ 1 мкг, 3 изолята (11,1%) продемонстрировали резистентность к данному антибиотику.
Обсуждение результатов исследования
Антибактериальная химиотерапия, назначаемая пациентам с ИПС в комплексе с хирургическим лечением, при условии полноценного иммунного ответа на инфекцию призвана обеспечить эрадикацию возбудителей.
В условиях возрастающей резистентности микробных патогенов и отсутствия разработок новых антимикробных препаратов, рекомендованных к применению при инфекциях костей и суставов, усилия исследователей направлены на выработку более рациональных стратегий применения «старых» антибиотиков и определение оптимальных показаний и режимов дозирования для крайне немногочисленных «новых» антибиотиков. Постмаркетинговые исследования антибактериальных лекарственных средств, возможно, позволят найти дополнительные эффективные инструменты для контроля инфекций, способные принести облегчение пациентам и улучшить качество медицинских вмешательств.
Как правило, чувствительные к метициллину S. aureus не вызывают трудностей в выборе антибиотика. Однако участие в этиологии инфекционного процесса MRSA зачастую ставит клинициста в сложную ситуацию при выборе препаратов для этиотропной антибактериальной терапии. Интенсивное изучение метициллинрезистентности в настоящее время во многом обусловлено высокой клинической значимостью данного феномена и повсеместным ростом частоты встречаемости метициллинрезистентных штаммов стафилококков. Трудности выбора препарата могут быть связаны с ограниченным перечнем активных в отношении MRSA антибиотиков, формальным отсутствием показаний к лечению инфекций костей и суставов, необходимостью назначения длительных курсов антибактериальной терапии при лечении ИПС. Кроме того, в процессе лечения клиническая ситуация нередко осложняется нарушением у пациента функции экскреторных органов, развитием нежелательных лекарственных реакций, требующих смены терапии, отсутствием возможности радикальной хирургической санации или развитием рецидива инфекции, что может потребовать смены препаратов и продления курса антимикробной терапии.
Имея in vitro высокую активность в отношении устойчивых к метициллину штаммов стафилококков, а также зарегистрированные показания к лечению инфекций костей и суставов, гликопептидные антибиотики во всех странах мира до настоящего времени остаются препаратом выбора при инфекциях, обусловленных штаммами MRSA [19]. Однако в настоящее время накоплены данные о снижении клинической эффективности ванкомицина при повышении его МПК в отношении отдельных штаммов стафилококков; так, при МПК ≥1 мкг/мл эффективность действия ванкомицина при лечении тяжелых MRSA-инфекций была менее 29% [20]. С учетом особенностей травматолого-ортопедических операций, а именно установки имплантата, имеет важное значение и тот факт, что гликопептиды проявляют в отношении стафилококков лишь бактериостатическое действие. Таким образом, можно предполагать с высокой степенью вероятности, что если МПК ванкомицина в отношении MRSA составляет 1 мкг/мл или более, то монотерапия парапротезной инфекции ванкомицином может оказаться неэффективной. Несмотря на менее частое по сравнению с ванкомицином использование тейкопланина, у штаммов MRSA регистрируется снижение чувствительности к гликопептидам в целом, что проявляется более высокими значениями МПК тейкопланина по сравнению с ванкомицином [21]. Таким образом, перечисленные факты не позволяют рассматривать гликопептиды как оптимальную группу антимикробных препаратов для терапии стафилококковых инфекций после эндопротезирования крупных суставов.
В нашем исследовании не выявлено штаммов S. aureus, устойчивых к линезолиду. Помимо высокой активности линезолида в отношении метициллинрезистентных стафилококков бесспорным преимуществом служат высокая пенетрация в ткани организма, в т.ч. и в костную, и хорошая переносимость; также немаловажно, что при его применении возможно использование ступенчатой терапии. Однако следует принимать во внимание, что продолжительность антимикробной терапии ИПС составляет в среднем 3 месяца [2], в то же время более чем 4-недельная длительность применения линезолида существенно усиливает риск развития нежелательных эффектов из-за его миело- и нейротоксичности [22].
Первый представитель класса глицилциклинов – тигециклин – показал in vitro высокую активность в отношении штаммов S. aureus. Кроме того, он имеет высокую активность и в отношении грамотрицательных микроорганизмов. На экспериментальной модели остеомиелита комбинацией тигециклина с рифампицином была показана 100%-ная эрадикация возбудителя [23]. Однако отсутствие зарегистрированных показаний к лечению остеомиелита и особенно фармакокинетический профиль препарата, характеризующийся слабым распределением в тканях, существенно ограничивают возможности его применения при ИПС.
К фузидиевой кислоте были чувствительны все исследованные штаммы стафилококков. Несмотря на это, фузидин также не может быть рекомендован к монотерапии парапротезной инфекции из-за отсутствия до настоящего времени доказательной базы о его эффективности. Для достижения хорошего антистафилококкового эффекта фузидиевую кислоту, так же как и рифампицин, необходимо сочетать c β-лактамами или фторхинолонами [24].
Новый представитель класса цефалоспоринов – цефтаролин – разрешен к лечению инфекций кожи и мягких тканей, внебольничной пневмонии и не имеет зарегистрированных показаний к лечению остеомиелита, инфекций костей и суставов. Однако благодаря наличию высокого сродства к пенициллин-связывающему белку он обладает бактерицидной активностью в отношении MRSA. В нашем исследовании из 27 наиболее проблемных штаммов MRSA c МПК ванкомицина ≥1,5 мкг/мл только 3 (11,1%) были резистентны к цефтаролину. Данный препарат характеризуется высоким объемом распределения, что позволяет предполагать его хорошее проникновение в ткани. Вышеперечисленные особенности позволяют рассматривать цефтаролин как перспективный препарат в гнойной ортопедии и остеологии. Однако требуется его дальнейшее экспериментальное и клиническое исследование.
По нашему мнению, хорошие перспективы в лечении MRSA-обусловленных инфекций после эндопротезирования крупных суставов имеет даптомицин – циклический липопептид природного происхождения, активный только в отношении грамположительных бактерий.
В нашем исследовании все протестированные штаммы MRSA сохраняли чувствительность к данному антибиотику. Несмотря на то что зарегистрированные показания к применению данного препарата – это осложненные инфекции кожи и мягких тканей, бактериемия, вызванная S. aureus, в т.ч. при инфекционном эндокардите, на сегодняшний день накоплен достаточно большой положительный опыт его применения в лечении инфекций костей и суставов. Даптомицин в дозе 6 мг/кг веса пациента был эффективным в терапии инфекции диабетической стопы и остеомиелита, вызванных MRSA [25]. Кроме того, в ряде экспериментальных работ установлена активность даптомицина в отношении штаммов MRSA в составе микробных биопленок при катетер-ассоциированных инфекциях [26], что, безусловно, представляет интерес для специалистов, занимающихся лечением инфекций, ассоциированных с ортопедическими имплантатами, к которым относят и инфекцию протезированного сустава.
Заключение
Полученные результаты свидетельствуют о том, что основные возбудители ИПС, штаммы S. aureus, в 24,5% случаев резистентны к метициллину и как следствие – обладают не только высокой перекрестной устойчивостью ко всем бета-лактамам, но и ассоциированной устойчивостью к препаратам других групп антибиотиков. Полирезистентность представляет собой очень серьезную клиническую проблему, т.к. существенно затрудняет выбор препаратов для эффективной, безопасной и длительной антибактериальной терапии. Несмотря на отсутствие до настоящего времени среди возбудителей ИПС штаммов MRSA c МПК ванкомицина >2 мкг/мл, при назначении ванкомицина необходимо тщательно оценивать клиническую эффективность терапии и в ее отсутствие назначать альтернативные препараты с высокой активностью в отношении MRSA: линезолид, даптомицин или цефтаролин.


