Иммунологическая эффективность вакцинации беременных против гриппа достигает 70–85% и планово выполняется в некоторых странах Европы и Америки уже более 25 лет, при этом ее целью служит ограничение возможности реализации инфекции в случае эпидемического контакта беременной женщины с вирусоносителем [1, 2]. В поствакцинальном периоде происходит формирование специфического протективного иммунитета беременной с последующей трансплацентарной защитой плода и новорожденного.
В положениях 2005 г. Всемирная организация здравоохранения призывает все страны проводить вакцинацию против гриппа всем беременным в течение эпидемического сезона [3–5]. Беременные составляют группу высокого риска по неблагоприятному течению респираторных инфекций [5, 6].
Физиологические изменения, происходящие при беременности, предрасполагают к развитию серьезных осложнений при любой респираторной инфекции. Доказано, что даже у женщин с неосложненной беременностью воспалительные бронхолегочные заболевания повышают риск преждевременных родов [7, 8]. Материнское инфицирование вирусом гриппа – одна из причин антенатальной гибели плода и новорожденного [6, 9]. В период предэпидемии гриппа увеличивается частота госпитализаций и снижение показателей здоровья беременных женщин [4, 6]. Применяемые к беременным современные субъединичные без- и иммуноадъювантные вакцины показывают одинаковую безопасность и благоприятное течение поствакцинального периода [8]. В связи с этим целью настоящего исследования стала оценка влияния на гестационный процесс и иммуногенность субъединичной вакцины против гриппа у беременных пациенток.
В соответствии с актуальностью проблемы и задачами исследования было проведено комплексное клинико-лабораторное обследование 110 беременных, разделенных на две группы: I группу (основную) составили 58 пациенок, которым была проведена вакцинопрофилактика гриппа субъединичной трехвалентной безадъювантной вакциной; во II (контрольную) вошли 52 пациентки, которым вакцинопрофилактика гриппа не проводилась.
Возрастной аспект у женщин в исследуемых группах был сопоставимым. Средний возраст обследуемых женщин в обеих группах колебался от 18 до 35 лет и составил 27,8±0,6 (I группа) и 24,1±0,3 (II группа) соответственно (р>0,05). Среди женщин сравниваемых групп нами не были выявлены существенные различия по паритету беременностей. Часть обследуемых беременных составили молодые первородящие женщины – 39 (35,4%). В то же время 63 (57,3%) женщины уже имели по 2 или 3 беременности в анамнезе, из них в 79 (72%) случаях первая беременность закончилась срочными родами, в 9,3% (21 пациентка) – медицинским абортом, для 7женщин (3,1%) – самопроизвольным выкидышем в первом триместре.
Количество родов в срок у обследуемых пациенток было сопоставимым: в I группе – 91 (79,8%), во II – 86 (78,9%; p>0,05). Анализ исходов анамнестических беременностей показал, что у 25 (11,1%) пациенток имели место различные формы гестационных потерь. При сравнении данного показателя в клинических группах различий не установлено: (I группа – 12 (10,5%), II – 13 (11,9%; p>0,05). Из числа анамнестических родов наиболее частыми осложнениями беременности стали эпизоды угрозы преждевременных родов (I группа – 8 [18,9%] пациенток и II – 7 [17,3%]), из них у 9 (8,2%) пациенток роды были преждевременными, при распределении по подгруппам существенных различий по этим показателям не выявлено, p>0,05. При этом 95,3% беременностей были желаемыми и 76,7% – планируемыми.
Экстрагенитальные заболевания у обследуемых беременных клинических групп выявлены в 82 (74,5%) случаях. Согласно полученным данным, основную часть соматических заболеваний определили: гипохромная анемия (I группа – 51,7 и II – 57,7%), хроническая урогенитальная инфекция (I группа – 53, 4 и II – 42,3%). Частые острые респираторно-вирусные инфекции – у 8 (13,7%) и 9 (17,3%), хронический бронхит – у 7 (12,7%) и 8 (15,4%) обеих групп соответственно, хронический пиелонефрит – у 6 (10,3%) в первой группе, во второй данной нозологии не наблюдалось. У женщин обеих групп в равных долях присутствовали признаки синдрома вегетативной дистонии, аллергически измененной реактивности и эутиреоидное увеличение щитовидной железы. Необходимо отметить, более чем в 20% случаев у исследуемых пациенток диагностировано нарушение жирового обмена различной степени.
У трети 35 (31,8%) пациенток выявлены микст-формы инфекций, передающихся половым путем. Однако, анализируя их составляющие, в клинических группах не выявлены достоверные различия: в I клинической группе у 10 (17,2%) был диагностирован уреамикоплазмоз, в сочетании с хламидийным инфицированием – у 5 (8,6%), данные нозологические формы во II группе – у 8 (15,3%) и 11 (21,1%) соответственно [р>0,05]). Распространенность в клинических группах вируса папилломы человека также не имеет достоверных различий.
При анализе условно-патогенного микробного пейзажа обследованных пациенток не выявлено достоверного превалирования ассоциантов, p>0,05. Таким образом, группы, по данным обследования инфекционного статуса, имеют достаточно высокий инфекционный индекс. Инфекционный статус обследуемых групп не имеет достоверных различий. Совокупность соматической патологии и инфекционного индекса выделяет обследуемых беременных в группу риска по развитию осложнений бронхолегочных заболеваний, острой респираторной вирусной инфекции, гриппу. При анализе анамнеза установлено, что клинические группы сопоставимы, не имеют достоверных различий в возрастных категориях и репродуктивном статусе.
Женщины были привиты субъединичной трехвалентной вакциной, достаточно широко используемой беременными в профилактике гриппа в европейских странах и США. Препарат содержал антигены трех актуальных штаммов гриппа: A/California/7/2009/H1N1/v, A/H3N2/ (Victoria) и В/Brisbane, эпидемических сезонов 2010–2011 и 2011–2012 гг. Данная вакцина не имеет адъюванта и содержит 45 мкг суммарного количества гемагглютинина. В день проведения вакцинации соматический и акушерский статусы беременных оценивались как удовлетворительные. В течение ближайших 2 недель активных инфекций не регистрировалось. После иммунизации женщин проведена клиническая оценка поствакцинального периода по шкале «Оценка нежелательных постпрививочных реакций» и на основании данных Дневника самонаблюдения.
В течение всего периода времени, отразившего возможные поствакцинальные реакции после введения препарата, не предъявляли никаких жалоб 9 (39,1%) женщин, привитых на II триместре, и 15 (71,4%) – на III триместре беременности (p<0,05).
В целом можно констатировать, что клиническая переносимость беременными субъединичной вакцины против гриппа хорошая и местные кожные симптомы (гиперемия в месте иньекции) не носили стойкого характера, не вызывали системных изменений и не нуждались в специальной медикаментозной коррекции. Длительность описанных симптомов не превышала 1,5–2,5 суток. Оценка гемограммы в динамике поствакцинального периода позволила выявить некоторые различия в форменном составе периферической крови. Так, уровень гемоглобина в исходном периоде среди беременных, подлежащих вакцинации субъединичной трехвалентной вакциной, был ниже, чем во второй клинической группе (p<0,05). В последующем данный показатель не имел выраженных различий.
Несмотря на некоторые колебания значений эритроцитов и лейкоцитов, достоверных изменений этих форменных элементов крови в сравниваемых группах женщин зарегистрировать не удалось (p>0,05). Наблюдали нарастание количества моноцитов в динамике поствакцинального периода у беременных первой группы (5,66%±0,46 – исходный период, 7,40%±1,39 – через 30 дней после вакцинации, p<0,01), что привело к достоверному различию данного показателя для беременных второй клинической группы (3,42%±0,43 – через 30 дней наблюдения, p<0,01). Анализ величины СОЭ выявил некоторое его снижение в I группе по сравнению с II как в исходный период (p<0,05), так и через 7 и 30 дней после вакцинации (p<0,05). Несмотря на некоторые различия, описанные в гемограмме, все параметры периферической капиллярной крови имели допустимые уровни физиологических колебаний и не отражали патологических изменений в организме женщин, что стало одним из свидетельств отсутствия провоспалительной активности используемого вакцинного препарата. Изучая особенности биохимических параметров крови поствакцинального периода беременных, привитых субъединичной вакциной, не выявлено существенных изменений, характеризующих дестабилизацию метаболического гомеостаза. Регистрировалось умеренное повышение уровня креатинина в раннем поствакцинальном периоде (59,05±65,54 мкмоль/л – исходный уровень и 65,54±1,72 – через 7 дней контроля, p<0,05). В те же сроки наблюдения выявлено нарастание концентрации аспартатаминотрансферазы (19,73±1,15 и 25,60±4,15 ЕД/л соответственно, p<0,0в). Уровень щелочной фосфатазы, отражавший процессы транспорта фосфора и клеточной проницаемости, увеличивался в динамике наблюдения. Однако эти изменения зависели не от проведенной накануне вакцинации, а от сроков беременности (61,93±4,51 МЕ/л – до вакцинации, и 86,23±7,84 – через 30 дней после прививки; 51,22±2,80 МЕ/л – во II, и 87,25±10,41 – в III триместре беременности, p<0,01). Аналогичные изменения прослеживались и в контрольной группе беременных.
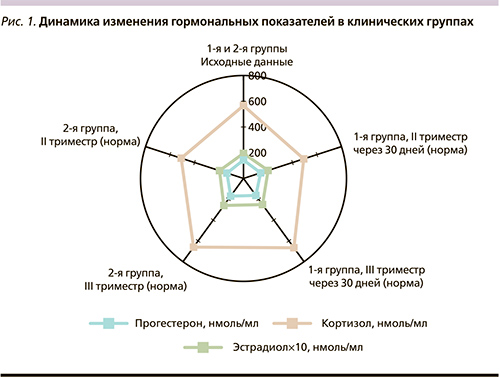
Согласно полученным результатам комплексной оценки обмена липидов в динамике вакцинального процесса, выявлено, что на протяжении 30 дней контроля отсутствует тенденция к изменению описываемых параметров. Основные различия отражали лишь сроки беременности. Так, уровень общего холестерина во II триместре составил 4,59±0,20 моль/л, в III – 5,27±0,15 (p<0,05); концентрация триглицеридов сыворотки крови во II триместре была равна 1,90±0,13 моль/л, в III триместре – 2,84±0,12 (p<0,01). Количество липопротеинов низкой плотности и липопротеинов очень низкой плотности в III триместре беременности превышало значения, полученные во II триместре (p<0,01). В контрольной группе наблюдалась схожая тенденция, что, по-видимому, отражает особенности физиологического развития беременности. Анализ данных сывороточного содержания изучаемых гормонов выявил идентичные закономерности распределения значений в сравниваемых группах, зависивших не столько от проводимой накануне вакцинации, сколько от срока беременности. Содержание прогестерона и кортизола отражало сопоставимые тенденции: повышалось с учетом нарастания срока беременности внутри групп сравнения. Наиболее консервативным показателем в динамике наблюдения выступил эстрадиол, не имевший выраженных колебаний значений между группами и триместрами сравнения. Достоверных межгрупповых различий по всем изучаемым параметрам нами выявлено не было (рис. 1).
Уровень сывороточных иммуноглобулинов основных классов (IgA, IgM, IgG) среди беременных сразу после проведения вакцинации и на 7-й день поствакцинального периода не имел достоверных различий в динамике. Через 30 дней контроля у беременных, получивших вакцину против гриппа, наблюдали более высокий уровень IgA (I группа – 2,56±0,27 мг/мл и II – 1,44±0,35 мг/мл в третьем триместре беременности, p<0,05). В то же время концентрация IgE через 30 дней контроля у беременных, вакцинированных субъединичной вакциной, была ниже (47,08±9,68 МЕ/мл), чем у женщин контрольной группы (76,31±11,5 МЕ/мл, p<0,01). Кроме того, замечено, что у беременных II группы в отдаленные сроки наблюдения уровень данного белка различался по триместрам беременности (63,96±9,37 МЕ/мл – II триместр; 88,14±21,10 МЕ/мл – III, p<0,05).
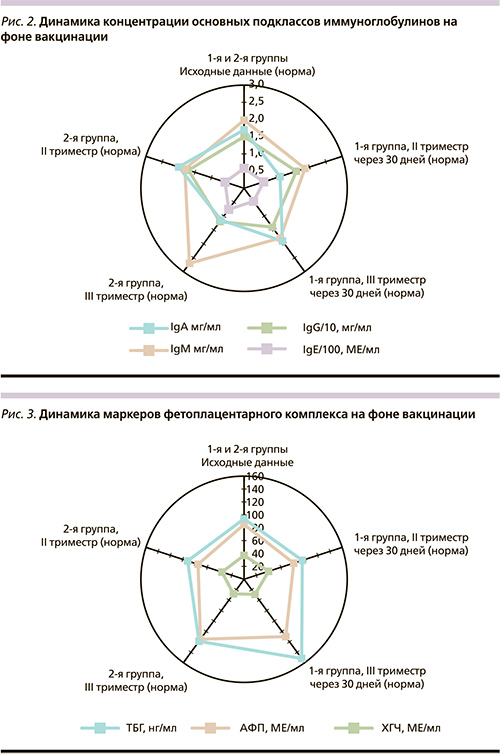
Обнаружены изменения в динамике содержания субклассов IgG у вакцинированных беременных. Уровень IgG1 и IgG3 изотипов повышается с 9,23±0,72 (IgG1) и 0,98±0,06 мг/мл (IgG3) до 13,49±1,10 (IgG1) и 1,26±0,09 мг/мл (IgG3) через 30 дней после вакцинации; p<0,01 и p<0,05 соответственно. Различий между группами сравнения по исследуемым параметрам нами не было выявлено (рис. 2).
Картина цитокинового каскада пациенток обследуемых клинических групп в целом имела тенденции, определенные механизмами физиологической гестационной иммуносупрессии: повышенные уровни интерлейкинов (IL) IL-1, IL-10, отсутствие в поствакцинальном периоде значительного увеличения уровней провоспалительных цитокинов. И тем не менее противогриппозная субъединичная вакцина влияла на цитокинсекрецию: краткосрочное повышение уровня интерферона-γ (IFN-γ), наиболее выраженное у беременных II триместра гестации, что, возможно, характеризует активное вовлечение в поствакцинальный иммунный ответ Th1-опосредованных механизмов. Повышенная продукция IL-4 в раннем поствакцинальном периоде как признак Th2-зависимой активации наблюдалась у женщин, привитых против гриппа в III триместре гестации. Косвенным подтверждением данной тенденции стало отсутствие существенных сдвигов уровня IFN-γ в раннем и позднем поствакцинальном периодах. Все тенденции изменений иммунограммы в исследуемых группах не выходили за границы допустимых коридоров нормы и не вызывали дестабилизации функционирования иммунной системы у беременных пациенток.
Значения фетоплацентарных маркеров у беременных, привитых против гриппа, позволяют сделать следующий вывод: возможно, основные различия описываемых параметров касаются в основном гестационных сроков. Более выраженные различия регистрировались в показателях трофобластического β-глобулина (ТБГ) внутри группы между вторым (85,05±7,16 нг/мл) и третьим (151,72±25,14 нг/мл) триместрами (p<0,001), а также в динамике течения беременности между исходными значениями (93,79±11,47 нг/мл) и через месяц (118,21±13,99 нг/мл) после вакцинации (p<0,05). Необходимо также отметить достоверное снижение ТБГ во II клинической группе, не получавшей вакцинацию. При анализе концентрации ɑ-фетопротеина (АФП): значения во II триместре (53,41±5,39 МЕ/мл) были значительно ниже, чем в III (162,08±22,69 МЕ/мл, p<0,001); исходный уровень (85,72±11,19МЕ/мл) был ниже показателя, полученного через месяц (110,84±13,92 МЕ/мл) после вакцинации (p<0,05). Аналогичные изменения прослеживаются и во II группе без достоверных различий с беременными, получившими субъединичную вакцину (рис. 3).
Значения фетоплацентарных маркеров у беременных, привитых против гриппа субъединичной вакциной, отражают в основном динамические зависимости гестационных сроков. Так, ТБГ у женщин клинических групп, вакцинированных во втором триместре беременности, был достоверно ниже, чем в третьем (р<0,05–p<0,001). Прослежена прямая зависимость нарастания концентрации ТБГ от АФП (r=0,60; p<0,05) с повышением количества данного белка по мере увеличения срока беременности (p<0,001). Значения хорионического гонадотропина (ХГЧ) уменьшались с течением гестационного срока и имели обратно корреляционную зависимость (r=-0,50; p<0,01). По данным УЗИ-фетометрии, выполненной на 21–22-й неделе, значимых изменений основных определяемых показателей не выявлено. Тенденции, отразившие некоторые различия параметров развития плода при изучении фетоплацентарного комплекса, диагностированы на более поздних сроках беременности: 31–33-й неделе гестации – I-я группа: окружность живота (ОЖ) – 301,02±19,34 мм, вес плода – 2607,7±55,1 грамма; II группа: ОЖ – 251,02±19,54 мм, примерный вес плода – 2107,7±31,0 грамм (p<0,05).
Таким образом, выявленные значения фетометрии отражают физиологическую беременность, соответствующую гестационным срокам развития плода, что подтверждается нормальным содержанием маркеров состояния фетоплацентарного комплекса во втором триместре. Поскольку беременность пациенток II клинической группы чаще осложнялась вирусной инфекцией (не проводилась вакцинация), у данных пациенток диагностированы признаки формирующейся фетоплацентарной недостаточности. Различия параметров развития плода получены при изучении на 31–32 неделе на фоне достоверного снижения ТБГ во II клинической группе пациенток, не получавших вакцинацию.
При оценке особенностей течения беременности клинических групп необходимо отметить, что при установленной однородности статуса и репродуктивного потенциала клинических групп выявлены некоторые из них, вероятно связанные со снижением гестационных осложнений, ассоциированных со снижением частоты острых респираторных вирусных инфекций, гриппа и обострений бронхолегочных заболеваний. Во II контрольной группе у 19 (32,8%) беременных во время наблюдения были проявления ОРВИ и гриппа: повышение температуры – у 9 (17,3%); катаральные проявления – у 5 (9,6%); обострение хронического бронхита – у 5 (9,6%). Заболевание гриппом отмечено у 3 (6,8%) пациенток I группы (р<0,05). Ранний токсикоз осложнял первый триместр беременности 7 (12,1%) обследуемых пациенток I клинической группы и 6 (11,5%) контрольной (p>0,05).
Угроза прерывания беременности в группе женщин, не получавших вакцинопрофилактику против гриппа, была достоверно выше: в I клинической группе во втором триместре – 10 (17,2%), во II – 17 (32,7%, p<0,05); в третьем триместре беременности – 9 (15,5%) и 13 (25%) (p<0,05).
Значимыми оказались различия в частоте формирования хронической фетоплацентарной недостаточности у пациенток клинических групп: в I группе – 8 (13,8%), во II – 12 (23% (p<0,001). Во II группе достоверно чаще были признаки синдрома задержки развития плода в сочетании с хронической внутриутробной гипоксией плода у 8 (15,3%) пациенток, в I группе – лишь у 4 (8,6%) (p<0,05).
Проведение вакцинации против гриппа среди беременных обеспечивает уменьшение частоты острых респираторно-вирусных и обострений хронических бронхолегочных заболеваний, что способствует уменьшению частоты нарушений функции фетоплацентарного комплекса.
В большинстве случаев (I группа – 91,4%, II группа – 88,5%) в группах наблюдения беременность завершилась физиологическими родами. При этом у части женщин беременность закончилась преждевременно с рождением недоношенных детей (I группа – 8,6%, II – 11,0%). Кроме того, описаны случаи рождения детей с неврологической патологией перинатального периода, в основном связанной с гестационной незрелостью (I группа – 7,3%, II – 10,4%, p<0,05), синдромом внутриутробной инфекции (I группа – 3,4%, II – 9,6%, p<0,05), аномалии и пороки развития (I группа – 1,7%, II – 1,9%, p<0,05).
Ранний неонатальный период детей, рожденных вакцинированными во время беременности матерями, имел сопоставимые критерии развития. Было установлено, что у детей из I группы наблюдения 8–9 баллов по шкале Апгар сразу после рождения регистрировалось в 87,9% случаев (в контрольной группе – 76,9%, p<0,05). Оценка 6–7 баллов по шкале Апгар, повысившаяся к 5-й минуте до значений 8–9 баллов, встречалась у 12,1% новорожденных группы вакцинированных матерей, что характеризует в целом хорошие показатели функциональной зрелости.
Характер вскармливания детей, рожденных пациентками, вакцинированными против гриппа, существенно не отличался от такового малышей, родившихся во II группе. Естественное вскармливание детей I группы в периоде новорожденности регистрировалось в 92,9% случаев с постепенным снижением доли грудного питания малышей до 83,3% к 3-му месяцу и до 69,0% к 6 месяцам жизни. Эти данные сопоставимы с показателями, полученными в контрольной группе: 88,6% случаев грудного вскармливания в 3 месяца и 60,0% – в 6. Таким образом, вакцинация женщин против гриппа во время беременности не влияет на характер лактации и длительность грудного вскармливания.
Физическое развитие детей первых 6 месяцев жизни исследуемых групп в целом имело сопоставимые параметры. Значения массы и длины тела в разные периоды осмотра детей соответствовали средним коридорам (25–50–75) центильных рядов. Отношение массы к росту детей, родившихся в I группе (индекс Кетле-I), составил 65,5±1,72, что примерно соответствовало значениям аналогичного показателя у детей контрольной группы (67,1±1,03, p>0,05).
Пропорциональность физического развития детей первых месяцев жизни в большинстве случаев имела средние гармоничные значения: в I клинической группе – 48 (82, 8%), во II – 40 (78,9%), p>0,05. С одинаковой частотой выявлялись младенцы со значениями физического развития ниже среднего: в I клинической группе – 11 (18,0%), во II – 11 (21,1%), p>0,05. Однако отмечена тенденция к более позитивным значениям данного показателя в группе новорожденных, рожденных привитыми беременными женщинами. Полученные результаты характеризуют достаточность основных критериев течения периода новорожденности, отражающих популяционную зрелость физического развития независимо от проведенной во время беременности вакцинации матерей против гриппа.
Показатели нервно-психического развития детей группы с материнской вакцинацией существенно не отличались от таковых, полученных от младенцев группы контроля. В целом у 82,8% детей первых 6 месяцев жизни, родившихся от матерей, привитых против гриппа во время беременности, изменения в нервно-психическом развитии отсутствовали, у новорожденных из контрольной группы – в 75%, p>0,05.
Установлено, что дети, рожденные от женщин, вакцинированных во время беременности против гриппа, в 1,7 реже болели респираторными инфекциями негриппозной этиологии в течение первых 6 месяцев жизни, чем дети из контрольной группы: в I клинической группе 14 (24,1%) и во II – 13 (25,0%), p<0,05.
Исследование уровня трансплацентарных IgG-антител у детей, матери которых были вакцинированы во время беременности, показало, что в периоде новорожденности по разным штаммам вируса гриппа уровень серопротекции составил 36,8–73,7%, причем при вакцинации в третьем триместре гестации достоверно выше. Так, при применении субъединичной трехвалентной вакцины показатели серопротекции к вирусу гриппа В составили 63,2–73,7%. Cамые высокие уровни средней геометрической титров антител (СГТАт) к вирусу гриппа А/H1N1/v) и В выявлены у новорожденных, матери которых получили в третьем триместре вакцинацию против гриппа (титр >1:40). В то же время наименьшие значения данного показателя к вирусу гриппа А штаммов /H1N1/v и /H3N2/ зарегистрированы у детей, рожденных от матерей данной клинической группы, но вакцинированных во втором триместре беременности. Через 3–6 месяцев после рождения у детей от вакцинированных матерей выявлено уменьшение СГТАт, что отражает физиологическую элиминацию протективных титров поствакцинальных материнских антител.
Уровни титров протективных антител к вирусам гриппа среди новорожденных отражали тенденцию интенсивной трансплацентарной передачи поствакцинальных антител гипериммунных беременных, вакцинированных на II и III триместрах гестации (r=0,68; p=0,05). У новорожденных материнской группы, которые были привиты во время беременности, высокие (>1:80) и очень высокие (>1:160) титры протективных антител ко всем трем вирусам гриппа выявлены только в подгруппе вакцинации в третьем триместре гестации. Полученные результаты свидетельствуют о высокой иммуногенности данной вакцины в парах мать–ребенок при ее использовании на поздних сроках беременности.
В 3 месяца жизни у большей части детей еще сохраняются гемагглютининингибирующие антитела (ГиАТ), однако не выявляются антитела в высокопротективных значениях (>1:80). Основное число серопозитивных детей имеют титры от средних (>1:40) до (>1:20) низких значений. Спустя 6 месяцев после рождения у детей антитела к вирусу гриппа определяжтся лишь в незначительных титрах ГиАТ (>1:20), что дает возможность утверждать о прекращении действия иммунологического эффекта материнской вакцинации, тем не менее вакцинация проведенной в третьем триместре гестации более эффективна у новорожденных.
Таким образом, анализируя внутриутробный и ранний неонатальный периоды развития детей группы женщин, вакцинированных во время беременности субъединичной вакциной против гриппа, негативного влияния на физиологическое течение беременности не выявлено. В группе новорожденных, рожденных пациентками, вакцинированными во время беременности трехвалентной субъединичной вакциной, достоверно ниже показатели внутриутробного инфицирования и перинатального поражения центральной нервной системы. Ранний постнатальный период жизни детей, рожденных вакцинированными во время беременности женщинами, по сравнению с контрольной группой не отличается по темпам физического и нервно-психического развития, а также по основным показателям здоровья периода новорожденности, уменьшая заболеваемость респираторными инфекциями в неонатальном периоде.
Эффективность вакцинации проявляется в виде формирования полноценной иммунной защиты беременных и новорожденных детей от гриппа. В крови новорожденных в результате вакцинации их матерей во время беременности циркулируют специфические, трансплацентарно переданные IgG-антитела в протективных титрах, элиминирующиеся к 6 месяцам жизни ребенка. Поствакцинальный иммунитет против гриппа, сформированный после вакцинации во время беременности, сохраняется у женщин более 6 месяцев наблюдения.
Иммуногенность используемой вакцины оценивалась критериями СРМР, в которых определены основные параметры эффективности препарата. Анализ эффективности вакцинации против гриппа у беременных независимо от сроков гестации показал, что уровень серопротекции (>70%) через месяц после введения к вирусам A/H1N1/v и В соответствовал критериям высокой иммуногенности. К вирусу гриппа А /H3N2/ уровень серопротекции достигал значений (50%) у беременных, вакцинированных во втором триместре гестации, в то же время субъединичная вакцина оказалась более высокоиммуногенной с серопротекцией (90,5–100%) у иммунизированных пациенток на более поздних сроках – в третьем триместре беременности. Характеризуя динамику нарастания и элиминации ГиАТ по уровню титра антител, было выявлено, что при вакцинации беременных в III триместре установлены высокие значения этого показателя к гриппу А /H1N1/v относительно II триместра, p<0,05. Используемая во время беременности вакцина имеет иммунологическую эффективность в обеспечении женщин долговременной специфической защитой. При использовании данного препарата максимальные показатели уровня серопротекции формируются при использовании в третьем триместре гестации.
Таким образом, анализ данных, полученных при комплексной оценке клинико-лабораторной характеристики беременных, привитых субъединичной трехвалентной вакциной, показал отсутствие дестабилизирующих изменений гуморального метаболического гомеостаза после проведенной вакцинации. Ранний и поздний поствакцинальные периоды сопровождаются незначительными местными и системными реакциями. Проведение вакцинации против гриппа среди беременных женщин формирует устойчивый специфический иммунитет, что обеспечивает уменьшение частоты гриппа, острых респираторно-вирусных заболеваний у матери и новорожденного[10].


