Введение
Витамин D – жирорастворимый витамин-гормон, влияющий на широкий спектр физиологических процессов, включая формирование структуры кости, иммуномодуляцию, развитие нервной системы, регуляцию сосудистого тонуса и артериального давления. Достаточная обеспеченность витамином D характеризуется противоопухолевым, нейропротекторным и нейротрофическим эффектами [1].
Для осуществления своих разносторонних биологических эффектов жирорастворимый витамин D должен эффективно всосаться из тонкого кишечника, поступить в кровь. Обогащенная биологически активными формами витамина D кровь доставляет витамин ко всем тканям организма, в которых расположены рецепторы витамина D (VDR – vitamin D receptor).
Всасывание и биодоступность
Скорость кишечного всасывания витамина D наиболее высока в проксимальных и средних сегментах тонкой кишки [2]. При этом, как и в случае других жирорастворимых витаминов [3], всасывание витамина D существенно зависит от присутствия других нутриентов [4].
Фармакологические и физико-химические исследования показали, что кишечная абсорбция витамина D наиболее полно происходит из растворов т.н. мицелл [5]. В физической химии мицеллы (от лат. mica – крупинка) – коллоидные наночастицы, образующие мелкодисперсную взвесь в большом объеме растворителя. В случае биологических систем такими растворителями являются водные растворы, образующие внутреннюю среду организма.
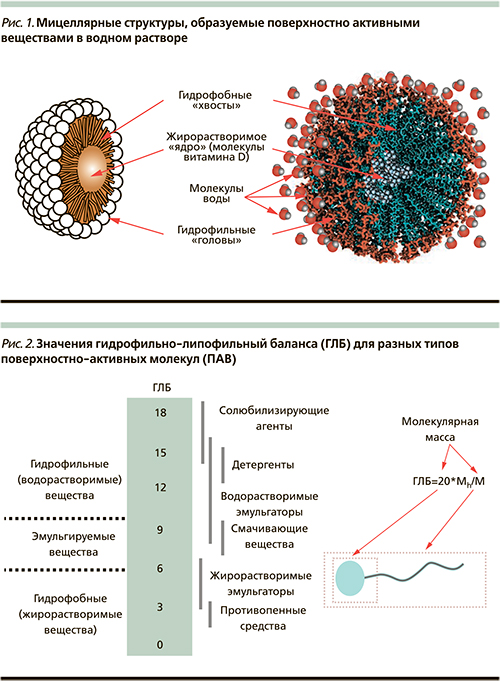
Мицеллы – наночастицы (10… 1000 нм в диаметре) с «жировой начинкой» (содержащей витамин D) и гидрофильной оболочкой, которая позволяет наночастицам равномерно распределяться по всему объему водного раствора. Именно за счет образования мицелл и происходит «солюбилизация» витамина D (т.е. переход в водорастворимую форму) [6]. В настоящей работе рассмотрены результаты фармакологических исследований витамина D, указавшие на принципиальное значение мицеллообразования для полноценного всасывания витамина D.
Фундаментальные физико-химические принципы образования мицелл в водных растворах
В водной среде мицеллы образуются особыми амфифильными молекулами (поверхностно активными веществами – ПАВ, или эмульгаторами), т.е. молекулами, имеющими гидрофобный «хвост» (выталкиваемый из водного раствора вследствие сил поверхностного натяжения) и гидрофильную «голову» (наоборот, обладающую повышенным сродством к водному раствору). Такими молекулами являются, например, липиды. Поскольку гидрофобные хвосты амфифильных молекул выталкиваются из водного раствора, энергетически выгодной является такая конфигурация, в которой гидрофобные концы «скрыты» от растворителя, а гидрофильные концы молекул, наоборот, максимально взаимодействуют с молекулами воды.
Мицеллообразование имеет большое значение для усвоения организмом жирорастворимых витаминов и сложных липидов. Соли желчных кислот, образуемые в печени и поступающие из желчного пузыря, стимулируют мицеллообразование жирных кислот (ЖК). Именно за счет этих мицелл и осуществляется всасывание сложных липидов (например, лецитина) и жирорастворимых витаминов (А, D, Е и К) в тонком кишечнике.

Мицелла является энергетически выгодной конфигурацией амфифильных молекул (рис. 1). При образовании мицеллы несколько десятков или сотен амфифильных молекул объединяются так, что гидрофобные концы образуют ядро (внутреннюю область), а гидрофильные группы – поверхностный слой мицеллы, окруженный стабилизирующей оболочкой молекул растворителя и адсорбированных из водного раствора ионов.
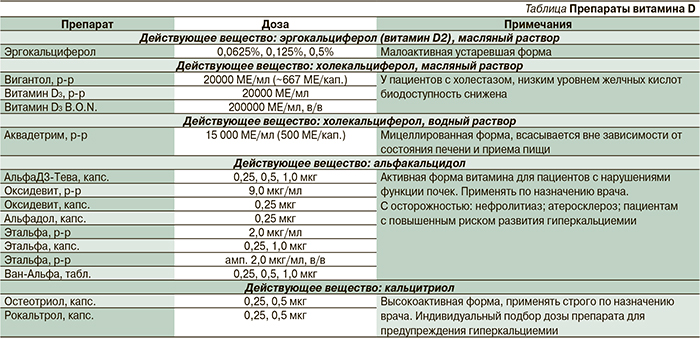
Мицеллы, как правило, имеют сферическую форму, хотя возможно образование эллипсоидов или цилиндров. Форма и размер мицеллы зависят от молекулярной структуры амфифильных молекул ПАВ (в частности, их гидрофильно-липофильного баланса, см. ниже) и таких условий образования раствора, как концентрация ПАВ, температура, рН и ионная сила («соленость»). Мицеллы образуются, только когда концентрация поверхностно-активного вещества больше, чем критическая концентрация мицеллообразования (ККМ), а температура системы превышает критическую температуру мицеллообразования (КТМ, или температура Крафта) [7, 8].
Важнейшим параметром любого ПАВ является гидрофильно-липофильный баланс (ГЛБ), который вычисляется как ГЛБ=20хMh/M, где Mh – молекулярная масса гидрофильной части («головы») молекулы, а M – молекулярная масса всей молекулы. Значение ГЛБ=0 соответствует полностью липофильной (гидрофобной) молекуле (например, бензол, бутан и др.), а значение 20 соответствует полностью гидрофильной (липофобной) молекуле (сама молекула воды, муравьиная кислота и др.) (рис. 2).
Зависимость параметров образуемых мицелл от молекулярной структуры инкапсулируемого в мицелле вещества может быть наглядно проиллюстрирована на примере включения витамина Е (токоферол), витамина D (холекальциферол) и экстракта масла лимона в мицеллы на основе одного и того же ПАВ (Tween-20, 1%-ный раствор) с относительно коротким гидрофобным хвостом (цепь из 11 атомов углерода, около 1,1… 1,3 нм) и очень большой гидрофильной головкой (включает 25 атомов кислорода). Вследствие короткого хвоста даже такие сравнительно небольшие молекулы, как витамины E и D, будут оказывать существенное воздействие на мицеллобразование в данной системе (рис. 3) [9].

Так, молекулы токоферола характеризуются вытянутой формой (гидрофобный «хвост» из 13 атомов, гидрофобная головка бензодигидропиранового ядра), поэтому токоферолы встраиваются, не нарушая структуры ядра.
В результате мицеллы получаются «одна к одной», т.е. имеют небольшой разброс в размерах.
Более «массивная» молекула витамина D (стероидное ядро с разветвленной цепью) вносит дополнительные искажения в процесс мицеллообразования, так что получающиеся мицеллы характеризуются гораздо большей неоднородностью размеров – пик уширяется.
В случае лимонного масла, которое является смесью различных молекул (средняя молекулярная масса порядка 1000 Да), эти компоненты смеси, очевидно, группируются по размерам и образуются мицеллы двух существенно различных размеров (два сравнительно больших пика на рис. 3).
Желчные кислоты, мицеллообразование и биоусвояемость витамина D
Оценка эффективности всасывания различных форм витамина D в эксперименте (моделирование фистул желудочно-кишечного тракта у крыс) указала на различные пути всасывания витамина D3 (1,25-дигидроксивитамина D3, 25-гидроксивитамина D3, холекальциферола) из мицеллярных растворов. При помещении мицеллярных растворов (содержащих 50 нмоль витамина D3 с радиоактивной меткой) в сегменты тощей кишки гидроксилированные формы витамина поступали в первую очередь в венозный кровоток. Средняя скорость венозного транспорта 1,25-(OH)2-D3 составила 1830 нмоль/мин/г, а 25-(OH)-D3 – ниже 900 нмоль/мин/г, а холекальциферола – всего 13 нмоль/мин/г. 25-гидроксилирование холекальциферола и 1-гидроксилирование всосавшегося 25-(OH)-D3 стимулировало транспорт через воротную вену. Без использования мицеллярной формы всасывание витамина D резко снижалось [10].
В норме мицеллы, содержащие витамин D, образуются в кишечном транзите под действием природных эмульгаторов – желчных кислот.

В эксперименте дефицит желчных кислот существенно снижал всасывание витамина D в кишечнике. При лигировании брыжеечных желчных протоков всасывание трех основных метаболитов витамина (витамин D3, 25-гидроксивитамин D3 и 1,25-дигидроксивитамина D3) в лимфу заметно снизилось [11]. Добавление таурохолата достоверно повышало всасывание витамина (рис. 4).
Смешанные мицеллы витамина D, образованные с использованием липидов, характеризуются улучшенным всасыванием витамина D в лимфу. Мицеллы для транспорта витамина D изготавливались с использованием ЖК, моноглицеридов и желчных кислот. Количество витамина D, появляющегося в лимфе экспериментальных животных, было значительно выше при интрадуоденальном введении именно смешанных мицелл на основе линолевой или пальмитиновой кислот по сравнению с мицеллами только на основе желчных кислот (таурохолат). Липиды в составе мицелл для переноса витамина D ускоряли процесс транспорта из слизистой оболочки внутрь эпителиоцитов кишечника [12].
Молекулярная структура ЖК и их концентрация модулируют мицеллообразование и всасывание витамина D. Исследование свойств мицелл, образованных различными ЖК, показало, что длинноцепочечные ЖК в концентрациях порядка 500 мкмоль/л снижают всасывание холекальциферола, а омега(Ω)-9 олеиновая кислота и Ω-3 эйкозапентаеновая кислота (ЭПК) значительно повышают всасывание холекальциферола (рис. 5.) [13]. Продуктами-концентраторами олеиновой кислоты являются орехи (фундук, кешью), папайя, треска, оливковое масло; продукты концентраторы ЭПК – сардины, скумбрия, сельдь.
Помимо мицеллообразования важно отметить и то, что влияние ЖК на всасывание витамина D зависит от воздействия кислот на белки липидного транспорта. Иначе говоря, витамин D (в форме провитамина, холекальциферола) всасывается не просто за счет пассивной диффузии, но и посредством таких белков – транспортеров холестерина, как NPC1 (Niemann-Pick type C proteins, осуществляет внутриклеточный транспорт липидов, предотвращает накопление липидов продуктов в эндосомах и лизосомах), SR-BI рецептор (scavenger receptor class B type I, облегчает всасывание сложных эфиров холестерина в печени из липопротеидов высокой плотности), MTTP (microsomal triglyceride transfer protein, микросомальный транспортный белок триглицеридов, играет центральную роль в сборке частиц липопротеидов), ABCA1 (АТФ-связывающий транспортер, регуляторный белок потока холестерина). Действительно, разные ЖК по-разному воздействуют на экспрессию этих белков (рис. 6) и, соответственно, на усвоение витамина D (рис. 5) [13].
С практической точки зрения результаты этого эксперимента позволяют сделать несколько важных выводов. Во-первых, пища с высоким содержанием олеиновой кислоты будет наиболее эффективно повышать всасывание витамина D из мицелл. В то же время высокое содержание пальмитиновой кислоты в пище (маргарин, твердые растительные жиры, свиной и говяжий жиры) будет затруднять усвоение витамина D (в частности, за счет достоверного снижения экспрессии белков – транспортеров холестерина).
Результаты клинических исследований подтвердили важность солюбилизации и мицеллообразования для усвоения витамина D. Всасывание витамина D3 в тощей кишке оценивалось у здоровых добровольцев после стандартизированного для всех участников завтрака (каша, йогурт, напиток). Изучение кривых концентраций витамина D3 в водной фазе в течение 30 минут после приема пищи показало, что более высокое всасывание коррелировало с более высокими уровнями желчных кислот и свободных ЖК (рис. 7). Существование таких корреляций соответствует образованию смешанных мицелл (витамин D3, липиды, желчные кислоты) в водной фазе [14].
В клиническом исследовании было показано, что эмульгатор d-α-токоферол полиэтиленгликоль-1000 сукцинат (ТПГС) усиливает всасывание витамина D при хроническом холестазе у детей. Сравнение эффектов приема 1000 МЕ/кг витамина D и той же дозы витамина D в смеси с ТПГС (25 МЕ/кг) показало, что у пациентов с холестазом прием только витамина D не приводил к достоверному повышению уровней 25-гидроксивитамина в крови (вследствие существенного снижения секреции желчных кислот). В то же время прием витамина D в смеси с ТПГС показал площадь под кривой на +156±33 нг/мл бóльшую по сравнению с витамином D (р<0,001), что соответствовало подъему уровней витамина в среднем на 5,2±1 нг/мл (рис. 8). Наблюдение за пациентами в течение 3 месяцев показало, что у пациентов с изначально низкими уровнями витамина (менее 15 нг/мл) происходила нормализация (до достижения диапазона уровней 16–52 нг/мл), в то время как у пациентов с изначально нормальным уровнем концентрация удерживалась в диапазоне нормы [15].
Эксперименты показывают возможность использования «нестандартных» эмульгаторов для приготовления водорастворимых форм витамина D. Например, мицеллы на основе хитозаноидов позволяют осуществлять пролонгированное высвобождение витамина D3 [16]. Стабильность и биодоступность витамина D, инкапсулированного в казеиновых мицеллах, несколько повышается по сравнению с обычными эмульгаторами [17]. Перспективным эмульгатором для создания мицелл для переноса жирорастворимого витамина D также является стандартизированный изолят соевого белка [18, 19].
Некоторые вещества могут, наоборот, затруднять всасывание витамина D. В эксперименте фитостеролы (например, из рапсового масла, облепихи, кукурузы) ухудшают всасывание витамина D в кишечнике: биодоступность холекальциферола была в 15 раз ниже в присутствии β-ситостерола (р<0,05). Отчасти это можно объяснить именно воздействием на мицеллообразование: фитостеролы могут вытеснять схожий по структуре холекальциферол в смешанных мицеллах [20]. Холестирамин связывает желчные кислоты и нейтрализует их способность к мицеллообразованию. В эксперименте было показано, что всасывание 10 мкг витамина D достоверно снижалось при добавлении холестирамина к диете, что приводит к нарушению мицеллообразования [21].
О мицеллообразовании в водорастворимом препарате витамина D (Аквадетрим)
Препарат Аквадетрим является водорастворимой фармацевтической формой холекальциферола (витамин D3). В состав 1 мл раствора (30 капель) входит 15 000 ME активного вещества (т.е. в 1 капле – 500 МЕ). В составе Аквадетрима витамин D3 переводится в водную фазу именно за счет мицеллообразования с использованием полиэтиленгликолевого эмульгатора глицерилрицинолеат макрогола (субстанция Cremophor®EL, далее просто Кремофор).
Кремофор – полиэтоксилированная форма касторового масла, которую получают из смеси касторового масла с окисью этилена в молярном соотношении 1:35. В водных растворах данный эмульгатор солюбилизирует (т.е. переводит в мицеллообразную форму) жирорастворимые витамины A, D, E и K. Основными компонентами данного эмульгатора являются полиэтиленгликоль глицерилрицинолеатные эфиры (рис. 9).

Вместе с эфирами ЖК и полиэтиленгликоля (ПЭГ) полиэтиленгликоль глицерин рицинолеат образует гидрофобный «хвост» эмульгатора, а гораздо меньшая гидрофильная «головка» состоит из свободных ПЭГ и этоксилированного глицерина. Критическая концентрация мицеллообразования (ККМ) Кремофора составляет 0,02%, т.е. мицеллы могут образовываться уже при достаточно малых количествах данного эмульгатора (0,02% от массы раствора). Гидрофильно-липофильный баланс (ГЛБ) лежит между 12 и 14, что указывает на высокую способность к эмульгированию липофильных веществ, в т.ч. витамина D.
Кремофор смешивается с олеиновой и стеариновой кислотами, додецил- и октадециловыми «жирными» спиртами, касторовым маслом и многими жирорастворимыми веществами в любых соотношениях. Когда доля эмульгатора снижается до 5–10% от нерастворимого в воде вещества, создаются условия для мицеллообразования, что и используется для создания фармацевтических препаратов на основе жирорастворимых витаминов (в т.ч. витамина D) в водных растворах для перорального и местного применения [22].
В эксперименте основной компонент Кремофора, эмульгатор глицерин полиэтиленгликоля рицинолеат, оказывал положительное воздействие на метаболизм и липидный профиль сыворотки у цыплят-бройлеров. Эмульгатор добавляли в рацион в количествах от 1 до 2% от массы добавленного жира (насыщенное пальмовое масло). Добавление эмульгатора приводило к повышению усвояемости жиров. Прирост массы тела за 39 дней был выше при добавлении эмульгатора. При этом происходила нормализация распределения жиров: содержание жира увеличивалось равномерно в мышечной ткани тела, а содержание жира в печени уменьшалось (p<0,05) по сравнению с контролем [23].
Кремофор повышает биодоступность сеокальцитола (22-24-диен-1альфа, 25-дигидроксивитамин D3): биодоступность этой формы витамина D составила 15, 21 и 28% для ПЭГ, триглицеридов со средней длиной цепи и эмульгирующей смеси с 50% Кремофора соответственно. На биодоступность витамина D из раствора ПЭГ влияет совместный прием препарата с пищей (+14%), в то время как биодоступность из составов на основе липидов и Кремофора значительно меньше зависит от приема пищи (+5%). Данная зависимость, очевидно, связана с наличием липидов в пище и с эмульгирующими свойствами Кремофора [24, 25].
В России зарегистрированы различные формы витамина D (см. таблицу). Среди этих препаратов эргокальциферол (витамин D2), форма витамина D растительного происхождения, проявляет крайне малую витаминную активность, в связи с чем практически не применяется.
В педиатрии и в терапии гораздо более востребованы препараты витамина D3 (холекальциферол), который, являясь провитамином (про-лекарством), конвертируется в активную форму гормона (кальцитриол) в необходимых организму количествах. Препараты на основе холекальциферола делятся на две группы: витамин D3 в масляном растворе и водный раствор мицеллированного витамина D3.
Мицеллированная форма витамина D3 важна потому, что физиологическое усвоение витамина D3 в кишечнике происходит только при участии желчных кислот (что подразумевает образование мицелл). У пожилых, пациентов с муковисцидозом, с холестазом и с другими нарушениями печени (стеатогепатитом и др.) или при соблюдении определенных диет секреция желчных кислот снижается. Это затрудняет мицеллообразование и, следовательно, резко снижает усвоение витамина D (в т.ч. из масляных растворов) и других жирорастворимых витаминов.
Заметим, что использование препаратов на основе активных форм витамина D (на основе альфакальцидола и кальцитриола) должно происходить только по рекомендации врача, т.к. фактически содержат активную форму гормона и в полном смысле слова являются гормональными препаратами. К ограничениям применения препаратов на основе активных форм витамина относятся возраст (менее 3 лет), нефролитиаз, атеросклероз.
В случае применения кальцитриола необходимо контролировать уровень кальция в сыворотке по крайней мере 2 раза в неделю; при превышении уровня кальция на 1 мг/100 мл (250 мкмоль/л) по сравнению с нормой – 9–11 мг/100 мл (2250–2750 мкмоль/л), либо при увеличении уровня креатинина в сыворотке до 120 мкмоль/л и более прием препарата немедленно прекращают. Возобновление лечения допускается только после нормализации уровня кальция в сыворотке с использованием дозы, уменьшенной на 0,25 мкг.
Заключение
Комплексы витаминов чаще всего рекомендуется принимать во время еды. Отчасти это связано с тем, что жирорастворимые витамины усваиваются лучше в присутствии определенных разновидностей ЖК (олеиновая кислота, полиненасыщенная эйкозапентаеновая кислота) и стимулируемых приемом пищи желчных кислот. В норме всасывание витамина D обязательно происходит при участии и желчных кислот, и ЖК за счет мицеллообразования (эмульгации). Однако далеко не все пищевые жиры способствуют усвоению витамина D (пальмитаты в составе маргарина и свиного жира могут тормозить всасывание витамина). Многие пациенты плохо переносят жирную пищу или страдают от той или иной патологии печени, приводящей к снижению синтеза желчных кислот. Синтез ЖК снижается в пожилом возрасте при использовании т.н. диет для похудания, включении в рацион блокаторов мицеллирования и усвоении витамина D (пальмитиновой кислоты, сатурированных жиров, маргарина). Поэтому мицеллированные («водорастворимые») растворы витамина D (Аквадетрим) обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот (рис. 10).



