Рак предстательной железы (РПЖ) является одной из ключевых проблем современной онкологии. По заболеваемости и смертности он уверенно держит второе место в США и странах Западной Европы, обгоняя рак легкого и рак желудка. В 2008 г. в Европе заболеваемость РПЖ составляла 65 на 100 тыс. человек [1]. В России, по данным 2012 г., он также стоит на втором месте среди онкологических заболеваний мужского населения (12,1%), а в общей заболеваемости находится на 6-м месте (5,5%). Смертность от РПЖ занимает 4-е место (7,1%). В 2012 г. по сравнению с 2002-м у мужчин на фоне значительного снижения стандартизованного показателя смертности (-10,5%) от всех злокачественных новообразований отмечено нарастание показателя смертности от злокачественных опухолей ПЖ (35,2%). С 2002 по 2012 г. прирост составил 157,78% (среднегодовой прирост – 8,45%). Абсолютное число впервые в жизни установленных диагнозов РПЖ увеличилось за тот период с 13 245 до 29 082, а смертность – с 7556 до 10 861 случая. Средний возраст больных составляет 70,1 года [2].
К основным факторам риска развития РПЖ относятся:
- Возраст (в 15–30% случаев различные формы РПЖ выявляются среди мужчин старше 50 лет, в 70% – среди мужчин старше 80 лет).
- Расовая принадлежность (наибольший показатель заболеваемости у афроамериканцев, наиболее низкий – у жителей стран Азии).
- Питание (повышенное потребление жирной и белковой пищи).
- Генетическая предрасположенность: вероятность развития заболевания у мужчин, один из ближайших родственников (отец или брат) которых болел РПЖ, вдвое выше, чем в популяции; если болели ≥2 родственников, риск возрастает в 5–11 раз.
Методы диагностики
Диагностика РПЖ включает три основных компонента: пальцевое ректальное исследование простаты, определение уровня сывороточного простат-специфического антигена (ПСА) и трансректальное ультразвуковое исследование (ТРУЗИ) с биоп-сией ПЖ.
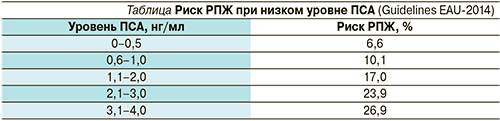
Пальцевое ректальное исследование было описано еще в XVII в. И служит самым простым и безопасным методом исследования ПЖ, но и точность его составляет от 30 до 50%, т.к. при ранних формах заболевания опухоль очень часто не пальпируется. При РПЖ могут определяться асимметрия ПЖ, участки плотной консистенции в виде узлов или инфильтратов, неподвижность ПЖ, пальпируемые семенные пузырьки. Однако данные признаки могут присутствовать и при доброкачественных изменениях, таких как гиперплазия ПЖ, камни ПЖ, простатит, флеболиты стенки прямой кишки, полипы прямой кишки, аномалии семенных пузырьков. Кроме того, этот метод исследования субъективен и очень часто зависит от опыта специалиста. Поэтому он должен сопоставляться с определением ПСА. Это гликопротеин, выделенный в 1979 г. Wang и соавт. из ткани ПЖ, для определения сывороточного уровня которого Papsidero и соавт. создали в 1980 г. серологический тест. Исследование ПСА имеет большое значение не только для диагностики, но и для лечения и прогноза РПЖ. Следует, однако, учитывать, что ПСА все же не может считаться специфическим в отношении РПЖ. Его уровень может быть повышенным и при доброкачественных изменениях ПЖ. Согласно Guidelines EAU-2014, уровень ПСА относят к «непрерывным» параметрам – чем выше его значение, тем больше вероятность наличия РПЖ. И это означает, что нет общепринятого порогового или пограничного значения этого показателя. В США было проведено исследование, согласно результатам которого у многих мужчин РПЖ может присутствовать, несмотря на низкий уровень сывороточного ПСА (см. таблицу) [3].
Уровень ПСА может также использоваться для оценки степени распространенности РПЖ. Различные исследования показали, что при ПСА >10 нг/мл пенетрация капсулы отмечается у 46%, инвазия в семенные пузырьки – у 13% и метастазы в тазовые лимфоузлы – у 11% больных. Уровень ПСA более 50 нг/мл указывает на экстракапсулярную инвазию в 80% случаев, на поражение регионарных лимфатических узлов – в 66% (Stanley и соавт., 1990). Концентрация ПСA более 100 нг/мл ассоциируется с наличием регионарных или отдаленных метастазов в 100% наблюдений (Rana и соавт., 1992). Хотя как самостоятельный фактор прогноза стадии опухолевого процесса уровень ПСА имеет ограниченное значение, его следует применять в качестве одного из параметров моделей прогноза патоморфологической стадии и безрецидивной выживаемости.
Регулярный скрининг на ПСА мужчин в возрасте старше 50 лет остается спорным, т.к. очень часто тесты на него ложноположительные, что приводит к безосновательной биопсии простаты – достаточно болезненному методу исследования. В связи с этим в США (согласно тезисам ASCO-2012–2013) отказались от использования ПСА для скрининга у мужчин с отсутствием симптомов опухоли простаты в связи с дороговизной данного исследования, а также убедительных доказательств способности этого маркера снижать смертность и увеличивать выживаемость при РПЖ.
ТРУЗИ также не является достаточно достоверным методом диагностики – при его применении присутствует субъективная оценка данных, и качество исследования зависит от опыта специалиста. Чувствительность его составляет 66%, а специфичность – 43%. Кроме того, до 60% опухолей рТ3 при ТРУЗИ не выявляются. В связи с этим при подозрении на РПЖ необходимо выполнение биопсии простаты.
К методам диагностики отдаленных метастазов РПЖ относятся сцинтиграфия скелета, компьютерная или магнитно-резонансная томография таза, рентгенография органов грудной клетки. К косвенным признакам метастатического поражения скелета относится повышение активности щелочной фосфатазы в сыворотке крови, которое выявляют у 70% больных с генерализацией процесса. Сцинтиграфию костей можно не выполнять больным с суммой Глисона <10 баллов, отсутствием клинической симптоматики поражения скелета и высоко или умеренно дифференцированными опухолями.
Лечение
Лечение РПЖ зависит в первую очередь от стадии заболевания. При локализованных формах (Т1-2N0M0) могут использоваться активное наблюдение (выжидательная тактика), лучевая терапия и хирургическое лечение.
При лечении местнораспространенного РПЖ (опухоли, выходящие за пределы простаты: Т3–4N0М0 или Т1–4N1М0) или метастатического РПЖ необходима гормонотерапия, которая включает два подхода: монотерапию (кастрация, эстрогенотерапия, антиандрогены) или комбинированное лечение, предполагающее сочетание кастрации (хирургической или медикаментозной) с антиандрогенами. Целью данного лечения стало создание максимальной андрогенной блокады (МАБ).
В 1941 г. Huggins (получил Нобелевскую премию в 1961 г.) и Hodges описали эффект от кастрации и применения эстрогенов при распространенном РПЖ. Была обнаружена чувствительность РПЖ к андрогенной депривации [4, 5].
Клеткам ПЖ андрогены необходимы для роста, функционирования и пролиферации. Для роста и развития опухолевых клеток необходим тестостерон, хотя сам по себе этот гормон и не канцерогенен [6].
Наибольшее количество андрогенов вырабатывается в яичках и только 5–10% – в надпочечниках. Контроль за секрецией тестостерона происходит в гипоталамо-гипофизарной системе. Выработка рилизинг-гормона лютеинизирующего гормона (ЛГРГ), который стимулирует секрецию лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов передней долей гипофиза, происходит в гипоталамусе. ЛГ стимулирует продукцию тестостерона в клетках Лейдига, расположенных в яичках. Поступая внутрь клеток ПЖ, тестостерон превращается в 5α-дигидротестостерон, обладающий в 10 раз большей активностью. Тестостерон, продолжающий вместе с другими андрогенами циркулировать в крови, ароматизируется и превращается в эстроген, который по механизму отрицательной обратной связи тормозит секрецию ЛГРГ в гипоталамусе. Клетки ПЖ лишаются андрогенной стимуляции, и происходит апоптоз (запрограммированная смерть клеток).
Любой вид лечения, в результате которого происходит подавление активности андрогенов, называется андроген-депривационной терапией. К возможным вариантам андрогенной блокады относятся хирургическая (двусторонняя орхидэктомия) и медикаментозная кастрация.
В 1971 г. Shelly выделил нативный ЛГРГ, а в 1977-м получил Нобелевскую премию за работы по исследованию пептидных гормонов головного мозга. Это повлекло за собой разработку терапии агонистами ЛГРГ в качестве способа медикаментозной кастрации.
Агонисты (аналоги) ЛГРГ используются уже около 30 лет, они были предложены в качестве клинического применения в 1980-е гг. Это самый распространенный вид гормонотерапии, способствующий регрессу опухоли. Агонисты ЛГРГ оказывают двухфазное действие на гипофиз: взаимодействуя со специфическими рецепторами клеток передней доли гипофиза, они вызывают кратковременную стимуляцию с последующей длительной десенситизацией, т.е. снижением чувствительности рецепторов аденогипофиза к ЛГРГ. У мужчин выделение ЛГРГ из гипоталамуса происходит эпизодически, при этом интервалы между импульсами составляют приблизительно 90 минут. ЛГРГ связывается с рецепторами, расположенными на мембране клеток гипофиза, что приводит к высвобождению ЛГ и, следовательно, тестостерона в яичках. Препараты – аналоги ЛГРГ имитируют действие нативного гормона. После однократной инъекции аналога ЛГРГ в результате стимулирующего эффекта усиливается секреция ЛГ и ФСГ из передней доли гипофиза (проявляется повышением содержания тестостерона в крови мужчин), обычно этот эффект наблюдается в первые 7–10 дней. При постоянном длительном применении эти препараты подавляют высвобождение ЛГ и ФСГ, снижают функцию яичек и, соответственно, содержание половых гормонов в крови. Эффект проявляется примерно через 21–28 дней, при этом концентрация тестостерона в крови снижается у мужчин до уровня, наблюдаемого после хирургической кастрации (т.н. лекарственная кастрация). Агонисты ЛГРГ – это сильнодействующие аналоги естественного ЛГРГ человека, с помощью которых достигается обратимая медикаментозная кастрация, т.е. после окончания применения этих препаратов физиологическая секреция гормонов восстанавливается. Побочные эффекты медикаментозной и хирургической кастрации в основном одинаковы (связаны со снижением уровня андрогенов), выражаются в импотенции и приливах. Специфический побочный эффект лечения аналогами ЛГРГ, наблюдаемый довольно редко, – это преходящее усугубление симптоматики, т.н. феномен вспышки, в первые недели после начала лечения. Он связан с первоначальным повышением уровня тестостерона и купируется к концу первого месяца лечения.
Агонисты ЛГРГ могут назначаться как для монотерапии локального, местнораспространенного и метастатического РПЖ, так и в качестве компонента МАБ совместно с антиандрогенами, а также для комбинированной терапии совместно с другими препаратами, применяемыми в качестве лечения РПЖ (химиопрепараты, стероиды, эстрогены, антиэстрогены, ингибиторы факторов роста, ингибиторы ароматазы, нестероидные противовоспалительные средства и др.). Аналоги ЛГРГ выгодно отличаются от других групп лекарственных препаратов, используемых по сходным показаниям, хорошей эффективностью, сочетающейся с существенно более высокой безопасностью. Побочные эффекты, наблюдаемые при применении аналогов ЛГРГ, точно такие же, как и при кастрации, однако они полностью обратимы после отмены препаратов и легко корригируются в процессе терапии. В ряде исследований было показано, что по клинической эффективности назначение агонистов ЛГРГ аналогично двусторонней орхиэктомии, но качество жизни больных при этом гораздо выше. Агонисты ЛГРГ не влияют на образование андрогенов надпочечниками, поэтому у пациентов, получающих эти препараты, может регистрироваться минимальный уровень тестостерона в сыворотке крови [7–9]. Недавно опубликованный мета-анализ показал, что аналоги ЛГРГ имеют сравнимую эффективность с орхидэктомией и терапией диэтилстильбэстролом [10].
В РОНЦ им. Н.Н. Блохина РАМН также проведено изучение аналогов ЛГРГ при диссеминированном РПЖ [11]. Анализ полученных данных показал, что в подавляющем большинстве случаев через 3–4 недели после начала их применения концентрация тестостерона в сыворотке крови снижается на 80–100% по сравнению с исходной и достигает посткастрационных значений. Пониженная концентрация тестостерона сохраняется на протяжении всего времени лечения. Частота частичных регрессов составляла от 19,0 до 33,3% к 3-му месяцу, от 24 до 50,0% к 6-му и от 9,5 до 16,7% к 12-му месяцу лечения. Частота стабилизации процесса составила от 45 до 66,7% к 3-му месяцу, от 23,3 до 42,7% к 6-му и от 47,6 до 53,3% к 12-му месяцу лечения. Таким образом, с помощью аналогов ЛГРГ удается контролировать опухолевый процесс в течение года практически у каждого второго больного диссеминированным РПЖ. Анализ прогрессирования заболевания на фоне лечения аналогами ЛГРГ принес следующие результаты. Частота прогрессирования составила от 0 до 27,5% к 3-му месяцу, от 26,7 до 36,2% к 6-му и от 30,0 до 42,9% к 12-му месяцу лечения. Это свидетельствует о том, что около 25–30% больных диссеминированным РПЖ изначально не чувствительны к медикаментозной кастрации. Из этого следует, что рекомендуемая обычно при диссеминированном РПЖ хирургическая кастрация никоим образом не помогла бы этой группе больных. Это говорит о том, что лечение аналогами ЛГРГ может являться «пробным» методом перед хирургическим вмешательством.
Таким образом, с учетом всего вышеизложенного можно сделать следующий вывод: наиболее оптимальным методом медикаментозной кастрации является применение аналогов ЛГРГ, причем терапия этими препаратами может проводиться в амбулаторных условиях [12], являясь удобной и простой формой лечения как для пациента, так и для врача.



