Приверженность к терапии (комплаентность) – это соответствие поведения пациента рекомендациям врача, включая прием препаратов, диету и/или изменение образа жизни. Приверженность к терапии считается неудовлетворительной, если пациент принимает менее 80 % или более 120 % доз, назначенных на длительный период медикаментов [1].
Нарушение приверженности проявляется приемом неадекватной дозы препаратов, приемом их в некорректное время, пропусками в приеме, отменой препаратов и приемом пациентом большего, чем рекомендовано, количества препарата. Часто показателями низкой приверженности становятся пропуски визитов к врачу. Некоторые пациенты с хроническими заболеваниями, требующими постоянной терапии, 3–4 раза в год устраивают себе «лекарственные каникулы» по разным причинам (устали принимать препарат, уехали в отпуск, не обновили рецепт, забыли купить лекарство и др.).
А.О. Конради [2] классифицировала причины, вызывающие низкую приверженность больного:
- причины, связанные с пациентом;
- причины, связанные с врачом;
- социально-экономические причины;
- причины, связанные с самой терапией.
Отмена лекарственной терапии и последующее возобновление лечения увеличивают вероятность осложнений, связанных с эффектом первой дозы или синдромом отмены. Низкая приверженность к терапии при хронических заболеваниях снижает эффективность лечения, увеличивает количество госпитализаций в стационар, увеличивает социальные проблемы по уходу за больными и экономические затраты на лечение. С другой стороны, высокая приверженность больных увеличивает их выживаемость при хронических заболеваниях [3].
Существуют общие предикторы низкой приверженности к терапии при различных заболеваниях:
- наличие психологических проблем, особенно депрессии, когнитивных нарушений;
- бессимптомность заболевания (пациент не понимает, почему он должен принимать препарат);
- неадекватное наблюдение и/или рекомендации при выписке;
- побочные эффекты терапии;
- недостаточная вера больного в эффективность лечения;
- недостаточная информированность пациента о его заболевании;
- плохие отношения между медицинским персоналом и больным;
- наличие препятствий к предоставлению медицинской помощи;
- сложность терапии;
- высокая стоимость лечения [4].
При этом низкая приверженность к терапии может быть непреднамеренной, когда пациент не понимает, чего от него ожидают в результате неэффективного взаимодействия с врачом, и не следует рекомендациям; и преднамеренной, когда больной знает, чего от него ждет врач, но не выполняет рекомендаций. Ряд факторов может снижать приверженность пациентов пожилого возраста к лечению (табл. 1) [5].
При хронических заболеваниях примерно треть медикаментов, прописанных врачом, не принимается больными [6].
При болезни Паркинсона (БП) медикаментозная терапия считается основной. Необходимость постоянной фармакотерапии, неизбежность периодов титрации доз медикаментов, сложные схемы приема одновременно нескольких противопаркинсонических препаратов, сопутствующие заболевания у лиц пожилого возраста, наличие когнитивных и аффективных расстройств, а иногда и расстройства глотания значительно снижают приверженность к лечению больных БП. Данные о приверженности пациентов БП к лечению достаточно противоречивы, что связано с использованием различных методов исследования приверженности [7–11].
Следует отметить, что последствия низкой приверженности к лечению могут быть более значимыми на более поздних стадиях БП. Прием как низких, так и высоких доз дофаминергических препаратов может вызывать моторные флуктуации, лекарственные дистонии и дискинезии, прием неадекватной терапии может увеличивать риск падений, застываний, необходимость госпитализаций пациентов в стационар. В некоторых случаях самостоятельная отмена больным БП лекарственных препаратов может приводить к тяжелому осложнению с высокой смертностью – акинетическому кризу. Прием избыточных доз препаратов может приводить к поведенческим и психиатрическим проблемам. Многие пациенты с БП, у которых развивается снижение эффективности контроля двигательных симптомов, по мере прогрессирования заболевания начинают принимать значительно бóльшие дозы леводопы, чем это необходимо для контроля двигательных нарушений. Дофаминовый дизрегуляционный синдром (ДДС) достаточно часто описывают как нарушение приверженности при БП, он выявляется примерно в 3–4 % случаев [12]. Этим пациентам требуются все бóльшие дозы дофаминергических средств, несмотря на рекомендации врача. Подобный прием медикаментов приводит к появлению леводопа-зависимости и развитию деструктивных поведенческих проблем. Известно, что компульсивный (навязчивый) прием дофаминергических препаратов наиболее часто встречается у мужчин с ранним дебютом БП. Алкоголизм, употребление наркотиков, наличие аффективных расстройств в анамнезе служат факторами риска развития ДДС [13, 14]. На фоне приема высоких доз дофаминергических препаратов появляется эйфория в период «включения» и дисфория периода «выключения». Больные с нетерпением ожидают приема следующей дозы и обосновывают необходимость увеличения частоты приема лекарств, несмотря на хорошую двигательную активность и появление дофаминовых дискинезий в период «включения». Они многократно увеличивают число приемов препаратов по собственному желанию и занимаются самолечением. Рекомендации врача и родственников уменьшить дозы принимаемых лекарств приводят к тайному накоплению медикаментов, поиску альтернативных запасов лекарственных средств. После принудительного уменьшения дозы препаратов у больных часто возникают рецидивы с нарушением поведения. У пациентов с БП с ДДС отсутствует понимание о нанесении вреда себе и окружающим, развиваются равнодушие и толерантность к побочным эффектам препаратов. Компульсивный прием дофаминергических средств в дальнейшем нарастает, больные принимают коротко- и быстрорастворимые препараты леводопы, избавляющие пациентов от периодов «выключения». Эти больные поглощены мыслями о расписании схем приема лекарственных средств, они часто продолжают сокращать промежутки между дозами в течение ночи [15].

Высокая приверженность к терапии при БП позволяет уменьшать побочные эффекты фармакотерапии, снижать риск развития моторных флуктуаций, число декомпенсаций в течение заболевания, госпитализаций, улучшать качество жизни и повседневную активность пациентов.
Методы оценки приверженности больного к терапии могут быть субъективными и объективными. К субъективным относятся опросники, тесты, интервью с родственниками, дневники, заполняемые больным. К объективным методам оценки приверженности относят подсчет числа таблеток, принятых пациентом за определенный промежуток времени, рецептов, прописанных пациенту; измерение концентрации препаратов или их метаболитов в плазме и моче; электронный мониторинг с использованием специальных крышек для флакона с таблетками, в которые встроены электронные микросчетчики и др.
В табл. 2 представлены плюсы и минусы различных методов оценки приверженности больных к лечению.
Наиболее часто в клинической практике используется опросник Мориски–Грина [16], который состоит из четырех вопросов:
1. Забывали ли Вы когда-либо принимать препараты?
Забывал – 0, не забывал – 1.
2. Относитесь ли Вы иногда невнимательно к часам приема лекарств?
Да – 0, нет – 1.
3. Не пропускаете ли Вы прием препаратов, если чувствуете себя хорошо?
Пропускаю – 0, не пропускаю – 1.
4. Если Вы чувствуете себя плохо после приема лекарств, не пропускаете ли Вы следующий прием?
Пропускаю – 0, не пропускаю – 1.
Приверженными к лечению считаются больные, набравшие четыре балла.
При проведении клинических испытаний для оценки приверженности производится подсчет числа таблеток, принятых пациентом за определенное количество времени. На приеме у врача пациенту выдается на руки упаковка с определенным количеством препарата. По истечении определенного периода времени подсчитывается число оставшихся таблеток и высчитывается процент приверженности по следующей формуле [17]:
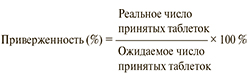
Показатель менее 80 % расценивается как низкая приверженность к терапии.
Методы повышения приверженности к лечению разнообразны [18]. Прежде всего это упрощение режима лекарственной терапии и минимизация побочных эффектов от препаратов (применение фиксированных комбинаций, применение пролонгированных однократных дозировок, использование больших упаковок, таблеток, удобных для деления; снижение стоимости лечения). Важными остаются и улучшение взаимодействия врача с пациентом, информирование больного о заболевании и лечении, акцент на необходимости постоянного приема противопаркинсонических препаратов, обсуждение сомнений, вовлечение больного в принятие решений, обсуждение возможных побочных эффектов, регулярный контроль соблюдения пациентом рекомендаций. Значительную роль играют общественные организации и школы для обучения пациентов БП и членов их семей, информационная и психологическая поддержка.
Необходимость увеличения приверженности больных является важной проблемой фармакотерапии БП.
В одном исследовании было установлено, что из 39 больных БП 50 % пропускают прием одной дозы, 20 % – прием трех и более доз противопаркинсонического препарата в течение одной недели наблюдения [19]. Проведенное исследование в Великобритании и Европе выявило, что пациенты с БП предпочитают однократный прием трехкратному приему препарата [20]. Таким образом, упрощение схемы лечения и прием однократной пролонгированной формы лекарственного препарата служат конструктивным подходом к повышению приверженности пациентов к лечению.
Новая лекарственная форма прамипексола с контролируемым высвобождением принимается один раз в сутки. Активное вещество равномерно распределено в полимерном матриксе. После приема таблетки в желудочно-кишечном тракте матрикс впитывает жидкость, затем превращается в гель, который равномерно высвобождает активное вещество в течение суток. Фармакотерапевтическая эффективность прамипексола постепенного высвобождения была изучена в многочисленных многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях с участием большого количества пациентов на ранних и поздних стадиях БП [21, 22].

Прамипексол замедленного высвобождения под названием «Мирапекс ПД» (пролонгированного действия) выпускается в таблетках с тремя дозировками: 0,375 мг, 1,5; 3,0 мг. Таблетки пролонгированного действия следует принимать один раз в сутки приблизительно в одно и то же время. Таблетки проглатывают целиком и запиваются водой; их нельзя разжевывать, разламывать или измельчать. Таблетки могут приниматься независимо от приема пищи. Пациентов, которые уже принимают таблетки Мирапекс, можно переводить на таблетки пролонгированного действия на следующий день в той же дозе. Терапию Мирапексом ПД следует начинать со стартовой дозы 0,375 мг/сут и затем постепенно повышать дозу каждые 5–7 дней до достижения максимального терапевтического эффекта (3,0–4,5 мг/сут). Постепенное высвобождение активного вещества из депо-таблетки обеспечивает более продолжительный период полужизни препарата в плазме и более стабильную концентрацию в течение суток, что обеспечивает реализацию концепции постоянной дофаминергической стимуляции постсинаптических рецепторов для профилактики возникновения и терапии уже развившихся моторных флуктуация и лекарственных дискинезий. Кроме того, пролонгированная форма препарата обеспечивает лучший контроль ночных моторных и немоторных симптомов у больных БП. Большим преимуществом прамипексола постепенного высвобождения считается однократный прием в течение суток, что значительно увеличивает приверженность больных БП к терапии.
Заключение
Таким образом, проблема низкой приверженности к терапии актуальна для больных неуклонно прогрессирующей БП. Низкая приверженность терапии пациентов с БП связана со многими факторами: сложным режимом приема препаратов; необходимостью комбинации различных лекарственных средств; периодом титрации доз при введении нового препарата; частым изменением схемы приема препаратов лечащим врачом в зависимости от клинической эффективности терапии и наличия побочных эффектов. Кроме того, аффективные расстройства и когнитивные нарушения при БП часто приводят к преждевременному отказу от приема лекарственных средств или изменению схемы терапии самим пациентом. Одним из проявлений низкой приверженности к терапии при БП является чрезмерное самостоятельное употребление больными высоких доз препаратов леводопы, что приводит к появлению ДДС, который часто сопровождается поведенческими нарушениями. Пациентам, входящим в группу риска, следует назначать минимально эффективную дозу дофаминергических средств; необходим также акцент на немедикаментозных способах лечения в периоды ухудшения состояния. Повышение эффективности терапии для коррекции моторных флуктуаций при БП может быть достигнуто с включением в схему лечения препаратов леводопы и агонистов дофаминовых рецепторов пролонгированного действия с одновременным снижением завышенных суточных доз дофаминергических препаратов. Важно объяснить больному, что необходимо соблюдать одинаковые временные интервалы между приемом препаратов. Упрощение режима приема противопаркинсонических средств, назначение пролонгированных, однократно применяемых в течение суток лекарственных препаратов служат конструктивным подходом к повышению приверженности больных БП к терапии и улучшению взаимодействия с врачом.


