Болезнь Паркинсона (БП) рассматривается как мультисистемное нейродегенеративное заболевание с широким спектром двигательных и недвигательных нарушений. К моторным симптомам относят гипокинезию, ригидность, тремор покоя и постуральную неустойчивость, на поздних стадиях присоединяются лекарственные дискинезии и моторные флуктуации. Немоторные симптомы при БП представлены вегетативными нарушениями, аффективными (тревога, депрессия) и психотическими расстройствами (ночные кошмары, галлюцинации, иллюзии и психомоторное возбуждение во сне), а также нарушениями сна [1]. Лечение БП в настоящее время требует от врача умения хорошо ориентироваться в разнообразных клинических ситуациях. Адекватная диагностика и подбор терапии в соответствии со стадией БП и индивидуальными особенностями конкретного пациента имеют принципиально важное значение; в противном случае врач вынужден будет бороться уже не только с самим заболеванием, но и с рядом побочных эффектов на фоне нерационально выстроенной тактики лечения.
Основные направления лечения БП:
- фармакотерапия (нейропротективная; заместительная – симптоматическая);
- медико-социальная реабилитация (лечебная физкультура, физио-, музыкотерапия, диета, депривация сна);
- нейрохирургическое лечение и вспомогательная терапия (коррекция побочных эффектов фармакотерапии, вегетативных, когнитивных и других расстройств).
Из клинического опыта и по сообщениям пациентов такие нефармакологические методы лечения, как физические упражнения, физиотерапия, занятия с логопедом и трудотерапия, оказывают положительный эффект на состояние больных с БП с точки зрения сохранения статуса и улучшения качества жизни. Эти методы должны использоваться в дополнение к лекарственной терапии, но не заменять ее. В частности, пациенты, страдающие от застываний при ходьбе, каптокормии, грубых нарушений ходьбы и речи, получают пользу от регулярных физических занятий и/или занятий с логопедом. Все остальные пациенты БП должны быть мотивированы на регулярные физические упражнения. Однако на сегодняшний день требуются хорошо продуманные исследования, которые позволили бы продемонстрировать не просто эффективный, а экономически эффективные нефармакологические подходы к терапии пациентов с БП.
В лечении БП можно выделить два основных направления: нейропротекцию и симптоматическую терапию. Целью нейропротекции является замедление дегенерации нейронов головного мозга. Исходя из известных в настоящее время механизмов развития БП, в качестве нейропротекторов изучаются препараты, действие которых направлено на уменьшение окислительного стресса, токсического действия глутамата и стимуляцию нейротрофических процессов. Согласно экспериментальным данным, нейропротекторными свойствами обладают ингибиторы моноаминооксидазы типа В (МАО-В), амантадины и агонисты дофаминовых рецепторов (АДР) [2, 3]. Тем не менее многочисленные клинические испытания пока не смогли предоставить однозначных доказательств протективного действия этих групп препаратов.
Наиболее разработанным направлением лечения БП является симптоматическая терапия. Поскольку основные проявления заболевания связаны со снижением содержания дофамина в базальных ганглиях, лечение должно быть нацелено на повышение активности дофаминергической системы. Существуют следующие пути восполнения дефицита дофамина: препараты леводопы (метаболический предшественник дофамина); АДР – непосредственно стимулируют рецепторы дофамина; ингибиторы МАО-В – уменьшают распад дофамина в синапсах; ингибиторы катехол-О-метилтрансферазы (КОМТ) – уменьшают периферическое разрушение леводопы, удлиняют период ее полужизни в плазме крови. Кроме дофаминергических препаратов в лечении БП используются средства, подавляющие избыточную холинергическую активность: холинолитики и снижающие активность глутаматергической системы препараты амантадина.
Выбор препарата для первоначального лечения определяется возрастом, формой заболевания и уровнем необходимой повседневной активности больного. Помимо объективной оценки выраженности двигательных симптомов необходимо учитывать и субъективные факторы, включающие личность пациента, его психологические установки, социальный статус и особенности его работы [4, 5]. Лечение предпочтительно начинать с монотерапии, постепенно увеличивая дозу препарата до оптимальной (метод титрования дозы). Если после достижения максимальной терапевтической дозы в течение месяца нет улучшения или лекарство плохо переносится, необходимо заменить препарат. Если препарат оказывает отчетливый, но недостаточный эффект либо увеличение дозы затруднено из-за плохой переносимости, следует рассмотреть возможность добавления второго противопаркинсонического средства другой фармакологической группы.
В настоящее время, несмотря на то что препараты леводопы являются «золотым» стандартом терапии БП, с открытием препаратов других групп, таких как ингибиторы МАО-В, амантадины, АДР, появилась возможность при начальных стадиях БП не назначать препараты леводопы, позволяя тем самым уменьшать выраженность двигательных расстройств, моторных и немоторных флуктуаций и улучшать качество жизни пациентов. Поэтому общим правилом терапии БП стало стремление лечить начальные стадии не леводопой, а другими препаратами, а саму леводопу по возможности резервировать до тех пор, пока без этого базового препарата уже становится невозможным удовлетворительно поддерживать функциональные способности больного. Что касается пациентов старше 60–70 лет, то решение вопроса о сроках начала лечения леводопой, стартовой дозе препарата и ее последующем наращивании решается строго индивидуально с учетом возраста больного, характера его профессиональной деятельности, отношения самого пациента к своей физической несостоятельности, его психологической реакции на заболевание и действия врача [6, 7].
Дофаминергические средства
Леводопа в сочетании с периферическим ингибитором декарбоксилазы по-прежнему остается наиболее эффективном средством [8, 9]. Имеются различные пероральные формы леводопы. Широкий спектр форм позволяет осуществлять селективный выбор того или иного леводопасодержащего препарата: нужно ли быстрое действие препарата (например, утром) или требуется длительное постоянное поступление (например, в ночное время). Кроме того, период «on» может быть продлен при использовании комбинации ингибиторов КОМТ с леводопой [10, 11]. Тем не менее у пациентов, получающих леводопу, как правило, развиваются двигательные осложнения через 4–6 лет приема [12].
Осложнения после длительного лечения леводопой включают флуктуации и/или дискинезии. Таким образом, основное назначение леводопы следует рассматривать, только когда нет эффекта от других препаратов или побочные эффекты препятствуют достаточному контролю симптомов у более молодых пациентов. В отличие от этого леводопа рекомендуется пожилым пациентам в виде монотерапии или в комбинации с другими препаратами – даже в качестве первой очереди, т.к. обладает высокой эффективностью и хорошей переносимостью [13].
Группа АДР включает фармацевтические препараты, которые активируют дофаминергические рецепторы и воспроизводят нейрохимический эффект дофамина [14]. Существует две различные группы: (1) эрголиновые и (2) неэрголиновые. Эрголиновые АДР не рекомендуются в качестве первой линии, т.к. могут вызывать серьезные побочные эффекты [6]. Неэрголиновые, напротив, считаются эффективными и безопасными и поэтому особенно рекомендуются для лечения молодых пациентов в комбинации с леводопой или в качестве монотерапии [6]. Таким образом, широкий диапазон средств и их форм позволяет индивидуализировать терапию, обеспечивая постоянный уровень лекарства и в конце концов – хорошо управлять заболеванием. Кроме того, двигательные осложнения на фоне длительного лечения возникают не чаще, чем на фоне лечения леводопой, и даже могут быть редуцированы при лечении АДР [15]. Агонистам дофаминовых (ДА) рецепторов приписывают, кроме того, антиоксидативный эффект; для них характерна меньшая способность индуцировать дискинезии; они хорошо сочетаются с такими препаратами, как мидантан и юмекс. Именно этот комплекс препаратов рекомендуется в качестве лечения начальных стадий болезни Паркинсона или пациентам моложе 60–70 лет. Достаточны минимальные дозы, способные обеспечивать адаптацию больного. Лечение начальных стадий болезни Паркинсона возможно с помощью монотерапии агонистами ДА-рецепторов. По данным рандомизированных исследований [16, 17], ряд АДР проявляют отчетливую активность в отношении паркинсонического тремора, уменьшая его тяжесть в среднем на 30 %, при этом прамипексол имеет, по-видимому, наиболее благоприятный профиль. В связи с этим большой интерес вызывает внедрение в практику в последние годы пролонгированной формы прамипексола с контролируемым высвобождением и 24-часовым действием [18]. Тем не менее следует отметить, что АДР имеют худший краткосрочный профиль рисков по сравнению с леводопой, вызывая больше психических и немоторных побочных эффектов, что требует регулярного динамического наблюдения.
К другим препаратам, оказавшимся эффективными в качестве лечения двигательных симптомов при БП [6], относятся ингибиторы МАО-В и ингибиторы КОМТ. Эти препараты имеют различные механизмы, однако каждый обладает своими преимуществами и свойствами, которые необходимо учитывать. Ингибиторы КОМТ, например, увеличивают уровни плазматической леводопы. Была доказана их эффективность для вспомогательной терапии с леводопой и для лечения двигательных флуктуаций [6]. Тем не менее есть побочные эффекты, которые следует учитывать, прежде всего гепатотоксичность у толкапона [19]. Энтакапон широко применяется – особенно в сочетании с леводопой, улучшая повседневную жизнедеятельность пациентов с БП, а также сокращает периоды «off» [11] у пациентов с флуктуациями [20]. Ингибиторы МАО-В также обеспечивают более высокий уровень допамина, блокируя фермент МАО-В, разрушающий дофамин, что ведет к увеличению концентрации дофамина в синаптической щели. Следовательно, эффективны в качестве монотерапии моторных симптомов, а также в качестве дополнения к леводопе [6]. Кроме того, оба препарата (селегилин и разагилин) рекомендуются благодаря их хорошей переносимости.
Амантадины стимулируют выделение дофамина из нейрональных депо и тормозят обратный захват дофамина, оказывая также легкий холинолитический эффект. По механизму действия они являются антагонистами глутаматных рецепторов, что предполагает наличие нейропротективного действия [21]. Их рекомендуется назначать для лечения двигательных симптомов у молодых пациентов [6], и они оказались эффективными в уменьшении леводопа-индуцированных дискинезий [22, 23].
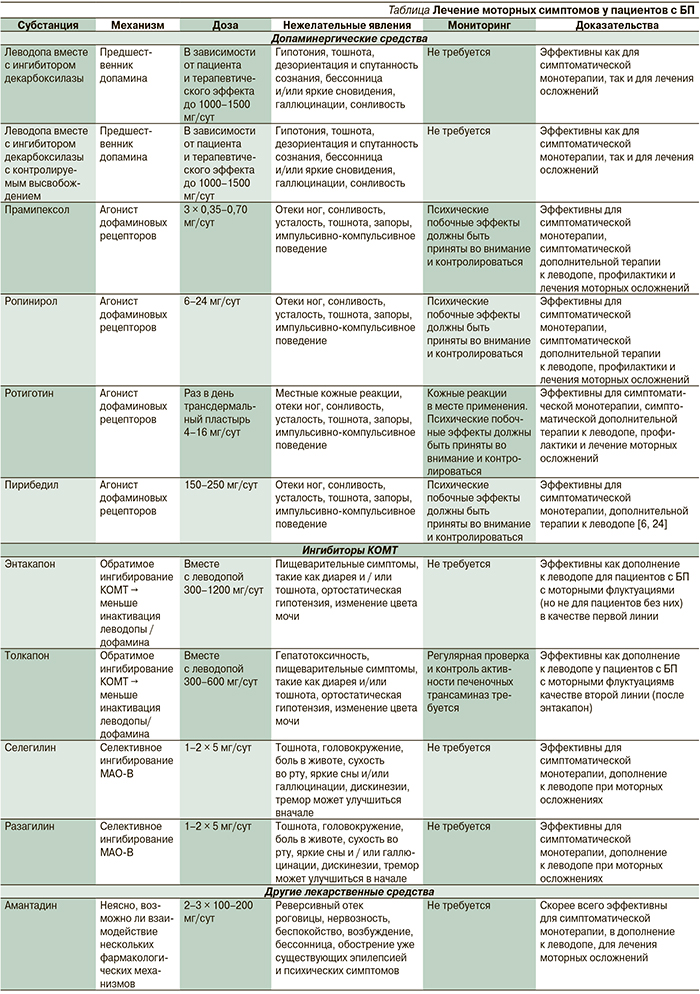
Суммарные данные по лечению моторных симптомов у пациентов с БП представлены в таблице [6, 8, 14, 24].