Основными клиническими проявлениями широкого круга воспалительных, в меньшей степени – дегенеративных, заболеваний суставов и позвоночника являются боль, ригидность и ограничение подвижности. Все эти симптомы находятся в тесной взаимосвязи и активно воздействуют друг на друга. В частности, на функциональную недостаточность опорно-двигательного аппарата (во всяком случае, в ранний период развития этих заболеваний) значительное воздействие оказывает не только выраженность боли, но и степень утренней скованности.
Боль и ригидность наиболее присущи ревматоидному артриту (РА), анкилозирующему спондилиту (АС) и другим серонегативным спондилоартритам (ССА), в частности псориатическому артриту, реактивным артритам, поражению суставов и позвоночника при воспалительных заболеваниях кишечника (язвенном колите и болезни Крона), недифференцированному спондилоартриту. Кроме того, эти явления присущи большой группе заболеваний, которые рассматриваются как дорсопатии.
У больных РА наблюдаются боли воспалительного типа, наиболее выраженные в утренние часы, и, как правило, сопровождаются утренней, ригидностью. При РА интенсивность утренней скованности и ее продолжительность адекватно отображают активность воспалительного процесса и позволяют судить не только о выраженности лабораторной активности заболевания, но и об интенсивности происходящих в тканях изменениях. Выраженная ригидность, которая держится в течение многих месяцев и не уменьшается на фоне активной противовоспалительной терапии, является неблагоприятным прогностическим фактором и нередко ассоциируется с возможным прогрессированием структурных изменений в суставах. У больных РА причинами болей в суставах, как и ригидности, являются воспалительный процесс в синовиальной оболочке (синовит) и периартикулярных мягких тканях (тендовагинит, тендосиновит, бурсит), растяжение капсулы сустава воспалительным выпотом, туннельные синдромы, функциональная нестабильность пораженных суставов. Боль и ригидность имеют не меньшее значение в полиморфной картине АС и других ССА. Известно, что боль воспалительного типа в позвоночнике входит в диагностические критерии АС.
Модифицированные критерии воспалительной боли в спине:
- утренняя скованность более 30 минут;
- улучшение после выполнения физических упражнений;
- пробуждение во второй половине ночи из-за болей;
- перемежающая боль в ягодицах [1].
Боль в спине считается воспалительной при наличии минимум двух из четырех перечисленных признаков, при этом чувствительность критериев составляет 70,3, а специфичность – 81,2 %.
Динамика интенсивности боли является одним из показателей ответа на проводимую терапию и критерием ремиссии при АС (ASAS response criteria и ASAS remission criteria) [2]. Что же касается ригидности или скованности, то этот симптом, как и при РА, адекватно отображает активность воспалительного процесса при АС, причем в большей степени, чем такие лабораторные тесты, как СОЭ и уровень С-реактивного белка. Динамика выраженности и продолжительности утренней скованности также позволяет судить об эффективности проводимой терапии. Для АС и других ССА это тем более важно, что при этой группе заболеваний наблюдается диссонанс клинических и лабораторных показателей активности заболевания и нередко выраженный воспалительный процесс может протекать с нормальными или субнормальными лабораторными показателями в течение длительного периода, а подчас и всего срока заболевания.
В дебюте АС ригидность или скованность преимущественно локализуется в поясничном отделе позвоночника и постепенно распространяется по всему осевому скелету. Она обычно более выражена в ранние утренние часы, но у некоторых больных с высокой активностью воспалительного процесса держится на протяжении всего дня. Интенсивность и длительность ригидности соответствуют интенсивности болей в позвоночнике, подчеркивая их единый генез. Наличие воспалительного процесса в осевом скелете вызывает рефлекторное напряжение мышц спины, что в свою очередь приводит к изменению осанки и деформации позвоночника (нивелируется физиологический лордоз в поясничном отделе позвоночника, подчеркивается кифоз в грудном и развивается гиперлордоз в шейном отделах). В далеко зашедших случаях формируется характерная для больных АС поза “просителя” с положительным симптомом Форестье, высокими значениями теста Томайера и значительным нарушением функциональной способности позвоночника, причем ограничение подвижности и деформация позвоночника поддерживаются не только структурными изменениями в суставах и связках позвоночника, но и гипертонусом мышц.
Причинами болевого синдрома при АС являются воспалительные изменения в периферических, корневых и крестцово-подвздошных суставах, а также в позвоночнике. Как известно, все структуры позвоночного столба, за исключением костной ткани, содержат нервные окончания и могут быть причиной появления боли [3]. Свободные нервные окончания, выполняющие функцию болевых рецепторов, выявлены в капсулах межпозвонковых суставов, задней продольной и межостистой связках, периосте позвонков, стенках артериол и вен, сосудах паравертебральных мышц, наружной трети фиброзного кольца межпозвоночных дисков. Боли в позвоночнике при этом заболевании могут быть проявлением вертеброгенного корешкового синдрома (радикулопатии) или рефлекторных болевых синдромов.
Помимо компрессионных синдромов при АС возможны рефлекторные (мышечно-тонические) синдромы, обусловленные раздражением рецепторов в ответ на изменения в дисках, связках и суставах позвоночника. Импульсы от рецепторов достигают двигательных нейронов спинного мозга, что сопровождается повышением тонуса соответствующих мышц. Спазмированные мышцы приводят к ограничению подвижности определенного сегмента позвоночника, а также становятся вторичным источником боли, который запускает порочный круг “боль–мышечный спазм–боль”. Такие изменения сохраняются в течение длительного времени и способствуют формированию миофасциального синдрома [3]. Следует отметить, что в генезе развития контрактур и фиброза мышц также принимает участие гипертонус поперечно-полосатой мускулатуры. Некоторые авторы рассматривают повышение мышечного тонуса как один из факторов риска неблагоприятного прогноза АС.
При остеоартрозе – основном дегенеративном заболевании суставов – ригидность не имеет столь большого значения, как при воспалительных заболеваниях суставов. Основными проявлениями этого заболевания являются боли в суставах и ограничение их подвижности. Боль носит упорный характер, а у некоторых больных держится почти постоянно. Однако нередко наблюдается и асимптоматическое течение заболевания. Боль при остеоартрозе имеет гетерогенное происхождение и связана с поражением различных структур сустава. При заинтересованности субхондральной кости она служит проявлением внутрикостной гипертензии и микропереломов. Болью сопровождается воспаление синовиальной оболочки, связок, энтезов и суставной капсулы, например, вследствие их растяжения. Крупные остеофиты вызывают боль за счет травматизации мягких тканей. При поражениях коленных или тазобедренных суставов, протекающих с реактивным (вторичным) синовитом, боль трансформируется из механического типа в воспалительный с закономерным появлением утренней ригидности, хотя ее продолжительность и не превышает 30 минут.
Среди отдельных болевых синдромов, которые встречаются в практике врача-ревматолога, болевой синдром в области позвоночника является наиболее распространенным вариантом, связанным с патологией опорнодвигательного аппарата. Известно, что боли в позвоночнике занимают 5-е место среди всех причин обращений к врачу и 2-е – среди причин утраты трудоспособности. С ними связано примерно 25 % от общих потерь рабочего времени. Важным обстоятельством является тот факт, что наибольшая распространенность болей в позвоночнике падает на молодой возраст (от 30 до 50 лет).
Боль и/или ригидность являются типичными симптомами не только воспалительных, но и дегенеративных заболеваний позвоночника. Большое значение придается боли, которая локализуется между 12-й парой ребер и ягодичной складкой. Она обозначается как поясничная боль, или боль в нижней части спины (low back pain) [4]. Все эти заболевания, сопровождающиеся неспецифической болью в позвоночнике, в настоящее время объединены термином “дорсопатии” и включают синдромы вертеброгенного и невертеброгенного генеза [5]. К заболеваниям вертеброгенного генеза относятся прежде всего дегенеративные болезни позвоночника, а именно межпозвонковый остеохондроз и деформирующий спондилоартроз, а также нестабильность позвоночника с формированием спондилолистеза или грыжи диска, являющиеся, как правило, производными межпозвонкового остеохондроза. К этой группе относятся также спинальный стеноз, патологические переломы при остеопорозе, травматические повреждения позвоночника и наиболее частое поражение – мышечно-тонический синдром. Что же касается невертеброгенных причин, то к их числу можно отнести патологию мышц и связок спины, поражения внутренних органов, забрюшинного пространства, психические расстройства и т. д.
Мышечно-тонический (миофасциальный) синдром имеет четко очерченную клиническую картину. Он встречается у 30–85 % больных со скелетномышечными болями. Основными причинами его развития являются аномалии костно-мышечного скелета, длительная иммобилизация мышцы и ее непосредственное сдавление, переохлаждение мышц, психические факторы и болезни внутренних органов и суставов. Этот симптомокомплекс характеризуется наличием триггерных точек, которые представляют собой ограниченные очаги локальной болезненности, расположенные в пучках напряженных мышечных волокон. Надавливание на такую точку обычно индуцирует не только локальную болезненность, но и боль в отдаленном участке. Активная триггерная точка является источником спонтанных болевых ощущений в покое и при движении, а также способствует нарушению функции мышцы и чаще локализуется в шее, плечевом и тазовом поясе, трапециевидной мышце, квадратной мышце поясницы. Диагностические критерии миофасциального синдрома включают спазмированную, болезненную мышцу, наличие болезненного мышечного уплотнения и активные триггерные точки.
Дорсопатия может быть связанной с компрессией спинальных корешков и их ишемией (невропатическая или радикулярная боль). При компрессии корешков, которая обычно сопровождается их отеком, наблюдается диссонанс между клинической картиной и выраженностью дегенеративных изменений, выявляемых рентгенографически, как и локализацией межпозвоночных грыж. Сегментарная нестабильность позвоночника характерна для женщин среднего возраста с ожирением. Боль в спине при этом усиливается при нагрузке, ограничение подвижности позвоночника выражено незначительно, редко наблюдается и неврологическая симптоматика. Следует иметь в виду и наличие психогенной боли с локализацией в нижней части спины, возникающей на фоне актуальной или хронической психической травмы. Для нее типичны тревожно-депрессивные расстройства, умеренно выраженный мышечно-тонический синдром, боль в пояснице при аксиальной нагрузке, несоответствие сенсорных расстройств в зоне иннервации корешка.
При остеопорозе боль в позвоночнике является следствием имеющегося компрессионного перелома тел позвонков. Его диагноз ставится на основании снижения высоты тел позвонков или их клиновидной деформации. Для диагностики остеопороза важны также такие симптомы, как уменьшение роста, “круглая” спина, изменение осанки, эпизоды болей в спине, утомляемость и ноющие боли в спине после вынужденного пребывания в одном положении или ходьбы, однако основное значение придается снижению минеральной плотности костной ткани.
При остеопорозе выделяют четыре типа боли [6]:
- Острая боль при свежем переломе позвонка, которая иррадиирует в грудную клетку, брюшную полость или бедро и резко ограничивает движения. Такая боль обычно резкая, усиливается при минимальных движениях, длится 1–2 недели и постепенно стихает в течение 2–3 месяцев.
- Боль, связанная со снижением высоты тел позвонков (вертебральный коллапс). Она является следствием увеличения поясничного лордоза, компенсирующего увеличение передне-задней кривизны в месте перелома.
- Боль в спине, возникающая при множественных компрессионных переломах. Обычно она незначительно выражена и персистирует вследствие механического сдавления связок, мышц или мест их прикрепления.
- Выраженный кифоз и снижение роста могут быть причиной боли от давления на ребра, гребень подвздошных костей и межвертебральные суставные поверхности.
Для дегенеративных заболеваний позвоночника или его нестабильности, как и для остеопороза, типичны боли механического характера. Они характеризуются постепенным развитием, усилением в положении стоя, при физической нагрузке или к концу дня, минимальной утренней скованностью (< 30 минут), а также уменьшением объема движений. Выявление воспалительного или механического характера боли в позвоночнике имеет большое значение при проведении дифференциальной диагностики заболеваний осевого скелета.
Болевые синдромы в осевом скелете периодически возникают почти у всех людей в возрасте после 40 лет. У лиц моложе 45 лет боли в нижней части спины являются самой частой причиной временной потери трудоспособности. При дегенеративных заболеваниях позвоночника основными патогенетическими факторами развития таких синдромов являются компрессионные механизмы и рефлекторные влияния с присоединением воспалительных нарушений, микроциркуляторных расстройств и их сочетаниями. Особенность болевых синдромов в поясничном отделе позвоночника – комбинация рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоционально-личностной сфере.
Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы (около 85 % больных с болями в спине) [3]. Они обусловлены раздражением как рецепторов фиброзного кольца, так и мышечно-суставных структур позвоночника, обычно не сопровождаются неврологическими нарушениями. В таких случаях рано развивается мышечный спазм, который поначалу носит характер защитного физиологического феномена, повышая болевой порог и ограничивая подвижность заинтересованного отдела позвоночника. Спазмированные мышцы являются вторичным источником боли, и они запускают порочный круг, что и способствует развитию миофасциального синдрома.
Регуляция мышечного тонуса осуществляется под влиянием центральной и периферической импульсации α-мотонейронов спинного мозга. Эти мотонейроны, расположенные в передних рогах спинного мозга, осуществляют иннервацию мышечных волокон [7]. В основе возникновения спастичности лежит нарушение тормозящих влияний супраспинальных отделов на спинальные двигательные и вставочные нейроны. Эти нарушения на спинальном уровне приводят к дисбалансу процессов возбуждения и торможения. В происхождении спастичности принимает участие не только дисфункция центральной и периферической нервной системы. Не меньшее значение в этом процессе имеет органическое и функциональное состояние поперечно-полосатой мускулатуры.
При диагностике дорсопатий следует обращать внимание на факторы, провоцирующие боль, ее характер, иррадиацию и время появления, возможные нарушения функций тазовых органов, наличие общих симптомов (лихорадка, снижение массы тела). Тщательное обследование пациента требуется при наличии стойких болей в спине, их воспалительном ритме и постепенном нарастании, онкологическом анамнезе, течении болезни на фоне лихорадки, симптомах поражения спинного мозга или лабораторных показателях воспалительной активности.
Терапия болевых синдромов зависит от характера основного заболевания, этапности их развития, интенсивности и наличия спастического компонента. Терапия вертеброгенной боли требует индивидуального и комплексного подхода с учетом фазы патологического процесса. Основными принципами лечения болей в позвоночнике являются: исключение неблагоприятных статико-динамических нагрузок, стимулирование активности мышц позвоночника, воздействие на вертебральные и экстравертебральные очаги поражения, назначение противовоспалительных препаратов, щадящий характер лечебных воздействий. Фармакотерапия направлена на купирование боли простыми (парацетамол) или опиоидными (трамадол, Залдиар) анальгетиками, более сильными средствами, включая обезболивающие коктейли или блокады, а также включает назначение антиконвульсантов и антидепрессантов, проведение противовоспалительной терапии (нестероидные противовоспалительные средства – НПВС, глюкокортикоиды), прием миорелаксантов, антихолинэстеразных средств. Большое значение имеет назначение препаратов, способных разорвать порочный круг “боль–спазм–боль”. К числу таких лекарственных средств относится Катадолон.
Катадолон (флупиртина малеат) является анальгезирующим ненаркотическим средством нового класса веществ SNEPCO (Selective Neuronal Potassium Channel Opener – селективные активаторы калиевых нейрональных каналов). Он относится к неопиоидным анальгетикам центрального действия, является производным триаминопиридина, обеспечивает нейропротекцию и нормализацию мышечного тонуса. Это один из немногих анальгетиков, способных препятствовать переходу боли в хроническую форму.
Механизмы реализации анальгетической активности Катадолона:
- селективное открытие K+-каналов стабилизирует потенциал покоя нервной клетки (нейрон становится менее возбудимым);
- блокада кальциевых каналов и снижение внутриклеточного тока ионов кальция (непрямой антагонист NMDA-рецепторов);
- торможение возбуждения нейрона в ответ на ноцицептивные стимулы (анальгезия);
- избирательно подавляет боль на уровне чувствительных нейронов задних рогов спинного мозга;
- блокирование передачи возбуждения на мотонейроны и промежуточные нейроны приводит к снятию мышечного напряжения.
Фармакологическая активность Катадолона основана на его непрямом антагонизме по отношению к NMDA (N-метил-D-аспартат) – рецепторам, принимающим активное участие в нисходящих механизмах модуляции боли и ГАМКергических процессах [8]. Катадолон в терапевтических дозах открывает потенциал-независимые каналы для ионов калия, что приводит к стабилизации мембранного потенциала нервной клетки и торможению возбуждения нейрона в ответ на ноцицептивные стимулы. В результате сдерживается формирование ноцицептивной сенситизации (болевой чувствительности) и феномена “wind up” (“взвинчивание” – нарастание нейронального ответа на повторные болевые стимулы), что предотвращает усиление боли и ее переход в хроническую форму, а при уже имеющемся хроническом болевом синдроме ослабляет его интенсивность. Имеются указания, что Катадолон воздействует на восприятие боли как на спинальном, так и на супраспинальном (таламическом) уровне.
Миорелаксирующее действие Катадолона связано с блокадой передачи возбуждения на мотонейроны и промежуточные нейроны, что и ведет к снятию мышечного напряжения. Что же касается нейропротективных свойств этого препарата, обусловливающих защиту нервных структур от токсического действия высоких концентраций ионов внутриклеточного кальция, то они связаны с его способностью вызывать блокаду нейрональных ионных кальциевых каналов и снижать внутриклеточный ток ионов кальция. Миорелаксация, вызванная применением Катадолона, не приводит к генерализованной мышечной слабости, поскольку спазмированные мышцы расслабляются только в очаге боли, а также не влияет на мышечную силу, что особенно актуально для больных пожилого возраста.
Интересными представляются биологические эффекты, возникающие при комбинированном применении Катадолона и НПВС. Он усиливает анальгетические свойства НПВС, что позволяет сократить их дозу и продолжительность приема. В то же время Катадолон лишен многих негативных особенностей НПВС, в частности не влияет на слизистую оболочку желудочно-кишечного тракта.
При длительном применении Катадолона (на протяжении ряда месяцев и даже лет) его обезболивающий эффект не только не уменьшается, но в ряде случаев становится более выраженным (рис. 1). Он способен вмешиваться в специфические механизмы хронической боли и прерывать ее за счет стабилизации мембранного потенциала, что позволяет “стереть” болевую память и снизить болевую чувствительность [9]. Кроме того, Катадолон сдерживает формирование болевой гиперчувствительности и феномена “взвинчивания”, т. е. нарастания боли в ответ на повторные подпороговые неболевые стимулы. Следует отметить, что при этом препарат не вызывает зависимости и привыкания.

Эффективность Катадолона продемонстрирована в многочисленных рандомизированных контролируемых исследованиях, в которых он сравнивался с другими анальгетиками или плацебо. Наибольшее количество работ выполнено у больных с дегенеративными заболеваниями позвоночника и миофасциальным синдромом [10]. При этих заболеваниях Катадолон оказывает выраженный обезболивающий эффект, а также уменьшает исходно повышенный мышечный тонус, особенно у больных с мышечно-тоническими и миофасциальными синдромами [11]. Хорошие результаты получены и при лечении большой когорты больных остеопорозом, сопровождающимся болями в позвоночнике [12].
Катадолон выпускается в капсулах по 100 мг. Он назначается внутрь с небольшим количеством жидкости (100 мл). Суточная доза составляет 300–400 мг. Максимальная суточная доза не превышает 600 мг. Дозу подбирают в зависимости от интенсивности боли и индивидуальной чувствительности больного к препарату. У пациентов с выраженными признаками почечной недостаточности или при гипоальбуминемии суточная доза не должна превышать 300 мг, как и у больных с нарушением функциональной активности печени. Длительность терапии зависит от динамики болевого синдрома и переносимости.
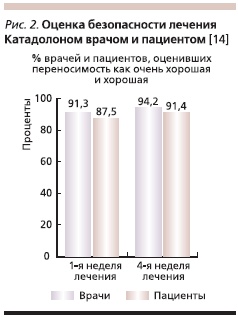
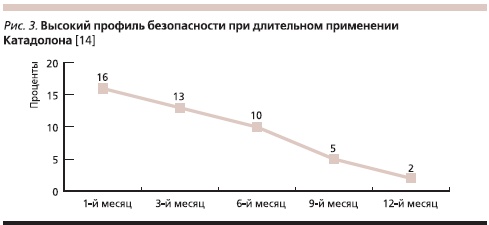
При применении Катадолона возможно развитие нежелательных реакций. Наиболее часто встречается общая слабость, которая обычно сопровождает начальный период лечения этим препаратом, реже – головокружение, головная боль, тошнота, рвота, изжога, нарушение стула, метеоризм, боль в животе, сухость во рту, потеря аппетита, нарушение сна, беспокойство, нервозность, тремор. Большинство из этих проявлений имеют транзиторный характер и после отмены препарата или даже на фоне его приема полностью проходят без каких-либо дополнительных лечебных мероприятий. Катадолон усиливает действие алкоголя, седативных средств и миорелаксантов. При его одновременном назначении с производными кумарина рекомендуется регулярно контролировать протромбиновый индекс. Следует избегать комбинированного применения Катадолона и лекарственных средств, содержащих парацетамол. Однако переносимость препарата в целом хорошая (рис. 2, 3). В двойном слепом исследовании показано, что нежелательные явления на фоне приема Катадолона встречаются в 3 раза реже по сравнению с трамадолом [13].
Согласно рекомендациям Немецкой Ассоциации по изучению боли Катадолон можно назначать на любом этапе развития болевого синдрома, а именно при острой, подострой и хронической боли [15]. Основным показанием к лечению этим препаратом являются боли в спине, ассоциированные с повышенным тонусом скелетной мускулатуры, что наблюдается при многих воспалительных и дегенеративных заболеваниях позвоночника. Наиболее характерна такая ситуация для межпозвонкового остеохондроза, деформирующего спондилеза, артроза межпозвонковых (фасеточных) суставов, грыж межпозвонковых дисков, спондилолистеза, миофасциального синдрома, а также спондилоартритов/спондилоартропатий, включая анкилозирующий спондилит. Кроме того, этот препарат рекомендуется для лечения головной боли напряжения, онкологической боли, компрессионных переломов позвоночника, связанных с остеопорозом, послеоперационной и посттравматической боли, дисменореи. Катадолон является препаратом выбора при болях, поскольку сочетает в себе фармакологическую активность анальгетиков и миорелаксантов, исключая проявление побочных эффектов последних. Его целесообразно использовать в реальной клинической практике ревматолога.
Информация об авторе:
Бадокин Владимир Васильевич – профессор, заведующий кафедрой ревматологии Российской
медицинской академии последипломного образования.
E-mail vbadokin@yandex.ru



