Остеопороз (ОП) – одна из важных медико-социальных проблем в развитых странах мира. Частота заболеваемости ОП увеличивается с возрастом, а связанные с ним осложнения растут с увеличением продолжительности жизни. Согласно подсчетам, в Российской Федерации ОП страдают 14 млн человек (10 % населения страны), еще 20 млн имеют остеопению. Таким образом, у 34 млн человек присутствует высокий риск переломов [2].
В структуре первичного ОП на долю постменопаузального приходится 85 % случаев заболевания. Женщины в 2 раза чаще имеют риск развития ОП и переломов, связанных с ним. Среди городского населения России 24 % женщин в возрасте 50 лет и старше имеют один остеопоретический перелом. По данным Всемирной организации здравоохранения, средняя продолжительность жизни женщин в России составляет 72 года. Около 20 лет приходится на период постменопаузы, т.е. на время высокого риска развития ОП и риска остеопоротических переломов, главным образом костей запястья, ребер, тел позвонков, шейки бедренной кости [2].
Прогрессирование ОП характеризуется значительным снижением минеральной плотности костной ткани (МПКТ), нарушением ее микроархитектоники, что приводит к повышению хрупкости костей и риску низкотравматичных переломов. Потеря плотности кости происходит постепенно, скрыто и часто диагностируется уже после случившихся переломов, что и дало основание назвать ОП «безмолвной эпидемией» [3].
Как показали эпидемиологические исследования, в течение первых 5 лет после наступления менопаузы потеря костной массы у женщин может составить до 30 %. Так, для 50-летней женщины риск перелома позвоночника составляет в среднем 15,5 %, шейки бедра – 17,5 %, костей запястья – 16,0 %.
Старение популяции приводит к непропорциональному увеличению числа переломов. Согласно прогнозу, в Российской Федерации 1 из 3 женщин после 80 лет на фоне ОП получит перелом шейки бедра. Как показали международные исследования, у женщин в возрасте старше 65 лет, остеопоротические переломы шейки бедра составляют 90 % [3].
Профилактика любого заболевания эффективнее, надежнее и дешевле лечения и предусматривает первоочередное воздействие на центральное звено его патогенеза. При постменопаузальном ОП в основе наблюдаемых изменений в костях лежит ослабление костнопротективного эффекта половых стероидов на фоне их абсолютной недостаточности. Это предполагает, что заместительную гормональную терапию (ЗГТ) препаратами женских половых стероидов вполне обоснованно можно рассматривать как «первую линию» лечебных воздействий, направленных на обеспечение сохранности МПКТ в условиях гипоэстрогении. Установлено, что эстрогены – эффективные антирезорбтивные средства, позволяющие сохранять архитектуру костных трабекул в постменопаузе [4].
Селективные модуляторы эстрогеновых рецепторов (СМЭР) действуют как агонисты эстрогенов в одних органах (сердечно-сосудистая система, костная ткань) и как антагонисты – в других (матка, молочная железа). В настоящее время собраны убедительные данные, согласно которым селективные модуляторы эстрогеновых рецепторов служат эффективным и перспективным препаратом профилактики ОП, возможно, сердечно-сосудистых заболеваний у женщин в менопаузе. Использование СМЭР позволяет расширять профилактические возможности женщин, имеющих какие-либо противопоказания к назначению классической ЗГТ [5].
Тиболон претерпел длительный этап испытаний длиною в 25 лет, прежде чем его одобрили в качестве коррекции эстрогендефицитных состояний. Тиболон впервые синтезировали в 1964 г. в Нидерландах (Ливиал, Organon), а в настоящее время он успешно синтезируется в Словацкой Республике (Ледибон, ZENTIVA). Препарат зарегистрирован в 91 стране для лечения климактерического синдрома и в 55 странах для профилактики ОП. На этапе доклинических и клинических испытаний было выявлено, что тиболон обладает эстрогенной, прогестагенной и андрогенной активностью. Однако было трудно объяснить отсутствие его стимулирующего эстрогенного влияния на молочные железы и эндометрий. В результате интенсивного изучения механизма действия тиболона и его метаболитов установлена их тканеселективная активность в различных органах и тканях, на основании которой препарат отнесен к группе СМЭР [6].
По химической структуре тиболон является 19-норстероидным прогестином. Введение 7α-метильной группы в норэтинодрел, который имеет двойную связь в положении 5–10, резко изменило его прогестагенные свойства и способствовало развитию эстрогенных. Биопробы показали, что тиболон может имитировать активность всех трех половых стероидов. Эстрогенное и анаболическое влияние тиболона поддерживает положительный баланс кальция в организме, и данное свойство стало отправной точкой для последующих исследований, касающихся метаболических заболеваний костей [7].
В 1979 г. проведены детальные исследования метаболитов тиболона. Осуществить радиоиммунологический анализ in vitro/in vivo не представлялось возможным, т.к. тиболон очень быстро подвергался метаболизму. Исследование «меченого» тиболона продемонстрировало образование его трех основных метаболитов. После приема внутрь тиболон под влиянием ферментов 3α- и 3β-гидроксистероиддегидрогеназ и изомеразы в печени и тонком кишечнике превращается в три биологически активных метаболита: 3α-, 3β-гидрокси (3α- и 3β-ОН) метаболиты и Δ4-изомер. Гидроксильные метаболиты тиболона исключительно связываются с эстрогеновыми рецепторами, а третий, Δ4-изомер, связывается с рецепторами к прогестерону и рецепторами к андрогенам. Оба 3-гидроксиметаболита являются агонистами эстрогеновых рецепторов у человека. Хотя эти метаболиты слабее эстрадиола, но эстрогенный ответ объясняется их высоким уровнем в кровотоке. Оба метаболита, обладающих эстрогенной активностью, быстро попадают в кровоток, при этом уровень 3α-ОН метаболита в 3 раза выше, чем 3β-ОН. Период полураспада 3α-ОН и 3β-ОН метаболитов в кровотоке составляет 7–8 часов, но они могут определяться в кровотоке в низких концентрациях в течение 5 дней. 3α-ОН и 3β-ОН метаболиты обладают большим родством с α-эстрогеновыми рецепторами (α-ER), чем с β-ER [8, 9].
 Таким образом, ассоциированная активность трех метаболитов определяет гормональное влияние тиболона на органы-мишени. Около 80 % метаболитов тиболона существует в кровотоке в неактивных моно- и дисульфатных формах, которые под влиянием фермента сульфатазы могут превращаться в активные на локальном тканевом уровне [9].
Таким образом, ассоциированная активность трех метаболитов определяет гормональное влияние тиболона на органы-мишени. Около 80 % метаболитов тиболона существует в кровотоке в неактивных моно- и дисульфатных формах, которые под влиянием фермента сульфатазы могут превращаться в активные на локальном тканевом уровне [9].
Первое многоцентровое исследование тиболона в лечении ОП стартовало в 1971 г., но его не удалость закончить из-за отсутствия стандартизации измерения МПКТ в различных центрах и получения различных результатов. В 1973 г. было начато новое исследование. Изначально участницы исследования получали более высокие дозы тиболона (2,5 мг 2 раза в сутки). Через 3 месяца доза была снижена до 1,25 мг 2 раза в сутки. Использование тиболона постменопаузальными женщинами с ОП в различных дозах в течение 2 лет не сопровождалось потерей МПКТ по сравнению с группой плацебо. При исследовании меньшей дозы существенно сокращалась выраженность климактерических проявлений и улучшение настроения. При анализе биоптатов эндометрия женщин, использующих тиболон, гиперплазии выявлено не было [10].
В 1982 г. с помощью биопроб анализировался гормональный профиль тиболона. Эстрогеновая активность – такая же, как у этинилэстрадиола, составила 10 %, прогестероновая, как у норэтистерона, – 12 %, анрогенная, как у метилтестостерона, – 2 %. Относительная связывающая аффинность для Δ4-метаболита составила 30 % по сравнению с дигидротестостероном, обладающим данным свойством на 100 %.
Присоединение 7α-метильной группы к структуре тиболона привело к увеличению эстрогенных свойств и уменьшению прогестероновой активности по сравнению с норэтинодрелом [11].
Тиболон проявляет эстрогенное влияние и на костную ткань, связываясь с эстрогеновыми рецепторами.
В своих исследованиях это подтвердили Ederveen и соавт. в 2001 г. [12].
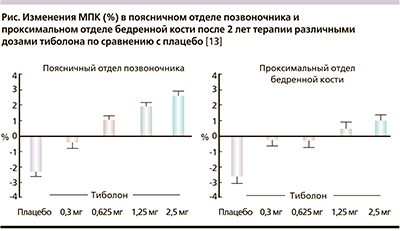
J.C. Gallagher и соавт. в своем исследовании с участием 770 женщин попытались определить минимально эффективные дозы тиболона в профилактике потери МПКТ у женщин в постменопаузе. На протяжении 2 лет было изучено несколько доз тиболона (0,3; 0,625; 1,25; 2,5). Все дозы (кроме 0,3 мг в сутки) прогрессивно увеличивали МПКТ в поясничном отделе позвоночника и общем бедре на протяжении всего периода наблюдения. При использовании дозы в 0,3 мг динамики изменения МПКТ в общем бедре не регистрировали. Установлено, что разницы средних процентных изменений МПКТ в сопоставлении с исходным уровнем в позвоночнике и всей бедренной кости были статистически значимы (p < 0,05) для всех доз тиболона по сравнению с плацебо. Достоверное увеличение МПКТ шейки бедра отмечено начиная с дозы 1,25 мг/сут [13]. Основные результаты продемонстрированы на рисунке.
В длительном открытом нерандомизированном исследовании женщин в постменопаузе изучалась реакция МПКТ на тиболон по сравнению с плацебо. Результаты подтвердили, что спустя 8 лет с момента начала терапии в основной группе имело место значительное увеличение МПКТ как в поясничном отделе позвоночника (4,1 %), так и в шейке бедренной кости (4,6 %; р < 0,05). В группе женщин, получавших плацебо, установлено снижение МПКТ в соответствующих отделах скелета [14].
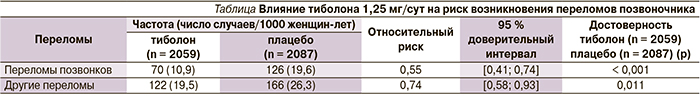
На основании полученных данных начато исследование LIFT (Longterm Intervention on Fractures with Tibolone trial) по определению влияния тиболона в дозе 1,25 на риск переломов при ОП у пожилых женщин. В исследование были включены 4538 женщин в постменопаузе. Средний возраст участниц составил 68,3 года. Оценка МПКТ в поясничном отделе позвоночника и в бедренной кости проведена с помощью двухэнергетической абсорбциометрии; T-критерий соответствовал ОП. Полученные результаты позволили сделать вывод: тиболон в дозе 1,25 мг/сут снижает риск как первичных, так и повторных переломов поясничного отдела позвоночника (см. таблицу) [15].
Таким образом, изучение кинетики и механизма действия тиболона и его метаболитов показало сложность его влияния в различных органах и тканях. С одной стороны, по химической структуре он относится к гормонам и, следовательно, используется как гормонотерапия при эстрогендефицитных состояниях. С другой – наряду непосредственно с гормональным воздействием тиболон оказывает влияние через ферментную регуляцию в отдельно взятых органах (молочной железе, эндометриий, костной ткани и др.). На основании многочисленных исследований как на животных, так и на человеке тиболон был отнесен к достоверно эффективным препаратам, которые могут применяться с заместительной целью женщинами в период постменопаузы, восполняя уровень эстрогенов и предотвращая потерю МПКТ после менопаузы или овариэктомии.


