Введение
На сегодняшний день ингибиторы протонной помпы (ИПП) относятся к наиболее эффективным и безопасным препаратам для лечения кислотозависимых заболеваний. Они обладают выраженным кислотосупрессивным действием и способны при однократном приеме обеспечивать целевые показатели рН в течение 16–18 часов [1]. При этом, несмотря на эквивалентный механизм действия ИПП, представленных на фармакологическом рынке, между ними существуют некоторые различия, проявляющиеся в скорости наступления антисекреторного эффекта, его выраженности, продолжительности действия, быстроте купирования симптомов заболевания и частоте возможных побочных проявлений [2, 3].
По химической структуре все ИПП являются производными бензимидазола, различающимися «надстройками» ядра, которые обеспечивают их индивидуальные особенности. Отличительные свойства касаются в основном скорости наступления и продолжительности кислотоподавления, рН-селективности, зависимости от генетически-детерминированных вариантов метаболизма, взаимодействия с другими одновременно принимаемыми препаратами [1, 2]. В данном контексте необходимо отметить, что ИПП последнего поколения рабепразол (Париет®) обладает наиболее оптимальными характеристиками, выгодно отличающими его от других представителей разбираемого класса.
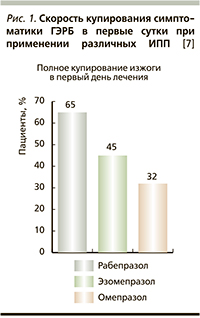 На сегодняшний день известно, что скорость накопления ИПП в канальцах париетальных клеток определяется показателем константы ионизации (диссоциации) – рКа: чем больше константа, тем выше скорость трансформации ИПП в активную форму [4]. Рабепразол обладает наиболее высокой рКа = 5,0, что позволяет ему быстрее кумулироваться в кислых компартментах париетальных клеток и оказывать антисекреторное действие [3, 5, 6]. Отражением этого эффекта служит более быстрое купирование симптоматики в первый день лечения, что подтверждается клиническими исследованиями (рис. 1) [7].
На сегодняшний день известно, что скорость накопления ИПП в канальцах париетальных клеток определяется показателем константы ионизации (диссоциации) – рКа: чем больше константа, тем выше скорость трансформации ИПП в активную форму [4]. Рабепразол обладает наиболее высокой рКа = 5,0, что позволяет ему быстрее кумулироваться в кислых компартментах париетальных клеток и оказывать антисекреторное действие [3, 5, 6]. Отражением этого эффекта служит более быстрое купирование симптоматики в первый день лечения, что подтверждается клиническими исследованиями (рис. 1) [7].
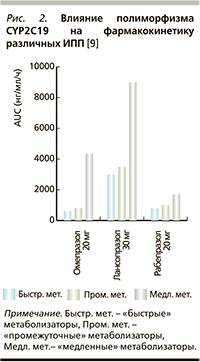
Скорость метаболизма, а соответственно, и эффективность ИПП в первую очередь детерминирована полиморфизмом гена, кодирующего изоформу системы цитохрома Р450 – CYP2С19. В зависимости от типов мутаций CYP2С19 популяцию можно подразделить на три фенотипические группы: «быстрые» метаболизаторы (нет мутаций), «промежуточные» метаболизаторы (мутация в одной аллели) и «медленные» метаболизаторы (мутация в обеих аллелях) [6, 8]. Пациенты с фенотипом «быстрых» метаболизаторов осуществляют ускоренный метаболизм ИПП, а следовательно, антисекреторный эффект от приема ИПП у них имеет меньшую выраженность, чем у пациентов с фенотипами «промежуточных» и «медленных» метаболизаторов [3, 4, 8]. Рабепразол метаболизируется преимущественно неэнзиматическим путем, за счет чего обладает более стабильным профилем фармакокинетики (наименьший разброс показателя AUC – Area Under Curve в зависимости от генотипа), в меньшей степени зависящим от полиморфизмов CYP2С19 (рис. 2) [9]. Данное свойство препарата обеспечивает более предсказуемый антисекреторный эффект.
Однако в современной клинической практике помимо непосредственной клинической эффективности препарата приходится учитывать и его стоимость, а также стоимость затрат, прямо или косвенно связанных с лечением конкретного заболевания [10]. Данное обстоятельство подчеркивает важность проведения фармакоэкономического анализа при лечении кислотозависимых заболеваний для клинической и экономической оптимизации терапии.
Общие принципы фармакоэкономического анализа
Фармакоэкономический анализ – это инструмент, помогающий выбрать, основываясь на минимальном соотношении «затраты–эффективность», препарат из группы аналогов. Анализ «стоимости болезни» (cost of illness) подразумевает оценку прямых (direct cost) и непрямых затрат (indirect cost), выраженных в денежных единицах. Прямые затраты (расходы) определяются как непосредственные расходы, связанные с оказанием медицинской помощи. Их можно разделить на прямые медицинские и непрямые медицинские [11, 12].
Прямые медицинские затраты включают:
- расходы на содержание пациента в лечебном учреждении (гостиничные услуги) или стоимость оказываемых ему на дому услуг, в т.ч. средним медицинским персоналом;
- стоимость профессиональных медицинских услуг (плата за врачебные консультации, оплата рабочего времени врачей и медицинских сестер);
- стоимость лекарственных препаратов (ЛП);
- стоимость лабораторного и инструментального обследования;
- стоимость медицинских процедур (таких, как хирургические операции, реабилитационные мероприятия, санитарно-противоэпидемические мероприятия);
- стоимость транспортировки больного санитарным транспортом;
- стоимость питания больного в стационаре;
- плату за использование медицинского оборудования, площадей и средств (распределение фиксированных затрат из статей бюджета);
- коррекцию побочных эффектов ЛП.
Более сложным представляется учет непрямых (косвенно-социальных) затрат, к которым относят:
- затраты за период отсутствия пациента на его рабочем месте из-за болезни или выхода на инвалидность;
- «стоимость» времени отсутствия на работе членов семьи пациента или его друзей, связанного с его болезнью;
- экономические потери от снижения производительности труда на месте работы;
- экономические потери от преждевременного наступления смерти;
- потеря дохода для семьи.
В последнее время фармакоэкономической наукой были усовершенствованы методы анализа, которые позволяют проводить взаимосвязанную оценку эффективности лекарств, затратности лечения и при определенных условиях сопоставления выделить наиболее клинически и экономически целесообразные схемы и их компоненты.
Основную группу таких методов составляют анализ «затраты–эффективность» (CEA – cost-effectiveness analysis), анализ «минимизации затрат» (CMA – cost-minimization analysis), «затраты–полезность» (CUA – cost-utility analysis) и «затраты–выгода» (CBA – cost-benefits analysis) [11, 13].
В соответствии с международными принципами выбора медицинских технологий применение как минимум одного из перечисленных методов представляется обязательной составляющей при сравнении двух и более альтернативных вариантов медицинских вмешательств. На практике с этой целью, как правило, используют анализ «затраты–эффективность», в результате которого исследователи получают значения одноименного коэффициента «затраты–эффективность» (CER – cost-effectiveness ratio), обобщенно выражающего соотношение стоимости и влияния на показатели здоровья сравниваемых вмешательств в определенный промежуток времени. Смысл данного показателя в том, что чем ниже значение CER, тем фармакоэкономически целесообразнее медицинское вмешательство [13].
 В большинстве зарубежных руководств по проведению фармакоэкономического анализа рекомендуется приводить результаты анализа отношения «приращений» стоимости и эффективности вместе с указанием значений полной стоимости и эффективности для каждого медицинского вмешательства.
В большинстве зарубежных руководств по проведению фармакоэкономического анализа рекомендуется приводить результаты анализа отношения «приращений» стоимости и эффективности вместе с указанием значений полной стоимости и эффективности для каждого медицинского вмешательства.
Определение собственно коэффициента затратной эффективности Кeff (отношение стоимости к эффективности) строится по формуле: Кeff = Сost/Eff (где Соst – суммарные затраты; Еff – эффективность).
За единицу эффективности могут быть приняты как непосредственно клинические параметры (уровень артериального давления, гемоглобина), так и показатель «сохраненных лет жизни». Коэффициент затратной эффективности Кeff рассчитывается для всех альтернативных вмешательств (отсутствие вмешательства также может считаться вмешательством). Если значение эффективности считается равным нулю (Eff = 0), то Кeff не определен. Следует отметить, что в отсутствие вмешательства эффективность, так же как и затраты, часто бывает отличной от нуля. Наиболее эффективно вмешательство с наименьшим коэффициентом затратной эффективности. Если значения коэффициента Кeff совпадают для двух или более медицинских вмешательств, то для выбора необходимо проведение дополнительного анализа значений стоимости и эффективности. Например, часто в основу выбора может быть положен поиск вмешательства с наименьшей стоимостью или с наибольшей эффективностью. Выбор параметра, описывающего эффект, обычно осуществляется произвольно и может быть обусловлен рядом различных причин. В некоторых случаях он может принимать и отрицательные значения. Например, изменение частоты случаев заболевания при профилактическом лечении. Если профилактика по каким-то причинам приводит к дополнительным случаям заболевания, она будет обладать отрицательной эффективностью, соответственно, значение Кeff будет меньше 0. Поэтому перед вычислением коэффициента Кeff следует проанализировать методику выбора параметра эффективности и сразу отбросить вмешательства со значениями эффективности, меньшими, чем в отсутствие медицинских вмешательств.
Определение Кefi-коэффициента отношения приращений – отношение приращения стоимости к приращению эффективности:
Кefi = (Сost1–Сost2) : (Еff1–Еff2), где Сost1, Сost2 – суммарные затраты, Еff1, Еff2 – эффективность для медицинских вмешательств 1, 2 соответственно.
Если сравнивается более двух терапевтических вмешательств, выбирается референтное вмешательство. Рассчитываются коэффициенты приращения отношений Кefi для всех остальных вмешательств относительно референтного. Наиболее эффективно вмешательство с наименьшим коэффициентом отношения приращений. Равенство коэффициентов Кefi указывает на одинаковую удельную эффективность сравниваемых вмешательств. В случае равенства эффектов разность Еff1–Еff2 равна 0, отношение Кefi не определено и в этом случае для сравнения следует использовать анализ минимизации затрат. В большинстве зарубежных руководств (по проведению фармакоэкономического анализа) рекомендуется приводить результаты анализа отношения приращений вместе с указанием значений полной стоимости и эффективности для каждого медицинского вмешательства. И в первом и во втором подходе в случае нулевой эффективности и равных эффективностей Eff1, Eff2, соответственно, возникает неопределенность коэффициентов Keff и Kefi. В первом подходе следует исключить из дальнейшего рассмотрения вмешательства с нулевой эффективностью, за исключением случая отсутствия вмешательства, во втором – перейти к анализу минимизации затрат. Обычно при принятии решения о выборе терапии проведение анализа «стоимость–эффективность» целесообразно, если есть возможность и необходимость выбирать между стоимостью терапии и величиной ее эффективности [13]. В некоторых случаях такая возможность может полностью отсутствовать или быть нецелесообразной. Например, сильно ограниченный бюджет, что случается очень часто, приводит к тому, что приходится использовать наиболее дешевую терапию, в то время как неограниченный бюджет позволяет выбирать лечение с наибольшей эффективностью (обычно гипотетический случай). Также сюда можно отнести случаи, когда эффективность терапии не может быть ниже определенного значения, поскольку это может приводить к осложнениям или смерти пациента [14]. Анализ «затраты–эффективность» прост с технической точки зрения.
Наибольшие затруднения могут возникать на стадии планирования фармакоэкономического исследования, связаны с определением структуры затрат и выбором параметров эффективности для описания исходов вмешательства, которые, естественно, влияют на результат анализа.
Фармакоэкономика и кислотозависимые заболевания
Частные вопросы фармакоэкономики кислотозависимых заболеваний были подробно проанализированы в обзорной работе И.В. Маева, А.С. Трухманова, Ю.А. Кучерявого в 2006 г. [10]. В данном обзоре были проанализированы ключевые работы A. Kivioja и соавт., Б.Д. Старостина и соавт., М.Ф. Осипенко и соавт., С.А. Афендуловым и соавт., проведенные с 2000 по 2005 г. [15–18].
Исследованием A. Kivioja и соавт. [15] на основании анализа минимизации затрат (СМА) на оригинальный рабепразол, омепразол, эзомепразол и лансопразол для больных гастроэзофагеальной рефлюксной болезнью (ГЭРБ) было установлено, что результаты сравнения находились в зависимости от длительности антисекреторного эффекта препаратов.
 В группе ИПП с длительностью антисекреторного эффекта > 11 часов (10 мг оригинального рабепразола, 20 мг омепразола, 20 мг эзомепраэода и 15 мг лансопразола) минимальная стоимость лечения 1 больного (138,89 евро) отмечена при лечении лансопразолом.
В группе ИПП с длительностью антисекреторного эффекта > 11 часов (10 мг оригинального рабепразола, 20 мг омепразола, 20 мг эзомепраэода и 15 мг лансопразола) минимальная стоимость лечения 1 больного (138,89 евро) отмечена при лечении лансопразолом.
В группе ИПП с длительностью антисекреторного эффекта > 12 часов (10 мг оригинального рабепразола, 40 мг омепразола, 20 мг эзомепразола и 30 мг лансопразола) наиболее экономичной оказалась терапия рабепразалом (193,81 евро на 1 больного). В группе ИПП с длительностью антисекреторного эффекта > 13 часов (10 мг оригинального рабепразола, 40 мг омепразола и 40 мг эзомепразола) такой же результат показан для рабепразола (193,81 евро на 1 больного), из чего следует, что Париет служит препаратом, характеризующимся минимальной стоимостью лечения среди всех ИПП с наиболее длительным антитисекреторным эффектом в поддерживающей (постоянной и но требованию) терапии ГЭРБ.
В исследованиях Б.Д. Старостина и соавт. [16] при 8-недельном лечении 98 пациентов с эрозивной и неэрозивной ГЭРБ Париетом (20 мг/сут) и эзомепразолом (40 мг/сут) общие затраты при использовании рабепразола были примерно в 2 раза ниже.
Несомненный интерес представляют результаты фармакоэкономического исследования, выполненного М.Ф. Осипенко и соавт. [17]. Проведен анализ стоимости схем эрадикационной терапии, отличающихся только по ИПП (применяли рабепразол 40 мг/сут и генерический омепразол 40 мг/сут). Бóльшая стоимость схемы терапии первой линии с рабепразолом проспективно нивелировалась ввиду большей ее эффективности, поэтому итоговый уровень затрат при применении генерического омепразола оказался выше, чем при использовании оригинального рабепразола (Париета). Это еще раз доказывает известный факт – использование более эффективных препаратов, несмотря на их кажущуюся высокую стоимость, в итоге оказывается экономически оправданным.
Аналогичные результаты были представлены С.А. Афендуловым и соавт. [18]. Проведенные авторами анализ динамики клинико-инструментальных показателей и стоимости лечения язвенной болезни, анализ минимизации затрат и анализ «затраты–эффективность» с определением приращения эффективности затрат при лечении различными антисекреторными препаратами показали, что при лечении рабепразолом отмечено 100 %-ное рубцевание язв в течение 3 недель, в то время как в остальных группах этот показатель варьировался в пределах 65,2–84,6 %. Данный факт, a также бóльшая клиническая эффективность оригинального рабепразола (более быстрое и выраженное купирование болевого абдоминального синдрома и симптомов диспепсии) определили и результаты фармакоэкономического анализа. Анализ стоимости болезни показал, что применение рабепразола характеризуется относительно небольшими затратами – 7764,75 руб., в то время как для омепразола эта сумма составила 10 361,40 руб. При анализе минимизации затрат на лечение установлено, что доля сэкономленных средств при лечении рабепразолом от общей стоимости болезни составляет 12 %, что значительно больше, чем собственно затраты на лечение этим препаратом.
С современных позиций, безусловно, актуальны фармакоэкономический анализ эффективности применения оригинальных препаратов и их сопоставимость с генерическими средствами, а также фармакоэкономические вопросы лечения кислотозависимых заболеваний, ассоциированных с инфекцией Helicobacter pylori.
Как известно, не всегда генерический препарат (ГП) обладает должной биологической, фармацевтической и терапевтической эквивалентностью с оригинальным препаратом в силу использования различного качества субстанций и вспомогательных веществ, а также малой доступностью ряда стран-производителей для контроля в сфере фармацевтической продукции. В связи с этим в настоящее время практикующий врач нередко сталкивается с проблемой недостаточной эффективности ГП [19]. Характерной иллюстрацией подобного тренда является ретроспективное исследование S. Cammarota и соавт. (2012) [20] в Неаполе (Италия), в котором оценивались частота и причины замены оригинального ИПП на ГП, а также потенциальная фармакоэкономическая выгода от этого субститута. Результаты данной работы продемонстрировали, что замена ИПП на ГП повлекла за собой достоверный рост расходов (как прямых, так и косвенных) на лечение в среднем на 61,14 евро в год на человека [20].
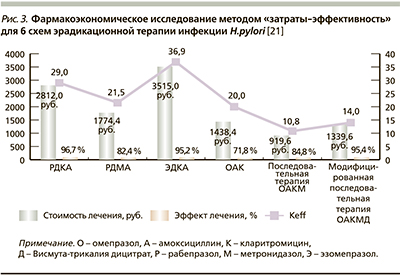
В контексте лечения кислотозависимых заболеваний отдельно стоит тема патологий, ассоциированных с инфекцией Helicobacter pylori. В связи с этим необходимо упомянуть последнюю работу А.А. Самсонова и соавт. (2014) [21], в рамках которой проводилась оценка фармакоэкономических показателей лечения пациентов с H. pylori-ассоциированными заболеваниями при применении 6 схем эрадикационной терапии и различных ИПП (омепразол, эзомепразол, оригинальный рабепразол). В исследование включили 231 (ITT – intention-to-treat) и 229 (PP – per protocol) больных: 106 пациентов с язвенной болезнью луковицы двенадцатиперстной кишки, 2 – с язвенной болезнью желудка, 90 – с эрозивным гастритом и 31 пациент – с неатрофическим гастритом. Все больные, получавшие различные схемы антихеликобактерной терапии, проходили лечение в амбулаторных условиях без отрыва от работы. Расчет стоимости лечения проводился только с учетом прямых затрат на медикаментозное обеспечение. При расчете прямых затрат на лечение учитывали стоимость лекарственных средств, поскольку очевидно, что в условиях российского здравоохранения именно разница в цене лекарств обусловливает различия в общей стоимости лечения. Рассматривая все схемы, применяемые в данном исследовании, хотелось бы отметить, что наиболее эффективной с наименьшим коэффициентом затратной эффективности (Кeff) оказалась четырехкомпонентная схема с оригинальным рабепразолом (Париет) (рабепразол + висмута трикалия длицитрат + кларитромицин + амоксициллин), где Keff составил 29, а эффективность лечения – 96,7 % (рис. 3) [21].
Заключение
Резюмируя вышеизложенное, можно сделать следующее заключение: экономический аспект лечения приобретает особое значение в условиях постоянного роста стоимости медицинской и фармацевтической помощи, поэтому врачу и больному важно знать диапазон вероятных затрат на лечение заболевания, включая лекарственную терапию. Не менее важным аспектом изучаемой проблемы являются оправданность этих затрат и их соотношение между собой – стоимость того или иного препарата, его эффективность от применения, оценка одновременно эффективности и стоимости альтернативных методов лечения. Текущие фармакоэкономические исследования кислотозависимых заболеваний свидетельствуют о положительном эффекте использования оригинального рабепразола (Париета), т.к. его применение позволяет добиваться наиболее приемлемого соотношения стоимости лечения и его эффективности.



