Введение
Острые респираторные вирусные инфекции (ОРВИ) – широко распространенные заболевания и составляют большую часть всей инфекционной патологии [1–4]. Основные возбудители заболеваний – вирусы гриппа типов А, B и С, вирус парагриппа, респираторно-синцитиальные, адено-, риновирусы и др. [3, 4]. Встречаются также микст-инфекции гриппа А и В, а также гриппа и респираторно-синцитиальной инфекции, гриппа и аденовирусных заболеваний и микст-инфекции, вызванные различными возбудителями, в т.ч. хламидиями, микоплазмами.
Каждый случай заболевания имеет некоторые отличительные черты в соответствии с тропностью тех или иных вирусов к дыхательной системе. Вирусы гриппа, респираторно-синцитиальные, аденовирусы поражают эпителий как верхних, так и нижних дыхательных путей с возможным развитием острого бронхита, бронхиолита, сопровождающихся синдромом обструкции нижних дыхательных путей. При риновирусной инфекции поражается преимущественно эпителий носовой полости, при парагриппе – гортани, а аденовирусная инфекция характеризуется возникновением конъюнктивита.
Следует отметить, что в настоящее время частота заболевания ОРВИ у беременных женщин возросла. Особой предрасположенности к инфекции со стороны беременных не существует, но респираторные заболевания инфекционной и вирусной природы у них нередко протекают тяжелее и дают больше осложнений в связи с физиологическим снижением иммунитета и воздействием вирусов.
Клиническая диагностика ОРВИ очень трудна, и на практике обычно ставится нозосиндромальный диагноз. Лабораторная диагностика остается решающей при постановке этиологического диагноза. Несмотря на высокую информативность, большинство методов идентификации вирусов не удовлетворяет клиницистов, т.к. результаты исследований можно получить спустя длительное время после взятия материала. Для лабораторного подтверждения диагноза используют экспресс-метод – реакцию иммунофлюоресценции, позволяющую определить антигены респираторных вирусов в цилиндрическом эпителии носовых ходов (в «отпечатках» со слизистой оболочки полости носа). Результативность метода существенно зависит от соблюдения методических условий получения клинических материалов, сроков и температурных условий их доставки в лабораторию, качества используемых реагентов, а также компетентности специалистов, ответственных за интерпретацию результатов [5]. В то же время в рутинной диагностике все большее распространение получают молекулярно-генетические методы выявления микроорганизмов, в частности полимеразно-цепная реакция (ПЦР). Данные методы имеют максимально доступную на сегодня чувствительность и специфичность, однако практический опыт и нормативная база, касающиеся применения ПЦР для диагностики ОРВИ, крайне ограничены.
Материал и методы
Исследование проводилось в ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» в период с сентября 2012 по май 2013 г. Всего в исследование были включены 174 взрослых пациентки, среди них 61 пациентка гинекологического профиля (1-я группа) и 113 беременных пациенток (2-я группа) с направительным диагнозом ОРВИ либо «грипп».
Критерием включения больных в исследование было наличие симптомов гриппа и ОРВИ (повышение температуры тела, симптомы интоксикации и катаральное воспаление дыхательных путей). Обследование проводилось методом ПЦР в режиме реального времени в первые двое суток от момента появления симптомов или поступления пациентки в стационар. Критерием исключения из исследования было наличие хронической обструктивной болезни легких. Всем женщинам, включенным в исследование, проводилось стандартное общеклиническое обследование: сбор анамнеза заболевания, объективный осмотр, анализ клинической картины в сопоставлении с данными лабораторно-инструментальных методов исследования (общие анализы крови и мочи, рентгенологическое исследование органов грудной полости). При наличии у пациентки признаков пневмонии по данным рентгенологического исследования органов грудной полости дополнительно назначался биохимический анализ крови (определение уровней аланин-аминотрансферазы, аспартат-аминотрансферазы, мочевины, креатинина, креатининфосфокиназы), а также анализ электролитного состава и кислотно-основного состояния крови.
Всем больным было проведено клинико-лабораторное и инструментальное обследования, включившее клинический анализ крови, общий анализ мочи, определение уровней С-реактивного белка, ПЦР-диагностику, в ряде случаев – ПКТ и рентгенологическое исследование органов грудной полости.
Молекулярно-генетическое исследование во всех случаях осуществлено методом ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации с использованием коммерческих тест-систем производства «ДНК-Технология» (Россия). Для выявления генетического материала РНК-содержащих вирусов предварительно проводили реакцию обратной транскрипции (ОТ). Биоматериал для исследования получали методом соскоба эпителиальных клеток из соответствующих локусов одноразовыми стерильными зондами. Аспират из трахеи получали в объеме 500 мкл и центрифугировали в течение 10 минут при 16 тыс. g. Осадок ресуспендировали в 100 мкл. Контроль адекватности взятия материала проведен по количеству ДНК человека. Реакция амплификации осуществлена на детектируюшем амплификаторе ДТ-96 «ДНК-Технология» (Россия).
Результаты исследований
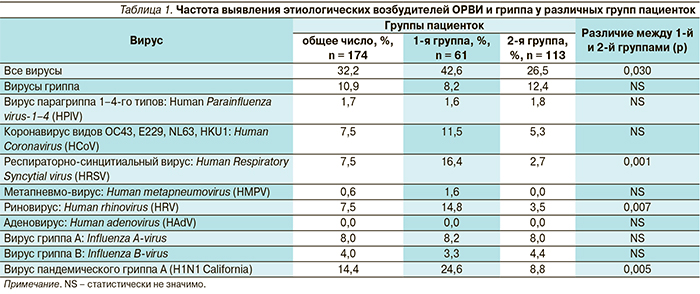
Средний возраст женщин составил 31,5 ± 1,6 года (от 16 до 57 лет). Среди всех пациенток, обследованных с направительным диагнозом ОРВИ либо «грипп», доля положительных результатов ОТ-ПЦР-исследования составила 32,2 %, среди которых в отношении 10,9 % (19 из 174) методом ОТ-ПЦР был выявлен генетический материал вируса гриппа: вирус гриппа А – Influenza A virus – у 7,5 % (13 пациенток), а также вирус гриппа B – Influenza B virus – у 4,0 % (7 пациенток). При этом среди беременных женщин, обследованных с направительным диагнозом ОРВИ либо «грипп», доля положительных результатов ОТ-ПЦР-исследования была ниже, чем у небеременных, и составила 26,5 % по сравнению с 42,6 % (p = 0,03) (табл. 1).
Среди остальных типов вируса также встречался респираторно-синцитиальный Нuman Respiratory Syncytial virus (HRSV) и риновирус Нuman Rhinovirus (HRV) как в первой, так и во второй группе пациенток. Аденовирус не был выявлен ни в одном случае.
Все женщины были обследованы по клиническим показаниям, среди которых основное значение имела степень выраженности катарального и интоксикационного синдромов. Клиника ОРВИ у беременных в 85,3 % случаев характеризовалась средним и среднетяжелым течением. В 52 % случаев больные были обследованы на 1–2-й день, в 31,6 % случаев – на 3–5-й, в 16,4 % – на 6-й и более дней болезни, когда уже наблюдались осложнения и обострения других хронических заболеваний.
В большинстве случаев заболевание начиналось остро с повышения температуры тела, которое было зарегистрировано у всех пациенток, при этом в 30,1 % случаев температура тела повышалась до 38,0 °С и выше. Длительность лихорадки составила от 1–2 до 3–4 дней. При этом температурная реакция была наиболее выраженной в I и II триместрах гестации. Симптомы интоксикации проявлялись также в виде слабости, недомогания, отмеченных у всех больных, выраженной головной боли в 34,1 % случаев. Катаральный синдром проявлялся в виде сухого кашля на 1–2-й день заболевания у 34,1 % женщин, першение, боли в горле при глотании наблюдались у 64,6 % беременных независимо от периода гестации.
Анализ данных распределения этиологических причин возникновения ОРВИ в обеих группах свидетельствует, что, хотя частота выявления респираторных вирусов у беременных женщин была ниже, чем у небеременных в тот же временной интервал (42,6 % в 1-й группе и 26,5 % во 2-й соответственно), доля респираторных инфекций, вызванных вирусами гриппа, характеризующихся более тяжелым течением и осложнениями, была выше в группе беременных женщин и составила 8,2 % в 1-й группе и 12,4 % во 2-й соответственно. Достоверных различий по частоте выявления других вирусов между двумя группами обнаружено не было, хотя отмечена более низкая встречаемость респираторно-синцитиального вируса: HRSV, и риновируса: HRV, в группе беременных пациенток по сравнению с небеременными.
Анализируя данные общеклинического исследования крови беременных пациенток, следует отметить, что в начале заболевания не отмечалось выраженного лейкоцитоза с палочкоядерным сдвигом у 98 из 113 (86,5 %) женщин, в то же время к 10-му дню от начала заболевания у 22,5 % имели место количественные и качественные изменения состава лейкограммы на фоне возникновения осложнений вирусного заболевания. Аналогичная динамика наблюдалась и в отношении СОЭ. Существенного изменения уровня эритроцитов, гемоглобина, цветового показателя крови в процессе заболевания у наблюдаемых больных отмечено не было.
Частота основных осложнений у пациенток с лабораторно подтвержденной ОРВИ представлена в табл. 2.
Угроза прерывания беременности наблюдалась у 15 больных (50 %). Статистически значимых различий между беременными и небеременными пациентками выявлено не было.
При физикальном обследовании пациенток отмечено улучшение аускультативной картины дыхания. Так, если при поступлении 17 (56,7 %) больных аускультативно имели влажные хрипы, то к 5-у дню лечения они сохранялись только у 5 (16,7 %), а к 16–20-му дню у 23 (76,7 %) пациенток полностью отсутствовали какие-либо патологические звуки при аускультации. В процессе лечения у 20 (66,7 %) больных в течение 3–5 дней уменьшилась интенсивность кашля.
Обсуждение
Риск заболевания и смертности для беременных при гриппе выше, чем для небеременных женщин, что в первую очередь связано с развитием осложнений, а именно пневмоний, регистрируемых в период эпидемий [2–4, 6]. При этом следует отметить лидирующее место ОРВИ в структуре экстрагенитальной патологии при беременности (более 2/3 от общей заболеваемости острыми инфекциями), что обусловлено высокой восприимчивостью беременных к вирусным инфекциям, склонностью к хронизации патологических процессов. Для беременных характерно затяжное течение ОРВИ в отсутствие тяжелых клинических проявлений, это, возможно, связано с повышенной способностью вирусов респираторной группы к репликации в плаценте [8], а также особенностями иммунной системы беременной женщины. Так, повышение уровня прогестерона, хорионического β-гонадотропина, α-фетопротеина приводит к снижению Т-клеточного иммунитета: уменьшается количество Т-хелперов и активность натуральных киллеров, как следствие – возрастает восприимчивость организма беременной женщины к вирусным и грибковым инфекциям.

В группе ОРВИ при беременности наибольшую угрозу несут вирусы гриппа: вирус гриппа А – Influenza A-virus, вирус пандемического гриппа А (H1N1), а также вирус гриппа B – Influenza B-virus. При зарегистрированных ранее эпидемиях и пандемиях гриппа среди беременных отмечена более высокая заболеваемость и смертность по сравнению с остальной популяцией женского населения [9, 10].
С учетом особенностей отбора пациенток (направительный диагноз ОРВИ либо «грипп») нельзя сделать однозначный вывод о распространенности того или иного вируса в популяции в период эпидемии. Тем не менее полученные данные свидетельствуют: предварительный диагноз, предполагающий вирусную природу заболевания, статистически значимо чаще подтверждается у небеременных пациенток. По-видимому, это служит отражением стертого клинического течения респираторной инфекции у беременных. Этиотропная терапия оказывает эффект в ранние сроки от момента начала заболевания, что обусловливает необходимость надежной лабораторной диагностики. Проведенное нами исследование подтвердило низкую точность клинической диагностики при респираторной инфекции, что особенно важно для беременных пациенток, если учитывать ограничения при назначении соответствующих этиотропных препаратов. В данном исследовании не проводилось идентификации бактериальных патогенов. Однако в свете того, что вирусная природа заболевания была подтверждена менее, чем в половине случаев, данное направление диагностики представляется актуальным.
При этом беременные женщины на основании проведенного анализа относятся к группе повышенного риска в отношении развития осложнений во время пандемии гриппа и чаще нуждаются в госпитализации.
Группы риска тяжелого и осложненного течения гриппа:
- Беременные женщины:
- женщины, у которых частота заболевания этими инфекциями произошла более трех раз в предшествующий беременности год.
- Пациенты с избыточным весом.
- Пациенты с хронической обструктивной болезнью легких и бронхиальной астмой.
- Пациенты с кахексиями.
- Пациенты с субкомпенсированным и декомпенсированным сахарным диабетом.
- Пациенты с хронической сердечно-сосудистой патологией (за исключением изолированной артериальной гипертензии).
- Пациенты с иммунодефицитными состояниями (врожденные иммунодефициты, ВИЧ-инфекция в стадии СПИДа).
- Дети в возрасте до двух лет.
Одно из обоснований необходимости стационарного лечения гриппа при беременности – высокая материнская смертность: более 10 %, отмеченная другими авторами в ходе исследований, проведенных ранее [9, 10]. Во время сезонных эпидемий гриппа беременные в большей степени предрасположены к формированию осложнений, причем риск их развития увеличивается пропорционально возрастанию срока гестации и наличию хронических заболеваний.
К особенностям клинического течения пандемического гриппа А (Н1N1) относятся:
- более частое развитие вирусной пневмонии с появлением дыхательной недостаточности (в среднем на 5–6-й день от момента возникновения первых клинических симптомов заболевания);
- развитие вирусной пневмонии у пациентов с избыточной массой тела (индекс массы тела – 30 и более);
- быстрое развитие острого респираторного дистресс-синдрома, которому предшествует выраженная одышка и упорный, плохо поддающийся лечению кашель, а также кровохарканье;
- при лабораторном исследовании в общем анализе крови чаще преобладает лейкопения;
- в некоторых случаях – развитие полиорганной недостаточности;
- изменения при рентгенографическом исследовании легких появляются позже развития клинических признаков пневмонии (они зачастую интерпретируются как «застой в малом круге», «усиление сосудистого рисунка», «пневмосклероз»);
- развитие тяжелых форм заболевания у пациентов молодого и среднего возраста.
В настоящее время существуют различные противовирусные препараты лечения гриппа. Наиболее часто используемые средства этиотропной терапии гриппа: ремантадин, осельтамивир (Тамифлю), занамивир (Реленза), Арбидол, Ингавирин, рекомбинантные интерфероны. Противовирусные лекарственные средства служат основой этиотропной терапии гриппа, особенно на ранних этапах развития заболевания и его осложнений. Однако в случае развития вирусной пневмонии при гриппе эффективность данных препаратов существенно ограничена, поскольку они имеют точку приложения при условии максимально раннего его назначения (в первые 24–48 часов от начала клинических проявлений). От этого напрямую зависят эффективность терапии и прогноз при гриппе А (H1N1). Озельтамивир (Тамифлю) принимается 2 раза в сутки начиная с первого дня заболевания. Курс лечения – 5 суток. Однако в тяжелых случаях взрослым зачастую требуется более высокая доза – 150 мг 2 раза в сутки, и длительный курс – 7–10 дней. Увеличение дозы и продолжительности терапии особенно оправданно для лиц, находящихся в отделениях интенсивной терапии и реанимации, получающих респираторную поддержку, а также для пациенток с массой тела свыше 110 кг [7].
Однако не следует забывать и о неминуемых токсических проявлениях противовирусной терапии и недоказанной безопасности ее для беременных. Именно поэтому необходимость точной и своевременной диагностики гриппа не вызывает сомнений. Дальнейшее совершенствование самого метода и разработка обновленных диагностических панелей, а также совершенствование нормативно-правовой базы помогут в будущем успешно решать вопросы ранней диагностики вирусной патологии в эпидемический период среди различных категорий пациентов.
Выводы
Острые респираторные инфекции у беременных чаще регистрируются в 3-м триместре и имеют менее выраженные симптомы интоксикации, чем на ранних сроках беременности. Развитие осложнений в основном связано с поздней обращаемостью. Лабораторное подтверждение вирусной этиологии заболевания удается получить значительно реже, чем вне беременности, и только у 26 % беременных с клиническими признаками респираторных инфекций, что свидетельствует о преобладании микробных/бактериальных форм. Вместе с тем опыт применения ОТ-ПЦР в диагностике респираторных вирусных патогенов демонстрирует большие возможности и перспективы использования данного метода в отношении больных различных категорий, в т.ч. у беременных женщин в эпидемический период. Несомненным преимуществом данного метода по сравнению с применявшимся ранее традиционным иммуноферментным анализом является его высокая скорость выполнения и информативность полученных результатов, которые вкупе позволяют клиницистам максимально рано начинать проведение не эмпирической, а напротив, этиопатогенетической терапии, направленной на борьбу с возбудителем. В большинстве случаев использование ПЦР позволило назначить наиболее эффективную противовирусную терапию в первые 24–48 часов с момента дебюта заболевания, которая позволяет существенно сокращать продолжительность лихорадки и других клинических симптомов заболевания.



