Актуальность проблемы
Социальная значимость любого заболевания определяется его распространенностью, трудностями диагностики и терапии, значимым влиянием на показатели инвалидности и смертности населения. По этим критериям болезни, обусловленные или сопровождающиеся нарушениями фосфорно-кальциевого обмена, абсолютно соответствуют статусу социально значимых. В практике эндокринолога заболевания, сопровождающиеся нарушением метаболизма кальция, занимают значительное место. Выраженные нарушения минерального обмена наблюдаются при сахарном диабете, патологии щитовидной железы и надпочечников, гипер- и гипопаратиреозе, пери- и постменопаузе, возрастном андрогенодефиците. Клинические проявления нарушений обмена кальция и фосфора достаточно разнообразны, но наиболее хорошо известны проявления, связанные с поражением костной ткани, включая остеопороз.
Как причина инвалидности и смертности пациентов от переломов костей остеопороз занимает четвертое место среди неинфекционных заболеваний [1]. По данным статистики, только 25 % больных полностью излечиваются после перелома шейки бедра, 50 % больных остаются инвалидами, в 25 % случаев перелом при остеопорозе ведет к смерти больных. В России остеопороз выявлен у 10 % населения (более 14 млн человек) [3, 4]. Ежегодно фиксируют 3 млн переломов позвонков, более 150 тыс. – лучевой кости и более 40 тыс. – проксимального отдела бедренной кости.
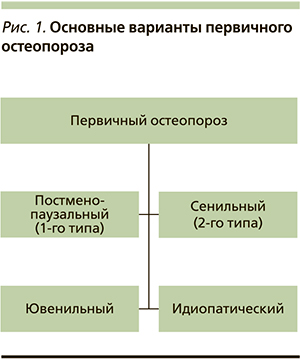
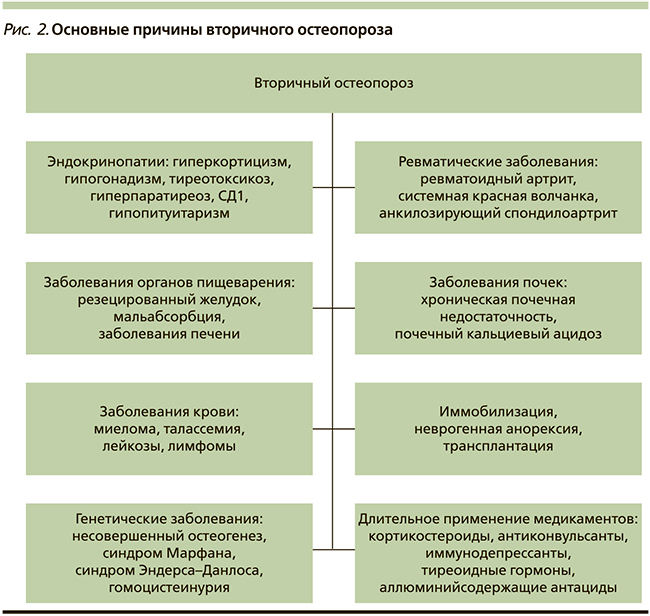
В медицинской литературе остеопороз иногда образно называют «тихой эпидемией». Длительное время заболевание протекает бессимптомно и впервые диагностируется после возникновения перелома. Термин «остеопороз» как название патологического процесса обычно употребляют, когда речь идет о первичном остеопорозе (рис. 1). С патологией эндокринной системы, как правило, связывают проявления вторичного остеопороза, который наблюдается у пациентов на фоне усиленной секреции паратгормона (ПТГ), обусловленной вторичными причинами, в т.ч. эндокринными заболеваниями (рис. 2). Из группы заболеваний, обозначенных как первичный остеопороз, в сферу деятельности эндокринологов входит остеопороз, обусловленный постменопаузой, и, как нам представляется, с полным основанием может быть отнесен остеопороз, обусловленный андрогенодефицитом.
Состояние фосфорно-кальциевого обмена в норме и патологии
 Уровень кальция в организме человека – одна из наиболее значимых констант. Достоверное тому доказательство – минимальный разброс значений приводимых показателей. Лабораторные критерии нормы содержания общего кальция в сыворотке крови составляют 2,1–2,6 ммоль/л; ионизированного – 1,1–1,3; белково-связанного – 0,9–1,1; комплексированного – 1,18 ммоль/л. В крови кальций представлен тремя формами. Около 40 % его находится в виде связанных с белком соединений, почти половину составляет свободный (в т.ч. ионизированный) кальций, 10 % – это комплексы с цитратами и фосфатами.
Уровень кальция в организме человека – одна из наиболее значимых констант. Достоверное тому доказательство – минимальный разброс значений приводимых показателей. Лабораторные критерии нормы содержания общего кальция в сыворотке крови составляют 2,1–2,6 ммоль/л; ионизированного – 1,1–1,3; белково-связанного – 0,9–1,1; комплексированного – 1,18 ммоль/л. В крови кальций представлен тремя формами. Около 40 % его находится в виде связанных с белком соединений, почти половину составляет свободный (в т.ч. ионизированный) кальций, 10 % – это комплексы с цитратами и фосфатами.
Как правило, внеклеточный кальций регулирует сократительную активность мышц, синаптическую передачу сигнала в нервной ткани, агрегацию тромбоцитов и эритроцитов, процесс коагуляции, секрецию гормонов и биологически активных соединений. Внутриклеточный кальций регулирует процессы клеточного цикла и роста, проницаемость клеточных мембран, силу мышечных сокращений, а также секрецию гормонов и биологически активных факторов.
Кальций – важный компонент регуляции функционирования сердечно-сосудистой системы (сократительная функция, сохранение нормального ритма и проводимости, контроль артериального давления), обладает антиоксидантными, противовоспалительными, противоотечными и антиатеросклеротическими эффектами.
Обмен кальция и фосфора в здоровом организме находится в динамическом равновесии, компенсаторные механизмы регулируют его при гипер- или гипокальциемических состояниях.
Реализация этого контроля обеспечивается адекватным уровнем ПТГ, кальцитонина, витамина D и других гормонов:
- ПТГ: регулирует резорбцию кости опосредованно через остеокласты;
- кальцитонин: ингибирует резорбцию кости, действуя непосредственно на остеокласты;
- инсулин: стимулирует синтез матрикса и формирование хряща, нормализует минерализацию;
- соматотропный гормон: поддерживает общую костную массу, регулируя синтез инсулиноподобного фактора роста 1-го типа (ИФР-1), стимулирует синтез 1,25–дигидроксин витамина D;
- витамин D отвечает за минерализацию костей, стимулирует синтез остеокальцина остеобластами и увеличивает концентрацию ИФР-связывающих белков;
- глюкокортикоиды: стимулируют резорбцию кости, снижая всасывание кальция в кишечнике (снижение секреции ПТГ);
- гормоны щитовидной железы: стимулируют резорбцию кости;
- эстрогены: подавляя продукцию интерлейкинов (ИЛ-1, -6), уменьшают резорбцию кости, поддерживают массу кости за счет регулирования активности гена ТФР-β;
- андрогены: оказывают анаболическое действие на костную ткань.
В основе жизнедеятельности костной системы лежат два взаимосвязанных процесса: созидания (формирования) новой кости и процесс разрушения (резорбции) старой кости. Эти процессы в костной системе осуществляются с разной скоростью в течение всей жизни человека. Ежегодно обмениваются от 1–2 до 10 % костной массы. Последняя достигает своего максимального значения к возрасту 16–20 лет, поэтому детский и подростковый возраст является ответственными периодами для формирования прочного здорового скелета. По достижении пика наступает баланс процессов синтеза и резорбции, который продолжается до 40–45 лет у женщин и 50 лет у мужчин. Затем начинается потеря костной массы, более значительная у женщин после менопаузы [3, 4].
К числу факторов, влияющих на формирование и прочность костей, относятся:
- генетические;
- фактор роста;
- факторы питания;
- физическая активность;
- средовые факторы.
Кость здорового человека – живая активная ткань. Она прочна, способна противостоять значительной нагрузке без перелома, но при этом гибка, способна поглощать энергию, деформироваться и не ломаться. Такие противоречивые свойства кости достигаются за счет особого состава и строения (вплетение коллагена 1-го типа в тройную спираль). При нарушениях фосфорно-кальциевого обмена ситуация меняется. Влияние нагрузки на кость с недостаточной минерализацией приво-дит к тому, что кость сгибается чрез-мерно и ломается, однако, если происходит нагрузка на кость с избыточной минерализацией, она недостаточно сгибается и также подвергается перелому.
Гиперкальциемия, сопровождающаяся избыточной продукцией ПТГ, наблюдается при первичном, вторичном гиперпаратиреозе, множественной эндокринной неоплазии, псевдогиперпаратиреозе (эктопическая продукция ПТГ) и семейном изолированном гиперпаратиреозе. Синдром гиперкальциемии может развиваться на фоне других эндокринопатий – тиреотоксикоз, гипотиреоз, эозинофильная аденома гипофиза (акромегалия), гиперкортицизм, феохромоцитома, ВИПомы. Кроме эндокринных заболеваний причинами гиперкальциемии и объектами для дифференциальной диагностики являются передозировка витамина D, злокачественные опухоли, острая и хроническая почечная недостаточность, иммобилизация после переломов костей, некоторые медикаменты. Избыточное потребление кальция (более 2 г/сут) также может приводить к развитию гиперпаратиреоза.
Гипокальциемия – состояние, связанное с первичной или вторичной недостаточностью продукции ПТГ, недостатком витамина D и резистентностью к ПТГ (псевдогипопаратиреоз). Основные причины: аутоиммунный процесс в паращитовидных железах, послеоперационный или радиойодный гипопаратиреоз, сахарный диабет.
Нарушение функции паращитовидных желез может проявляться как компонент различных генетических синдромов (синдром Ди Джорджа, болезнь Вильсона, гемохроматоз и др.) и аутоиммунного полигландулярного синдрома I типа (гипопаратиреоз, хронический генерализованный гранулематозный кандидоз и хроническая надпочечниковая недостаточность). Недостаточностью кальция сопровождаются эндокринные расстройства, связанные с возрастными изменениями половой системы, – андрогенодефицит у мужчин и постменопаузальные процессы у женщин.
Помимо эндокринных нарушений дефицитом кальция могут сопровождаться заболевания желудочно-кишечного тракта, почек, гиповитаминоз D, повышение уровня магния в сыворотке крови, применение лекарственных средств (гормональные, слабительные, антациды, мочегонные, адсорбенты, противосудорожные средства, тетрациклин).
К числу факторов, способствующих возникновению дефицита кальция в организме, можно отнести малоподвижный образ жизни, употребление массы белков, сахара, соли, животных жиров, продуктов с кислой реакцией (шпинат, ревень и др.) [5].
Дисбаланс фосфорно-кальциевого обмена способствует прогрессированию атеросклероза, развитию артрозов и дорсопатии, артериальной гипертонии, но основным проявлением остается остеопороз, приводящий к значительному повышению риска переломов костей [6, 7].
Первичный гиперпаратиреоз
Наиболее частая причина гиперкальциемии и гипофосфатемии. Заболевание было неоднократно представлено с 1981 г. в научной медицинской литературе под различными названиями: болезнь Реклингаузена, синдром Бернета, фиброзная остеодистрофия, первичный гиперпаратиреоз. Распространенность заболевания составляет 0,05–0,10 % населения и у женщин наблюдается примерно в 4 раза чаще, чем у мужчин.
В 80–89 % случаев причиной заболевания является солитарная аденома паращитовидной железы, значительно реже встречаются множественная аденома (2–3 %), гиперплазия паращитовидных желез (2–6 %) и рак (0,5–3,0 %).
Первичный гиперпаратиреоз наблюдается у 90 % больных множественной эндокринной неоплазией I типа (МЭН I) и у 50 % пациентов с МЭН IIa-типа. Избыточная продукция ПТГ и отсутствие подавления секреции в ответ на гиперкальциемию приводят к ускорению резорбции костной ткани и вымыванию кальция из костей, снижению порога реабсорбции фосфора. Увеличивается клубочковая фильтрация кальция и экскреция фосфора с мочой. Гиперкальциемия поддерживается увеличением канальцевой реабсорбции кальция и повышенным всасыванием кальция в кишечнике. Симтоматика заболевания достаточно разнообразна. Пациенты предъявляют жалобы на общую слабость, потерю аппетита, тошноту, рвоту, запоры, похудание, боли в костях, артралгии, деформацию костей, мышечную слабость, судороги, полиурию, полидипсию, ухудшение памяти, депрессию, кальцинаты мягких тканей и роговой оболочки, отеки на лице, нарушения функции сердечно-сосудистой системы. Преобладание тех или иных симптомов позволяет условно относить проявления патологии конкретного пациента к костной, висцеральной или почечной формам гиперпаратиреоза. Наименее сложной для диагностики формой является «костная», при которой возможны варианты поражения по типу системного остеопороза, кистозно-фиброзного остеита или болезни Педжета. Рентгенологическое обследование позволяет фиксировать типичные изменения костей в виде остеопороза, патологических переломов, субпериостальной резорбции костей, кистозных образований в области эпифизов, деформации скелета. Гиперпаратиреоз встречается достаточно часто, но, к сожалению, диагностика этого заболевания представляется довольно непростой.
Вторичный гиперпаратиреоз
Состояние, связанное с увеличением продукции ПТГ в ответ на длительную гипокальциемию. У больных тиреотоксикозом усиление процессов катаболизма приводит к повышенной резорбции костной ткани, т.к. тиреоидные гормоны активируют преимущественно остеокласты. Преобладание резорбции кости над ее образованием может приводить к гиперкальциемии и кальцийурии, а при длительном некомпенсированном гипертиреозе ожидаемым осложнением можно считать развитие остеопении, особенно у пациентов молодого возраста.
Возникновение остеопороза на фоне гипотиреоза возможно, но связано это с гормональной заместительной терапией (передозировкой тиреоидных препаратов). Для больных гиперкортицизмом, как первичным, так и ятрогенным, избыток продукции глюкокортикоидов сопровождается подавлением активности остеобластов и угнетением всасывания кальция в кишечнике. Гипокальциемия приводит к увеличению выработки ПТГ, развитию вторичного гиперпаратиреоза и активации остеокластов.
Снижение инсулиновой секреции у больных сахарным диабетом типа I сопровождается снижением активности остеобластов и подавлением секреции 1,25(OH)2D3 в почках. На потерю костной массы также влияет усиление секреции глюкокортикоидов в ответ на гипогликемию и снижение физической активности.
Первичный гипопаратиреоз
Недостаточность секреции ПТГ околощитовидными железами, снижение резорбции кальция в канальцах почек, уменьшение абсорбции кальция в кишечнике, приводящее к гипокальциемии. Основные причины – оперативные вмешательства на щитовидной и паращитовидных железах, лечение радиоактивным йодом, нарушения развития паращитовидных желез (врожденная гипоплазия, синдром Ди Джорджи и др.), аутоиммунные процессы и идиопатический гипопаратиреоз. Заболевание может протекать в острой и хронической формах. К числу ведущих синдромов относятся тетания и вегетативная дисфункция. Подтверждение диагноза предусматривает проведение провокационных проб: Труссо, Хвостека, Шлезингера, Вайса.
Постменопаузальный остеопороз
Постменопаузальный остеопороз встречается в клинической практике наиболее часто, отличается быстрым развитием. У женщин в постменопаузе происходит снижение костной массы на 15–20 % в течение 5–10 лет. Основная причина – дефицит эстрогенов, который приводит к повышению числа и активности остеокластов. Повышенная резорбция ведет к необратимой потере кости. Высокая активность остеокластов способствует перфорации трабекул в месте резорбции, нарушается микроархитектоника кости. Страдает в первую очередь трабекулярная кость, поэтому локализация ранних остеопоретических переломов – это кости запястья и позвонки.
Множественная эндокринная неоплазия
Под этим названием объединяют группу синдромов, вызванных опухолями (редко гиперплазией) одновременно нескольких эндокринных желез. Большинство опухолей имеют нейроэктодермальное происхождение и злокачественное течение. В середине XX в. P. Wermer описал синдром, который включал сочетание опухоли паращитовидных желез, гипофоза и поджелудочной железы, и назвал его множественным эндокринным аденоматозом (сейчас – МЭН I). Немного позже J.H. Sipple описал синдром сочетанного проявления симптомов рака щитовидной железы и феохромоцитомы (МЭН IIа). Среди 50 % этих пациентов наблюдаются аденома паращитовидной железы и гиперпаратиреоз. Трудности диагностики связаны с тем, что симптомы поражения разных эндокринных органов проявляются не одновременно. Иногда заболевание начинается с гиперпаратиреоза с характерной клинической симтоматикой, а симптомы поражения других эндокринных желез манифестируют значительно позже, поэтому для установления окончательного диагноза требуется гораздо больше времени.
Проблемы диагностики нарушений фосфорно-кальциевого обмена
Проблема диагностики нарушений фосфорно-кальциевого обмена связана с особенностями заболевания. Отсутствие ярко-выраженных клинических проявлений на начальных этапах заболевания приводит к тому, что визит к эндокринологу оказывается далеко не на первых позициях в диагностической цепочке. Поэтому диагноз нарушений фосфорно-кальциевого обмена эндокринной природы выставляется достаточно поздно. Как правило, первым сигналом к началу обследования пациента становится возникновение патологического перелома. Проведение денситометрии не всегда сразу позволяет получать однозначный ответ. Среди женщин в возрасте 50 лет и старше 50 % имеют переломы, но не страдают остеопорозом, по данным биоэнергетической рентгеновской абсорбициометрии (Wainwright S.A. et al., 2005). В популяции женщин в возрасте 50 лет и старше 96 % переломов типичной локализации могут возникать без снижения минеральной плотности кости (МПК) (Kanis J.A. et al., 2001).
И все же некоторые симптомы у остеопороза присутствуют. К ним относятся боли в спине и пояснице, искривление позвоночника вперед, уменьшение роста на несколько сантиметров в течение года, судороги в ногах, хрупкость ногтей, появление ранней седины. Обычно появление этих симптомов приводит пациентов не к эндокринологу, а к неврологу и терапевту. Остеопороз следует подозревать, если рост снизился более чем на 2 см за год или на 4 см за несколько лет.
Традиционный подход к диагностике остеопороза основан на оценке риска возникновения перелома. Факторы риска остеопороза и переломов принято делить на большие и малые.
Большие факторы риска:
- возраст старше 65 лет;
- предшествующие переломы в анамнезе (при повседневной двигательной активности лиц старше 40 лет);
- компрессионные переломы позвонков;
- семейный анамнез по остеопоретическим переломам;
- длительный прием глюкокортикоидов (более 3 месяцев);
- женский пол;
- низкая МПК;
- дефицит эстрогенов: ранняя менопауза (до 40–45), хирургическая менопауза (до 40–45 лет);
- первичный гиперпаратиреоидизм;
- предрасположенность к падениям (мышечная слабость, снижение остроты зрения, снижение проприоцептивной чувствительности, прием бензодиазепинов);
- синдром мальабсорбции;
- длительная иммобилизация;
- остеопения;
- гипогонадизм.
Малые факторы риска:
- ревматоидный артрит, сахарный диабет;
- клинический гиперпаратиреоидизм в анамнезе;
- постоянная противосудорожная терапия;
- недостаточное потребление кальция;
- дефицит витамина D;
- длительная иммобилизация;
- курение (снижение выработки эстрогенов);
- злоупотребление алкоголем (ингибирует остеобласты, подавляет резорбцию кости, нарушает метаболизм витамина D, усиливает возрастной андрогенодефицит);
- индекс массы тела < 20 кг/м2, вес < 57 кг;
- потеря веса более чем на 10 % в возрасте 25 лет;
- злоупотребление кофеином;
- длительная гепаринотерапия.
Остеопоротический (перелом при минимальной травме) определяется как перелом, произошедший спонтанно или при падении с высоты не выше собственного росте, включая переломы, развившиеся при таких действиях, как кашель, чихание или резкое движение (например, при открытии форточки). А также в ситуации, когда у пациента на рентгенограмме выявлен компрессионный перелом позвонка независимо от того, выявляются симптомы компрессии или нет.
Лабораторная диагностика предусматривает определение в крови уровня кальция, фосфора, других микроэлементов, биохимических маркеров образования кости (щелочная фосфатаза, остеокальцин, PINP N (терминальный пропептид проколлагена 1-го типа) и маркеров костной резорбции. Маркеры костной резорбции (beta-cross Laps) указывают на ускорение костного обмена, снижение МПК и возникновение переломов. Сочетание высокого уровня показателей костных маркеров резорбции (например, продукты деградации коллагена I типа — N-телопептид [NTX] в моче или С-телопептид в сыворотке крови) с низким уровнем МПК на денситометрии или предшествующими переломами свидетельствует об увеличении риска возникновения новых переломов. Повторные исследования МПК на фоне терапии обычно проводятся с интервалом 1–2 года. Лечение считается эффективным, если в течение года по показателю МПК не наблюдается отрицательной динамики.
Определение уровня ПТГ, остеокальцина – обязательный компонент обследования при любых формах остеопороза. В диагностике нарушений фосфорно-кальциевого обмена гистоморфометрия применяются и методы рентгенологического обследования денситометрии, и стандартная рентгенография.
Каждого взрослого пациента, перенесшего при минимальной травме перелом позвонка, проксимального отдела бедра или лучевой кости, необходимо рассматривать как имеющего высокий риск развития переломов и как кандидата на лечение остеопороза (даже если значения МПК не соответствуют критериям диагноза остеопороза). Женщины в возрасте старше 70 лет с предшествующим переломом становятся кандидатами на лечение остеопороза без проведения денситометрии.
Выбор тактики терапии при различных вариантах нарушения фосфорно-кальциевого обмена
Основная цель лечения больных заболеваниями, сопровождающимися гиперкальциемией, помимо этиопатогенетического лечения основного заболевания – снижение вымывания кальция из костей или усиление поступления кальция в кость.
В лечении первичного гиперпаратиреоза основным и наиболее радикальным методом служит аденомэктомия паращитовидной железы. Однако не во всех случаях эту операцию можно проводить достаточно быстро или радикально. В случаях отказа пациента от операции, при наличии абсолютных или относительных противопоказаний, безуспешной операции следует назначать медикаментозное лечение. Применяют синтетические фосфатсвязывающие препараты короткими курсами (2–4 недели), что позволяет устранять гиперкальциемию и предотвращать образование камней в почках.
От женщин в постменопаузе получены положительные результаты применения эстроген-гестагенных препаратов. Хороший эффект обеспечивает применение активных метаболитов витамина D и бисфосфонатов, значение которых возрастает при наличии противопоказаний к проведению заместительной гормонотерапии. Применение бисфосфонатов в стандартных дозах позволяет нормализовывать уровень кальция 80 % пациентов. Лечение остеопороза у пациентов с возрастным андрогенодефицитом предусматривает назначение заместительной терапии препаратами тестостерона.
Лечение вторичного гиперпаратиреоза определяется основной патологией, вызвавшей его формирование, и этапом оказания медицинской помощи. В терапии вторичного остеопороза применяются кальцитриол, препараты кальция и бисфосфонаты. Паратиреоидэктомия может быть методом выбора и при лечении вторичного гиперпаратиреоза. Абсолютным показанием считаются возникновение фиброзного остеита, безуспешность консервативной терапии, персистирующая гиперкальциемия с повышенным значением ПТГ, диссименирующий кожный некроз, кальцификаты мягких тканей.
Лечение гипопаратиреоза предусматривает диету, богатую кальцием (преимущественно молочно-овощную), препараты солей кальция, заместительную терапию препаратами ПТГ и его аналогов, а также использование препаратов витамина D и комбинированных препаратов (витамин D + препараты кальция, дегидротахистерол, АТ-10 и др.).
Лечение остеопороза, обусловленного как первичными, так и вторичными причинами, имеет общие подходы.
Немедикаментозная терапия:
- физические упражнения;
- снижение риска падений;
- диета;
- отказ от курения;
- питание, обогащенное кальцием и витамином D.
Медикаментозная терапия:
- гормональная заместительная терапия;
- тиболон (синтетический стероид);
- селективные модуляторы рецепторов эстрогена;
- бисфосфонаты;
- кальцитонин;
- препараты кальция.
Из числа приведенных немедикаментозных методов лечения пациент может самостоятельно отвечать за отказ от курения и снижение риска падений. Что касается физических упражнений, должна быть обязательная консультация специалиста и разработан индивидуальный комплекс лечебной физкультуры для каждого пациента.
Какого бы генеза заболевание ни приводило к развитию остеопороза – диета составляет важный компонент лечения. В условиях нормального состояния организма для обеспечения основных процессов, регулируемых фосфорно-кальциевым обменом, человек должен получать 0,5 г кальция в сутки. Однако во многих руководствах приводится рекомендация 1 г кальция в сутки, это связано с тем, что в кишечнике всасывается лишь 50 % потребляемой дозы из-за низкой способности кальция образовывать растворимые соединения. Именно по этой причине кальций лучше усваивается из продуктов, не подвергавшихся термической обработке. При нагревании продуктов кальций образует стойкие соединения и практически не усваивается организмом. Более высокие дозы кальция в физиологических условиях требуются растущему организму, женщине во время беременности, людям во время значительных физических и психических нагрузок, в зимнее время. Пациенты с остеопорозом обязательно должны употреблять продукты, богатые кальцием, витаминами (D, А, Е), микроэлементами (магний, медь, цинк, селен).
С возрастом у людей снижается способность кожи продуцировать D3 и адсорбировать его в кишечнике. Пожилые люди реже находятся на открытом воздухе в условиях прямого попадания солнечных лучей, что, конечно, не может не сказаться на образовании эндогенного витамина D.
Медикаментозная коррекция нарушений фосфорно-кальциевого обмена – задача непростая. Определилась достаточно ограниченная группа лекарственных препаратов, которые применяются в качестве патогенетической терапии. В практике врача-эндокринолога успешно применяются бисфосфонаты, препараты кальция и витамина D [8, 9].
Критерии оценки эффективности лекарственных препаратов лечения остеопороза: снижение частоты переломов при 3–5-летнем лечении (основной критерий), увеличение минеральной плотности кости, нормализация или улучшение профиля маркеров костного метаболизма, улучшение качества кости (гистоморфологические исследования), улучшение качества жизни больных (повышение физической активности, уменьшение болевого синдрома).
Препараты кальция достаточно давно применяются в лечении первичного остеопороза. Чаще используются таблетированные формы препаратов кальция, хорошо известны основные средства, способствующие лучшему усвоению кальция из желудочно-кишечного тракта:
- белковая пища (аминокислоты улучшают транспорт кальция в клетку);
- лимонный сок (повышает усвоение солей кальция);
- желчегонные средства (желчные кислоты улучшают утилизацию кальция в тонком кишечнике);
- достаточное количество жидкости (1,5–2,0 л/сут).
Физиологической активностью обладает ионизированный кальций, он активирует пластическую функцию остеобластов и остеоцитов, участвует в формировании костной ткани, составляет минеральную основу скелета. Препараты кальция восполняют дефицит ионов, ингибируют активность остеокластов и снижают резорбцию костной ткани. Соли кальция эффективны в лечении остеопороза, если поступают в организм в количестве не менее 1500 мкг/сут (в пересчете на ионизированный кальций). Самое низкое содержание кальция в 1 г соли содержится в глюконате кальция, наибольшее – в карбонате и фосфате кальция. Помимо монокомпонентных препаратов солей кальция применяют двукомпонентные: соли кальция + витамин D3.
Витамин D используется при различных нарушениях фосфорно-кальциевого обмена – в комплексной терапии остеопороза, при гипопаратиреозе, остеомаляции, синдроме Фанкони. Понятие «витамин D» объединяет две природные формы – D2 (эргокальциферол) и D3 (колекальциферол), их структурные аналоги и активные метаболиты. Нативные продукты (колекальциферол, эргокальциферол) и аналог витамина D2 (дигидротахистерол) обладают умеренной активностью. В настоящее время с лечебной целью чаще используются активные метаболиты – кальцитриол [1α,25-(OH)2D3], альфакальцидол [1α-(OH)D3], кальципотриол. Все препараты витамина D в организме превращаются в кальцитриол и обеспечивают одинаковый фармакологический эффект: усиление всасывания кальция в кишечнике (образование внутри энтероцитов кальцийсвязывающих белков), угнетение повышенной костной резорбции, нормализацию процессов ремоделирования и вымывание кальция из костей, подавление секреции ПТГ, улучшение функции мышечной ткани. Под влиянием кальцитриола и альфакальцидола происходит также увеличение синтеза в остеобластах коллагена 1-го типа и матричных белков (остеокальцина и остеопонтина), играющих важную роль в процессах формирования и минерализации костной ткани. Применение кальцитриола способствует подавлению активности 1α-гидроксилазы и стимулирует активность другого почечного фермента – 24α-гидроксилазы, увеличивает образование активного метаболита – 24α,25(OH)2D3, который играет активную роль в процессах заживления микропереломов и образования микромозолей в костях, увеличивает плотность костной ткани.
Препараты витамина D уже длительное время используют для профилактики и лечения остеопороза. Физиологические заместительные дозы нативного витамина D составляют от 400–800 до 1000–2000 МЕ/день. При нарушениях метаболизма дозировки могут быть увеличены от 10 тыс. до 25 тыс. МЕ/день. Терапия проводится в течение нескольких месяцев или лет.
Кальцитриол обладает доказанной эффективностью в лечении и профилактике вторичного гиперпаратиреоза. Применение кальцитриола понижает уровень ПТГ и улучшает структуру костной ткани. Доза зависит от тяжести состояния пациента и способа применения (пероральный, внутривенный).
Однако следует учитывать риск развития гиперкальциемии и гиперкальцийурии при длительном лечении высокими дозами витамина D. Более безопасно при длительном применении назначение альфакальцидола, его можно использовать пациентам с заболеваниями почек.
Бисфосфонаты – «золотой» стандарт в лечении остеопороза независимо от того, первичный он или вторичный [8]. Название этой группы лекарственных средств образовалось благодаря наличию в химической структуре атома углерода, связанного с двумя атомами фосфора (негидролизируемая P-C-P-связь). По структуре бисфосфонаты близки к эндогенному пирофосфату. Бисфосфонаты первого поколения тормозили резорбтивную активность остеокластов за счет образования и накопления метаболитов, нарушающих нормальное функционирование остеокластов. Бисфосфонаты первого поколения (этидронат, клодронат и тилудронат) использовались в основном для лечения болезни Педжета (деформирующий остеит) и уже позднее – в лечении остеопороза. На сегодняшний день этидронат, тилудронат, памидронат, ибандронат и золедронат практически не применяются в лечении остеопороза, основными показаниями к их назначению остаются болезнь Педжета и опухолевые формы гипертиреоза.
Формула бисфосфонатов нового поколения – аминобисфосфонатов содержит атом азота (алендронат, ризендронат), что меняет их механизм действия, при этом за счет ингибирования фарнезил-пирофосфатазы и других этапов метаболизма мевалоната нарушается дифференцировка предшественников остеокластов и усиливается апоптоз остеокластов. В результате снижается уровень маркеров костной резорбции, повышается минеральная плотность костной ткани и снижается риск возникновения переломов.
Все перечисленное расширило горизонты использования бисфосфонатов нового поколения. Алендронат эффективно используется как при ювенильном и иммобилизационном остеопорозе, так и при остеопорозе, обусловленном эндокринными нарушениями (гипертиреоз, гиперкортицизм, эстрогенная и андрогенная недостаточность).
Применение бисфосфонатов должно сопровождаться некоторыми мерами предосторожности: препараты необходимо принимать натощак, запивая большим количеством воды. Среди побочных эффектов чаще всего встречаются: боли в животе, диспептические расстройства (запор или диарея, метеоризм), дисфагия, изжога; боль в мышцах, боль в костях. Бисфосфонаты не метаболизируются в организме, поэтому выводятся с мочой практически в неизмененном виде.
Бисфосфонаты противопоказаны при беременности, во время лактации, при выраженных нарушениях функции почек (клиренс креатинина менее 30 мл/мин), повышенной чувствительности. Следует помнить и о «феномене рикошета» – усилении резорбции кости на фоне лечения солями кальция после отмены бисфосфонатов.
Фороза® – препарат выбора в лечении нарушений фосфорно-кальциевого обмена у больных эндокринной патологией
В лечении нарушений фосфорно-кальциевого обмена у больных эндокринной патологией требования к выбору препарата для их коррекции возрастают. Не все средства, используемые в терапии первичного остеопороза, обладают достаточной эффективностью при вторичных остеопорозах эндокринного генеза. С другой стороны, по требованиям современной медицины эффективность любого препарата должна быть доказана многоцентровыми рандомизированными исследованиями. В соответствии с этими критериями подтверждена активность азотсодержащих бисфосфонатов (алендронат, ризендронат) [3], поэтому препаратами первой линии лечения остеопороза являются именно они.
Одной из наиболее оптимальных формул бисфосфонатов, которыми мы пользуемся на сегодняшний день, является Фороза® – алендроната натрия тригидрат, негормональный специфический ингибитор остеокластической костной резорбции, подавляющий активность остеокластов. Фороза® стимулирует остеогенез, восстанавливает положительный баланс между резорбцией и восстановлением кости, увеличивает минеральную плотность костей (регулирует фосфорно-кальциевый обмен), способствует формированию костной ткани с нормальной гистологической структурой. Преимущества препарата связаны с частотой применения (70 мкг 1 раз в неделю), высокой эффективностью при остеопорозе любого типа, как у женщин, так и у мужчин. И это очень важный аспект в лечении вторичного остеопороза на фоне возрастного андрогенодефицита и профилактики переломов.
Нет ограничений для его назначения пожилым пациентам и больным с нарушением функции печени, умеренным нарушением функции почек (Cl креатинина > 35 мл/мин). Осо-бую ценность для эндокринологической практики препарат представляет в связи с доказанной эффективностью его применения больными гиперкортицизмом, в т.ч. для лечения остеопороза, вызванного длительным применением кортикостероидов. Фороза не оказывает влияния на концентрацию внимания и способность управлять транспортом.
Заключение
Клиническая эффективность алендроната была неоднократно доказана в рандомизированных исследованиях на больных остеопорозом (уровень рекомендаций А). Он эффективен не только при первичных формах гипопаратиреоза, но и при нарушениях фосфорно-кальциевого обмена у больных гиперпаратиреозом, гиперкортицизмом, тиреотоксикозом, сахарным диабетом. В среднем Фороза снижает риск переломов различной локализации на 50 %, а риск множественных переломов позвонков – на 90 %. Конечно, препарат наделен и некоторыми общими недостатками всех бисфосфонатов: низкая биодоступность таблетированных форм, нефрогенный путь выведения, ограниченное применение пациентами с нарушением функции почек, побочное действие в виде диспепсических расстройств, боли в костях и мышцах, аллергические реакции, но при соблюдении рекомендаций по использованию препарата Фороза® позволяет обеспечивать высокую эффективность в коррекции нарушений фосфорно-кальциевого обмена при эндокринных заболеваниях.


