Введение
Сахарный диабет 2 типа (СД2) в последнее время приобрел масштабы неинфекционной эпидемии и представляет собой серьезную медико-социальную проблему. По данным Всемирной организации здравоохранения (ВОЗ), сегодня в мире насчитывается около 347 млн больных СД, из них – 90 % СД2 и, согласно прогнозам, к 2030 г. их число, возможно, превысит 530 млн. Сердечно-сосудистые осложнения СД считаются одним из основных факторов, определяющих выживаемость этой категории пациентов, а сам СД предлагается рассматривать как эквивалент наличия у пациента клинически выраженного сердечно-сосудистого заболевания [1].
Одно из часто встречающихся осложнений СД – хроническая сердечная недостаточность (ХСН). В ряде исследований было показано, что СД является фактором риска развития ХСН [2]. Эпидемиологические исследования свидетельствуют, что от 15 до 26 % пациентов с недостаточностью кровообращения страдают СД2. Около 12 % больных СД2 имеют признаки ХСН [3]. Частое сочетание ХСН и СД2 обусловлено схожими патогенетическими механизмами. Инсулинорезистентность (ИР) играет одну из главных ролей в формировании и развитии СД2, а ХСН может быть одним из факторов, приводящих к развитию ИР [4].
Инсулинорезистентность, определяющая развитие СД2, рассматривается в настоящее время как первичный этиологический фактор развития сердечной недостаточности неишемического генеза [5]. Показано, что в основе патогенеза развития «инсулинорезистентной кардиомиопатии» лежит нарушение энергетического метаболизма миокарда, опосредованное формированием синдрома липотоксичности, симпатической дисрегуляции, оксидативного стресса и воспаления, что проявляется преобладанием в нем процессов β-окисления жирных кислот и резким подавлением окисления глюкозы в миокарде, нарушением метаболизма в нем.
Гиперинсулинемия является независимым фактором риска развития сердечно-сосудистой патологии у лиц, имеющих СД2 [6]. Сигнальный путь инсулина играет важную роль в активации синтазы оксида азота, которая регулирует продукцию оксида азота, являющегося мощным вазодилататором и антиатеросклеротическим фактором [7]. Таким образом, нарушение сигнального пути инсулина может приводить к нарушению эндотелиальной функции микро- и макрососудов, а в дальнейшем – к развитию атеросклероза у больных СД2. Однажды возникший и закрепившийся дефект в сигнальном пути инсулина инициирует повторяющиеся циклы обратной связи. Нарушение утилизации глюкозы вызывает гипергликемию, которая стимулирует секрецию инсулина, который в свою очередь увеличивает продукцию коллагена, вызывает пролиферацию гладкой мускулатуры сосудов, избыточное количество ростовых факторов и провоспалительных цитокинов, что усиливает развитие атеросклероза и увеличивает жесткость сосудистой стенки [8].
Известно, что одним из осложнений СД2 является автономная кардиальная невропатия, которая приводит к нарастанию тонуса симпатической нервной системы и сопровождается снижением парасимпатических воздействий. Изменение вегетативной регуляции сердечно-сосудистой системы у больных ХСН и СД2 значительно повышает риск развития коронарного атеросклероза и инфаркта миокарда, Так, низкая вариабельность ритма сердца (ВРС) является предиктором внезапной сердечной смерти у данного контингента больных [9].
Исследования, проведенные ранее, показали, что концентрация глюкозы, инсулина, уровень триглицеридов (ТГ) и липопротеидов низкой плотности (ЛПНП) в крови может значительно влиять на изменение структуры и функции артериальной стенки [10].
Высокая частота встречаемости ХСН и СД2, плохой прогноз и низкое качество жизни определяют актуальность вопроса подбора оптимальной терапии. Предупреждение поражения органов-мишеней, в т.ч. микро- и макрососудов, при СД является одним из главных направлений лечения. Представляется интересным также изучить возможность коррекции углеводного, липидного обменов, вегетативной дисфункции у данной категории больных и опосредованно воздействовать на патофизиологические механизмы нарушений микро- и макроциркуляторного русла. Таким образом, предполагается, что лекарственные средства метаболического действия могут благоприятно влиять на течение ХСН и СД2. Одним из таких перспективных препаратов является таурин – жизненно необходимая сульфоаминокислота, конечный продукт обмена серосодержащих аминокислот: метионина, цистеина, цистеамина. На сегодняшний день выполнено достаточно много экспериментальных и клинических исследований, показывающих перспективность применения таурина в терапии сердечной недостаточности и СД. Положительное влияние на течение ХСН после перенесенного инфаркта миокарда обусловлено доказанными антиоксидантными [11] и противовоспалительными свойствами таурина [12]. Известны вазопротективные свойства таурина, который снижает жесткость магистральных сосудов, улучшает эндотелиальную функцию [13]. Также показано благоприятное влияние таурина на углеводный и липидный обмены у пациентов с СД2 [14].
С учетом вышеуказанного свойства таурина можно предполагать его положительное влияние на обменные нарушения, лежащие в основе развития и прогрессирования ХСН и СД: липидо- и глюкозотоксичность, ИР, а также благоприятное действие на структурно-функциональные свойства сосудов и сердца.
Целью исследования было изучение влияния таурина в составе базисной терапии ХСН и СД2 на тяжесть сердечной недостаточности, углеводный и липидный обмены, ИР, вариабельность ритма сердца (ВРС), систолическую и диастолическую функции сердца, а также эластические свойства сосудов и параметры микроциркуляции.
Материал и методы
Под наблюдением находились 60 больных обоего пола в раннем постинфарктном периоде (3–4-я недели от начала инфаркта миокарда) с ХСН II–III функциональных классов (ФК) по NYHA (NewYork Heart Association) и сопутствующим СД2. Критерии исключения из исследования: декомпенсированная ХСН, неконтролируемая злокачественная артериальная гипертензия, острый период инфаркта миокарда, прогрессирующая стенокардия, аортокоронарное шунтирование, стентирование, гемодинамически значимые пороки сердца и нарушения ритма, СД1, ожирение II–III степеней, тяжелые заболевания эндокринной системы помимо СД, терапия инсулином, клинически выраженная печеночная и почечная недостаточность, любые другие заболевания, которые могли повлиять на результаты исследования. Протокол исследования одобрен Региональным этическим комитетом. Все пациенты были распределены методом простой рандомизации в две группы по 30 человек: 1-я (контрольная) – пациенты, получающие базисную терапию сердечной недостаточности (бисопролол, периндоприл, ацетилсалициловая кислота, клопидогрел, симвастатин; диуретики – фуросемид, индапамид, спиронолактон, при необходимости – нитраты) и базисную сахароснижающую терапию (метформин и/или глибенкламид), и 2-я (опытная) – пациенты, принимающие дополнительно к основному лечению ХСН и СД таурин в дозе 500 мг 2 раза в сутки. Терапия ХСН проводилась в соответствии с национальными рекомендациями Всероссийского научного общества кардиологов (ВНОК) и Общества специалистов по сердечной недостаточности (ОССН) по диагностике и лечению ХСН третьего пересмотра [15]. Медикаментозное лечение СД2 было согласовано со специалистом-эндокринологом и соответствовало Алгоритмам специализированной медицинской помощи больным сахарным диабетом [16]. Средние дозы базисных препаратов, применяемых для лечения ХСН и СД2, статистически достоверно не различались между группами. Больные в обеих группах при включении в исследование не имели достоверных различий по возрасту, половому составу, тяжести перенесенного инфаркта миокарда, ХСН и СД2 (табл. 1).
Кроме того, пациенты не имели достоверных межгрупповых различий при включении в исследование по таким параметрам, как фракция выброса левого желудочка – ФВ ЛЖ (50,7 ± 6,1 против 49,8 ± 5,9 %); индекс массы миокарда ЛЖ (145,5 ± 7,2 против 146,9 ± 6,2 г/м2); распределение типов диастолической дисфункции (ДД): рестриктивный тип ДД (3,3 против 6,7 %), псевдонормальный тип ДД (13,3 против 23,3 %), гипертрофический тип ДД (83,3 против 70 %) соответственно в 1-й и 2-й группах.
Для решения поставленных задач провели клиническое обследование пациентов с оценкой функционального класса ХСН пациента по тесту 6-минутной ходьбы (ТШХ). Определили уровень мозгового натрийуретического пропептида (Nt-proBNP) методом иммуноферментного анализа (ИФА) с помощью наборов Biomedica (Словакия) на биохимическом анализаторе Liasys (AMS, Италия); уровень глюкозы крови натощак исследовали с помощью наборов фирмы «Lachema» (Чехия) унифицированным калориметрическим глюкозооксидазным методом, базальный инсулин – методом ИФА с использованием наборов DRG (США) на иммуноферментном анализаторе УНИПЛАН («Пикон», Россия); гликированный гемоглобин (HbA1c) определен методом боратного аффинного анализа наборами «NycoCard» (Норвегия) на анализаторе NycoCard Reader II («Axis-Shield РоС AS», Норвегия). Рассчитан индекс ИР – индекс HOMA-IR (Homeostasis Model of Assessment-Insulin Resistance). Уровни креатинина крови, общего холестерина (ОХС), ТГ, ЛПНП, липопротеидов высокой плотности (ЛПВП), индекс атерогенности (ИА) определены ферментативным методом наборами ASSEL (Италия) на биохимическом анализаторе Liasys (AMS, Италия).
Эхокардиографическое (ЭхоКГ) исследование для изучения структурно-функционального состояния миокарда и центральной гемодинамики выполнены на аппарате SIEMENS SONOLINE G50 (Германия). Все исследования выполнены в В- и М-режимах с использованием стандартных ЭхоКГ-позиций. Расcчитаны основные структурные и функциональные параметры сердца (ФВ ЛЖ, конечный диастолический размер, конечный систолический размер) в соответствии с рекомендациями по количественной оценке структуры и функций камер сердца. Ударный объем крови определен по Симпсону. Диастолическая функция ЛЖ исследована путем оценки трансмитрального кровотока при проведении пробы Вальсальвы и потока в легочных венах, при этом также учитывали размеры левого предсердия.
Исследование ВРС проведено на приборе «Поли-Спектр-8/Е» (Россия). Запись электрокардиограммы осуществлена в течение 5 минут утром в состоянии покоя в одном из стандартных отведений в положении лежа. Учтены следующие показатели ВРС: SDNN (standart deviation, мс) – стандартное отклонение величин интервалов RR за весь рассматриваемый период; SI (Stress Index) – индекс напряжения регуляторных систем с учетом величины которого определен исходный вегетативный тонус: нормотония – при SI от 30 до 90 усл. ед., ваготония – SI менее 30, симпатикотония с умеренным преобладанием тонуса симпатического отдела вегетативной нервной системы – SI от 90 до 160, гиперсимпатикотония – SI более 160 усл. ед.; TP (total power, мс2) – суммарная мощность спектра ВРС; IC (%) – индекс централизации регуляторных систем [17].
Микроциркуляция изучена методом лазерной допплеровской флоуметрии (ЛДФ) со спектральным анализом колебаний кровотока с помощью аппарата ЛАКК-ОП (Россия). Оценены следующие параметры МЦ: показатель микроциркуляции – (ПМ); интегральный показатель вариаций (Kv); показатели, характеризующие нейрогенный (Ан/СКО), миогенный (Ам/СКО), эндотелиальный (Аэ/СКО) факторы регуляции микроциркуляции (МЦ). Резервные возможности МЦ оценены при проведении окклюзионной пробы, во время которой определен резервный капиллярный кровоток (РКК). Для оценки артериоловенулярного рефлекса проведена дыхательная проба. По степени снижения тканевого кровотока на высоте вдоха (повышение активности симпатической нервной системы) оценено состояние приносящего и венулярного звена МЦ.
С учетом ПМ на исходной ЛДФ-грамме и РКК в окклюзионной пробе определен гемодинамический тип микроциркуляции (ГТМ). Были выделены следующие ГТМ: нормоциркуляторный, гиперемический, спастический. В тех случаях, когда указать конкретный ГТМ было затруднительно, решающим оставался показатель РКК, отражающий функциональные возможности сосудов МЦ [18].
Эластические свойства сосудов оценены методом определения скорости распространения пульсовой волны (СРПВ) с помощью сфигмографической приставки на аппаратно-программном комплексе «Поли-Спектр-8/Е» (Россия). Исследованы СРПВ по сосудам эластического типа (СРПВэ), СРПВ по сосудам мышечного типа (СРПВм) и соотношение СРПВм/СРПВэ. Для определения СРПВэ произведена синхронная запись сфигмограмм сонной и бедренной артерий, СРПВм – сонной и лучевой артерий. СРПВэ и СРПВм рассчитаны как отношение расстояния между точками расположения датчиков ко времени прохождения пульсовой волны на соответствующем сегменте сосудистого русла. Для оценки функции эндотелия использована окклюзионная проба – изменение диаметра сосудов после реактивной гиперемии в процентном отношении к исходной величине. Нормальной реакцией плечевой артерии принято считать ее дилатацию на фоне реактивной гиперемии более чем на 10 % от исходного диаметра [19]. Жесткость крупных артерий (ЖКА) оценена как соотношение пульсового артериального давления (мм рт. ст.) к ударному объему крови сердца (мл).
На II этапе исследования были проведены оценка влияния 16-недельной терапии таурином на выраженность ФК сердечной недостаточности; структурно-функциональные параметры сердца, углеводный, липидный обмены; показатели ВРС и МЦ; эластические свойства магистральных сосудов у больных ХСН с сопутствующим СД2.
Статистическая обработка результатов проведена с использованием функций Microsoft Excel 2010 и пакета статистических программ Statistica 6.0. Применены методы параметрической и непараметрической статистики. Вычислено среднее значение исследуемых величин (М), ошибка средней величины (m) для каждого показателя. Оценка достоверности различий между данными, полученными в исследуемых группах, осуществлена с использованием t-критерия Стьюдента. Качественные величины сравнивали с помощью критерия Фишера. Статистически значимыми считали отклонения при p < 0,05. При сравнении распределений пациентов по ГТМ использован критерий χ². В зависимости от результатов теста Шапиро–Уилка на нормальность для проверки гипотезы о принадлежности выборок к одной генеральной совокупности привлекли тесты либо Стьюдента, либо Манна–Уитни. Аналогично при оценке эффекта лечения использован либо парный t-тест, либо тест Вилконсона.
Результаты и обсуждение
В конце 4-месячной терапии в опытной группе пациентов выявлено достоверное снижение уровня Nt-proBNP, отражающего степень тяжести сердечной недостаточности у обследованных больных, – на 28,9 % против 13,7 в группе сравнения. Различие между группами по данному показателю на уровне статистической тенденции (p = 0,07). Толерантность к физическим нагрузкам, по результатам ТШХ, у пациентов достоверно увеличилась в обеих группах: на 38,5 % – в основной и на 24,8 % – в контрольной группах, в то время как ФК тяжести ХСН снизился на 18,2 и 16,1 % соответственно. Достоверного различия между группами не выявлено. Также статистически значимым оказалось увеличение ФВ ЛЖ у больных, которым дополнительно назначали таурин, – на 15 % против 2,4 в группе сравнения по завершении исследования (различие между группами при p = 0,03).
Включение таурина в базисную терапию ХСН у больных СД2 оказало позитивное влияние на выраженность ДД. Частота выявления ДД II типа у больных ХСН и МС в основной группе снизилась на 28,6 % против 25,0 (р > 0,05). Число пациентов с нормальной диастолической функцией увеличилось на 10 % в 1-й и на 6,7 % во 2-й группах. ДД III типа, выявленная при первичном обследовании, не встретилась в обеих группах по окончании 16-недельной терапии. Различия между группами по данному признаку не достоверны.
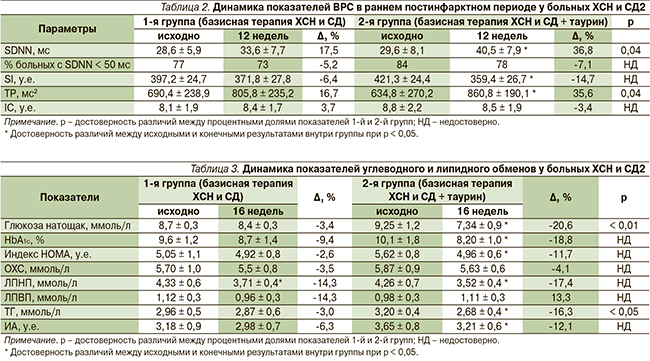
Четырехмесячное лечение таурином пациентов с ХСН и СД2 сопровождалось более выраженными позитивными изменениями показателей ВРС (табл. 2). В обеих группах у всех больных в начале наблюдения выявлено снижение SDNN менее 50 мс, что является независимым предиктором смерти от прогрессирующей ХСН [20].
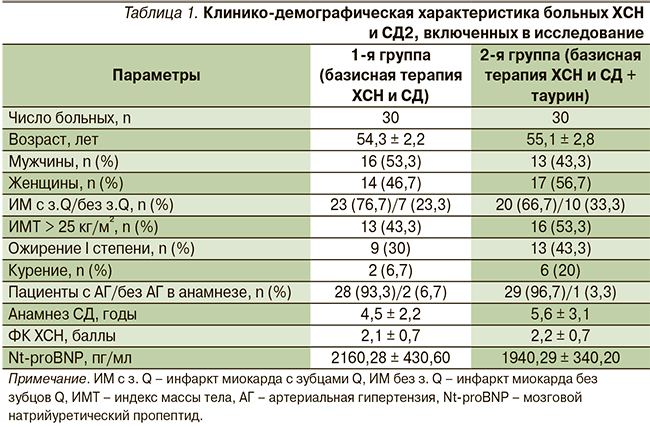
На фоне терапии таурином больных ХСН и СД2 к 16-й неделе наблюдения значение SDNN достоверно увеличилось на 36,8 % (р < 0,05) против 17,5 % в контрольной группе. Различие по конечному результату между группами достоверно. Включение таурина в схему лечения ХСН у больных СД2 сопровождалось более выраженным снижением процента больных с SDNN < 50 мс: на 7,1 % по сравнению с исходными показателями против 5,2 % в группе базисной терапии по завершении исследования.
В обеих группах к 16-й неделе наблюдения отмечено снижение SI, более выраженное на фоне дополнительного приема таурина: в основной группе – на 14,7 % (p < 0,05) против 6,4 % соответственно в группе базисной терапии, что является благоприятным изменением в сторону уменьшения активности симпатического отдела вегетативной нервной системы. Различие по изучаемому параметру между группами не достигло критерия достоверности.
Также установлено, что в результате 16-недельной терапии таурином отмечено увеличение TP на 35,6 % (p < 0,05), тогда как в контрольной группе данный показатель возрос на 16,7 %. Различие по конечным результатам с группой сравнения достигло статистической значимости (p = 0,04).
В группе больных ХСН и СД2 через 16 недель лечения таурином отмечена нормализация вегетативных показателей: достоверно уменьшилось число пациентов, имеющих гиперсимпатикотонию, и увеличилось число пациентов с симпатикотоническим вегетативным тонусом. Исходно по распределению типов вегетативного тонуса группы не различались (рис. 1).
У больных 2-й группы на фоне включения в комбинированную терапию таурина выявлено статистически значимое улучшение показателей углеводного обмена: снижение уровня глюкозы крови натощак и HbA1c, а достоверное снижение индекса HOMA свидетельствует о клинически значимом уменьшении ИР (табл. 3).
При изучении липидного обмена обнаружено статистически значимое снижение уровня ЛПНП (∆17%), ТГ (∆16 %) и ИА (∆12 %) в группе пациентов, принимавших таурин в дополнение к базисной терапии ХСН и СД2.
При сравнении динамики параметров углеводного обмена и липидного спектра в двух группах пациентов по конечному результату (через 4 месяца) достоверные различия обнаружены только по уровню глюкозы натощак и ТГ в крови – достоверно ниже в опытной группе.
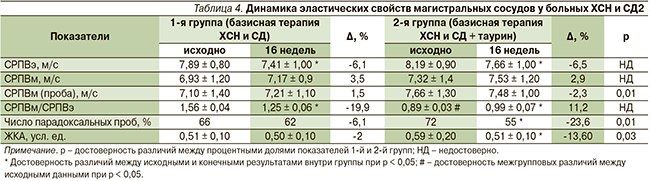
При исследовании параметров жесткости артерий отмечено достоверное снижение СРПВ по сосудам эластического типа на 9 % в опытной группе и на 6 % в контрольной через 16 недель лечения по сравнению с исходными данными. Показатель соотношения СРПВм/СРПВэ увеличился во 2-й группе через 16 недель базисного лечения ХСН и СД2 с включением таурина на 11 % (р ≤ 0,05), в то время как в контрольной группе этот показатель снизился на 20 % (р ≤ 0,05) (табл. 4).
Важно отметить, что значение ЖКА достоверно уменьшилось только в группе больных, получавших дополнительно таурин на 9 %. Анализ исходных показателей пробы с реактивной гиперемией у пациентов обеих групп свидетельствует о наличии патологической вазоконстрикции, что отражает выраженное нарушение эндотелиальной функции у пациентов ХСН и СД2. Установлено, что только в опытной группе через 16 недель базисной терапии ХСН и СД2 с включением таурина определена постокклюзионная вазодилатация (%) по сравнению с исходными данными (-5,50 ± 11,7 против 0,02 ± 7,5) и достоверно снизилось число парадоксальных проб. В конце 4-месячного периода наблюдения было выявлено статистически значимое различие между опытной и контрольной группами пациентов по таким показателям, как СРПВм (проба), число парадоксальных проб (%), эндотелийзависимая вазодилатация (%), ЖКА, что свидетельствовало о благоприятном влиянии таурина на эластические свойства магистральных сосудов при терапии больных ХСН с СД2.
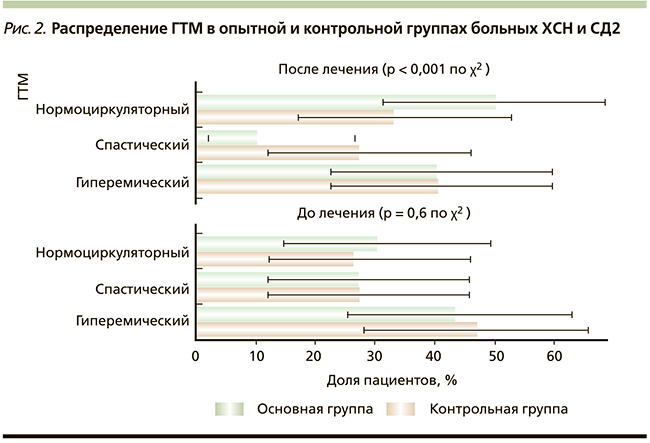
Исследование состояния МЦ показало, что большинство пациентов с ХСН и СД2, включенных в исследование, имели гиперемический тип МЦ: 43 % – в основной группе и 37 % – в контрольной. Спастический и нормоциркуляторный типы выявлены у 27 и 30 % больных во 2-й и у 27 и 33 % – в 1-й группах соответственно (рис. 2).
Отмечено перераспределение типов МЦ через 16 недель лечения среди пациентов 2-й группы, принимающих таурин в дополнение к базисной терапии ХСН и СД2. Статистически значимо уменьшилась доля больных спастическим ГТМ на 17 %, при этом возросла доля пациентов с нормоциркуляторным ГТМ (рис. 2).
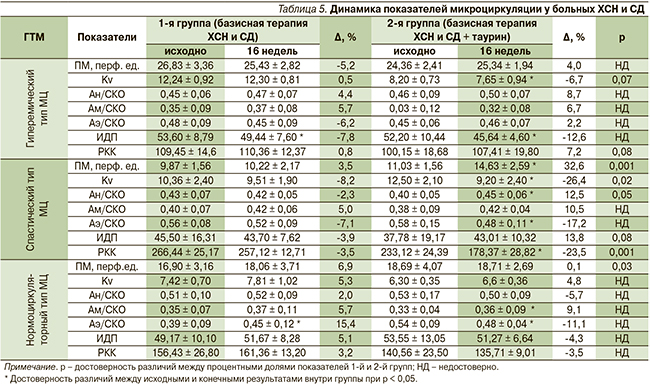
Параметры МЦ, а также влияние на них терапии таурином изучались внутри каждого ГТМ (табл. 5). Установлено, что эффективность применения таурина отличалась в зависимости от типа МЦ.
Исходные показатели МЦ между группами достоверно не различались.
У пациентов ХСН с сопутствующим СД2 и гиперемическим типом МЦ отмечено статистически значимое снижение ИДП через 16 недель терапии по сравнению с исходными данными: на 7 % – в основной группе и на 8 % – в контрольной. Обращает на себя также внимание снижение Kv на 7 % только в группе больных, дополнительно к базисной терапии принимавших таурин.
Наибольшие изменения наблюдались у пациентов с ХСН и СД2 со спастическим типом МЦ. Установлено увеличение ПМ на 33 % (р < 0,01) и снижение РКК на 23 % (р < 0,01), что соответствует параметрам нормоциркуляции. Отношение Ан/СКО достоверно увеличилось на 13 % через 16 недель базисной терапии с таурином. Различия при сравнении динамики данных показателей между группами пациентов было статистически значимым.
Среди пациентов с нормоциркуляторным ГТМ через 16 недель базисной терапии ХСН и СД2 произошло статистически значимое снижение отношения Аэ/СКО на 13 % в контрольной группе и на 12 % (р < 0,05) в опытной, а показатель Ам/СКО достоверно увеличился на 9 % только в группе у больных ХСН и СД2, принимавших дополнительно таурин.
Выводы
Включение таурина в состав базисной терапии ХСН и СД2 увеличивает ФВ ЛЖ и на уровне статистической тенденции снижает уровень Nt-proBNP по сравнению с контрольной группой.
16-недельная терапия таурином пациентов ХСН и СД2 достоверно снижает уровень тощаковой глюкозы, HbA1c, ИР, уменьшает уровни ЛПНП и ТГ.
Терапия таурином больных ХСН и СД2 приводит к росту значений SDNN, снижает напряжение регуляторных систем, а также достоверно снижает число пациентов с гиперсимпатикотонией.
Включение таурина в базисную терапию больных ХСН и сопутствующим СД2 способствует клинически значимому снижению жесткости сосудистой стенки магистральных артерий и достоверно улучшает ее эндотелиальную функцию.
На фоне приема таурина происходит статистически значимое увеличение доли нормоциркуляторного ГТМ у больных ХСН и СД2 за счет уменьшения встречаемости спастического типа. У больных со спастическим ГТМ увеличиваются скорость и объем периферического кровотока, снижается симпатический тонус, а также уменьшается напряженность регуляторных систем микрогемодинамики.
Авторы статьи заявляют об отсутствии конфликта интересов по отношению к рукописи.


