Сахарный диабет 2 типа (СД2) представляет собой серьезную медико-социальную проблему. На сегодняшний день в мире число больных СД составляет 374 млн. По прогнозам Всемирной организации здравоохранения, к 2030 г. число пациентов превысит 525 млн. Столь быстрый рост распространенности заболевания объясняется влиянием изменения характера питания и гиподинамией. Положительный энергетический баланс и недостаточная физическая активность ведут к росту избыточной массы тела и ожирения населения. По данным различных источников, ожирение присутствует примерно у 80–90 % пациентов с СД2 [27]. Определен прямой характер зависимости риска развития СД2 от индекса массы тела (ИМТ). При ожирении I степени риск СД2 увеличивается в 2 раза, II степени – в 5–10, III степени – более чем в 10 раз [3, 13]. Тесная корреляция между ИМТ и частотой развития СД отмечается как у мужчин, так и у женщин [1]. Оба состояния приобрели сегодня глобальный характер, ряд исследователей ввели термин «DiObesity», т.е.«диожирение».
Сочетание СД с ожирением значительно ухудшает прогноз и увеличивает стоимость лечения. Установлено, что уменьшение массы тела пациентов с ожирением на 5 % ассоциируется с улучшением показателя гликированного гемоглобина (HbAlc) на 0,6 % и снижением дозы сахароснижающей терапии [23]. Связь ожирения с факторами развития и прогрессирования сердечно-сосудистых осложнений и смертности среди больных СД (артеральная гипертензия, атеросклероз, дислипидемия) служит еще более мощным стимулом для выбора в качестве сахароснижающей терапии препаратов, вызывающих редукцию массы тела. Большинство из них, используемых в настоящее время для лечения СД2, способствует прибавке массы тела, особенно в условиях интенсификации гликемического контроля.
Метформин получил широкое применение после представления данных многолетнего исследования UKPDS (UK Prospective Diabetes Study) в 1998 г.
Основные выводы этой работы свидетельствовали о снижении риска развития осложнений у пациентов с ожирением на фоне приема метформина: сосудистых – на 32 %, смертности от СД – на 42, общей смертности – на 36, инфаркта миокарда – на 39 %. Последующие крупные клинические исследования подтвердили эффективность и безопасность метформина, в результате чего в 2006 г. он был определен в качестве препарата первого выбора при инициации лечения пациентов с СД2.
Клинически на фоне приема метформина не происходит прибавки массы тела и даже отмечается некоторое ее снижение. Немаловажным остается его влияние на правильное распределение жировой массы. На сегодняшний день есть данные, будто именно абдоминальное отложение жира независимо от массы тела связано с инсулинорезистентностью (ИР) и нарушением толерантности к глюкозе [3]. Причиной развития гипергликемии, гиперинсулинемии и дислипидемии при ожирении служат метаболические нарушения, а именно липолитические процессы, протекающие в висцеральной жировой ткани [6]. Так, в исследовании с использованием радионуклеидного сканирования было показано, что через 6 месяцев лечения метформином масса тела снизилась на 4 %; масса жировой ткани – на 9; потеря висцерального жира составила 15 %; масса подкожной жировой клетчатки снизилась на 7 %; снижения мышечной массы не отмечено [18].
Регионарные различия между висцеральной и подкожной жировой тканью обусловлены неодинаковой экспрессией генов гормонов жировой ткани. Установлено, что бóльшая липолитическая активность обусловлена низким содержанием инсулиновых рецепторов на мембране адипоцитов висцерального жира и высокой плотностью рецепторов к катехаломинам. Также имеет значение повышение содержания β3- и снижения α2-адренорецепторов в сальнике [9, 20]. В силу этого сниженный антилиполитический эффект инсулина на адипоциты висцеральной жировой ткани способствует повышенной продукции свободных жирных кислот, поступающих через систему воротной вены в печень [8]. Этот процесс угнетает окисление глюкозы в цикле Рэндла, что в свою очередь влияет на развитие ИР [10].
Уникальность действия метформина состоит в улучшении чувствительности периферических тканей к инсулину путем повышения активности тирозинкиназы инсулинового рецептора в периферических тканях, а также повышения активности транспортеров глюкозы ГЛЮТ-1 и -4. В результате улучшается утилизация и окисление глюкозы [19], подавляется липолиз [25]. Повышение чувствительности к инсулину печеночной ткани ведет к уменьшению глюконеогенеза и гликогенолиза [7], снижению патологически повышенного уровня глюкозы за счет торможения глюконеогенеза и уменьшения окисления свободных жирных кислот и липидов [6]. Метформин также уменьшает всасывание глюкозы в кишечнике, усиливает ее утилизацию и снижает аппетит. Анорексигенный эффект препарата связан с влиянием на инкретиновую систему. Meтформин стимулирует секрецию глюкагоноподобного пептида-1 (ГПП-1) в ГПП-продуцирующих клетках in vitro, значительно увеличивая плазменные уровни ГПП-1. В связи с этим у пациентов, длительно получающих метформин, как правило, отмечаются повышенные уровни ГПП-1. Кроме того, метформин индуцирует экспрессию гена рецепторов островковых клеток к инкретинам с участием рецептора – активатора пролиферации пероксисом альфа (PPARα – Peroxisome Proliferator Activated Receptor) [22, 17].
С течением времени эффективность монотерапии метформином постепенно снижается и большинству пациентов требуется комбинированная терапия [2]. В исследовании UKPDS было продемонстрировано, что через три года после установления диагноза СД2 в комбинированной терапии нуждались 45 % пациентов, а через 9 лет – 75 %.
На втором этапе терапии традиционно используют производные сульфонилмочевины, эффективность гликемического контроля которых сопоставима, а в некоторых случаях превосходит метформин. Однако существует вероятность развития побочных эффектов, таких как гипогликемия и прибавка массы тела. В исследовании ACCORD (Action to Control Cardiovascular Risk in Diabetes) было продемонстрировано, что тактика интенсивного контроля не всегда ведет пациентов с СД2 к улучшению прогноза [16]. Стремление к достижению идеального гликемического контроля сопровождается возрастанием риска развития гипогликемий, прибавкой массы тела и увеличением сосудистого риска.
В связи с этой настороженностью особый интерес представляет группа препаратов, обладающих инкретиновым эффектом: аналоги глюкагоноподобного пептида-1 и ингибиторы дипептидилпептидазы-4 (ДПП-4).
В настоящее время найдено достаточно данных о сахароснижающей эффективности и безопасности данной группы препаратов в лечении СД2. Глюкозозависимая стимуляция инсулинового ответа и подавление секреции глюкагона ведут к снижению уровня глюкозы крови при низком риске гипогликемий. Эта группа препаратов также обладает потенциальной способностью положительно влиять на функцию β-клеток. Эти свойства позволяют говорить о патогенетически обоснованной терапии СД2 [12, 14]. Аналоги агонистов рецепторов ГПП-1 обладают выраженной сахароснижающей активностью и способствуют снижению массы тела. Это связано с тем, что ГПП-1 обладает анорексигенным эффектом, похожим на действие лептина, антагонистов нейропептида Y и кортиколиберина. ГПП-1 участвует в процессах регуляции пищевого поведения, действуя через центральные механизмы, и способствует развитию чувства насыщения [26].
Представители класса ингибиторов ДПП-4 отличаются нейтральным эффектом в отношении массы тела. Их действие основано на обратимом ингибировании ДПП-4. Кроме семейства глюкагона (ГИП – глюкозозависимый инсулинотропный полипептид, ГПП-1) ингибиторы ДПП-4 располагают множеством физиологически родственных субстратов: семейством панкреатических полипептидов (нейропептид Y и петид YY), широким спектром цитокинов (Mig – монокин, индуцируемый интерфероном γ; I-TAC – Interferon-inducible T-cell α chemoattractant; эотаксин; RANTES-фактор – regulated on activation, normal T cell expressed and secreted, экспрессия и секреция которого регулируются при активации нормальных Т-клеток), субстанцией Р. Этим объясняется многогранность эффектов блокады ДПП-4. Умеренное снижение массы тела в части случаев обусловлено физиологическим повышением уровня активной формы ГПП-1. Кроме того, терапия пациентов с СД2 ингибиторами ДПП-4 статистически значимо снижает тощаковый уровень грелина, вырабатываемого главным образом эндокринными клетками желудка и принимающего участие в регуляции пищевого поведения и кишечной моторики. Это также может вносить свой вклад в снижение массы тела [21].
В новых российских рекомендациях предусмотрена возможность более интенсивной терапии даже на старте лечения при исходном уровне НBA1c 7,6–9 %. При этом рассматривается возможность начала лечения с комбинации двух препаратов, включая таковую метформина с ингибиторами ДПП-4. Комбинация метформина с ингибиторами ДПП-4 клинически обоснованна, т.к. она позволяет воздействовать на все основные патогенетические механизмы развития СД2, синергично усиливая и продлевая инкретиновую активность [2]. Так как снижение числа принимаемых таблеток значительно улучшает приверженность пациентов лечению, в клинической практике появились комбинированные препараты с фиксированной дозировкой составляющих их компонентов. К одним из них относится Галвус Мет – комбинация метформина с вилдаглиптином (ингибитор ДПП-4) в дозировках 50 мг вилдаглиптина и 500, 850 и 1000 мг метформина. Препарат применяется в России в течение 5 лет.
Эффективность данной комбинации в отношении контроля гликемии подтверждена в многочисленных международных клинических исследованиях, в т.ч. с участием российских центров.
В данном исследовании планировалось оценить влияние комбинированной терапии на массу и распределение жира у пациентов с СД2, имеющих абдоминальное ожирение, с использованием магнитно-резонансной томографии (МРТ) для визуализации висцеральной жировой ткани. Целью исследования стала оценка эффективности лечения больных СД2 препаратом Галвус Мет.
Материал и методы
Для оценки эффективности комбинированной терапии и ее влияния на распределение жировой массы в исследование были включены 70 пациентов с СД2, стадавших абдоминальным ожирением. Средний возраст составил 57,7 ± 5,5 года. До включения в исследование как минимум три месяца они получали монотерапию метформином в дозе более 1500 мг/сут, не достигая целевых значений гликемии. Степень компенсации углеводного обмена определялась по уровню глюкозы крови натощак и уровню НBA1c. Выраженность ИР определялась с помощью индекса инсулинорезистентности (ИРИ) HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) по формуле:

(N = 1–2,77). Чем выше индекс НОМА, тем ниже чувствительность к инсулину. Для выявления степени ожирения использован ИМТ. Абдоминальное ожирение определено с помощью метода, широко применяемого в настоящее время в рутинной клинической практике: отношение окружности талии к окружности бедер (ОТ/ОБ). Свидетельством накопления жировой ткани в абдоминальной области служил коэффициент ОТ/ОБ: у мужчин > 1,0, у женщин > 0,85. Косвенным показателем абдоминально-висцерального ожирения также считалась окружность талии > 100 см в возрасте до 40 лет и > 90 см в возрасте 40–60 лет как у мужчин, так и у женщин [24]. Определение характера распределения жировой ткани в абдоминальной области проведено с помощью МРТ. Использован аппарат Magnetom Impact (Siemens, Германия) с напряженностью поля 1,0 Тесла. Метод предложен Van der Kooy и J.C. Seidell (1993). Исследование проведено утром натощак. Пациенты находились в положении лежа на спине. Полученные изображения в аксиальной проекции на уровне 1–5-го поясничных позвонков (L1 – L5) обработаны с помощью программных средств системы Numaris 3.0. На каждом срезе определена площадь подкожного и висцерального жира. При площади висцерального жира на уровне L4 130 см² и более пациентов относили к висцеральному типу ожирения. Следующим этапом пациенты были разделены на две группы методом случайной выборки. Основную группу составили 40 пациентов, группу сравнения – 30.
С целью компенсации углеводного обмена пациентам основной группы к терапии был добавлен препарат вилдаглиптин в дозе 100 мг/сут, а пациентам группы сравнения – препарат глибенкламид в дозе от 3,5 до 7,5 мг/сут. Повторный контроль антропометрических, лабораторных и инструментальных исследований проведен через 6 месяцев от начала комбинированной терапии. Статистическая обработка данных осуществлена с помощью пакета прикладных программ Statistica 6.0, для оценки достоверности различий применены методы описательной статистики, сравнение двух связанных групп до и после проведен с помощью непараметрического метода критерия Вилкоксона. Для оценки различий между параметрами несвязанных групп использован U-критерий Манна–Уитни. Все пациенты подписали информированное согласие. Субъективный статус (жалобы, результаты первичного осмотра) оценены с помощью специально подготовленного опросника.
Результаты и обсуждение
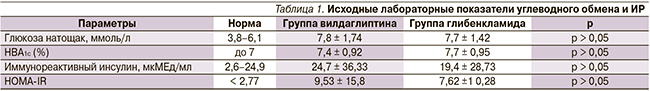
У всех пациентов, включенных в исследование, исходно уровень глюкозы и НbA1c превышал целевые показатели. Среднее значение HOMA-IR также служило косвенным показателем периферической ИР. Статистически значимых различий между группами не отмечено. Результаты первичного клинико-лабораторного исследования представлены в табл. 1.
Все пациенты страдали избыточной массой тела (ИМТ – от 25 до 29,9 кг/м2) или ожирением I степени (ИМТ – от 30–34,9 кг/м2). Средняя масса тела в основной группе составила 91,5 ± 13,3, в группе сравнения 91,9 ± 12,3 кг.
Средний ИМТ в основной группе составил 31,69 ± 2,72, в группе сравнения – 32,2 ± 2,85 кг/м². Характер распределения массы тела соответствовал абдоминальному типу независимо от половой принадлежности. Исходно у всех (100 %) пациентов выявлено абдоминальное ожирение. Отношение ОТ/ОБ у женщин в среднем составило 0,87 ± 0,04 (норма – не более 0,85), у мужчин ∆ = 1,04 ± 0,06 (норма – не более 0,9). Проведенная МРТ подтвердила наличие висцерального типа распределения абдоминального жира в обеих группах как у мужчин, так и у женщин. Площадь висцерального жира на уровне L4 поясничного позвонка превысила 130 см² у всех пациентов.
Через 6 месяцев комбинированной терапии отмечено существенное улучшение показателей углеводного обмена в обеих группах. Уровень НbA1c снизился в среднем на 0,6 % в обеих группах. Снижение уровня гликемии натощак достоверно различалось между группами (р < 0,05). В основной группе глюкоза натощак в среднем снизилась на 1,0 (р < 0,0001), в группе сравнения – на 0,5 ммоль/л (р < 0,001).
За период наблюдения случаев гипогликемии в основной группе не отмечено. В группе сравнения подтвержденные гипогликемические эпизоды были зарегистрированы однократно у 5 пациентов, дважды у 1 пациента. Все эпизоды были связаны с погрешностями в режиме приема пищи, носили легкий симптоматический характер и не требовали коррекции терапии. Полученные результаты согласуются с данными клинических исследований, в которых у пациентов с неудовлетворительным контролем СД2 на фоне применения метформина добавление вилдаглиптина обеспечило достоверное снижение уровня НbA1c (до 1,1 %) при минимальном риске гипогликемий [2].
На фоне проводимой терапии в данном исследовании получены статистически значимые различия между показателями массы тела в основной группе, которая снизилась в среднем на 2,4 кг (р < 0,009). В группе сравнения масса тела статистически значимо не изменилась. Это согласуется с результатами проводимых оригинальных исследований, в которых комбинированная терапия метформином и вилдаглиптином была нейтральной в отношении массы тела либо способствовала ее снижению, тогда как комбинация метформина с производными сульфонилмочевины чаще демонстрировала прибавку массы тела.
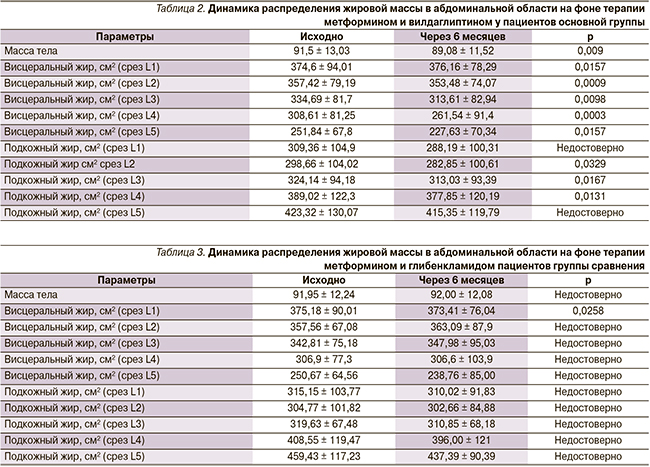
Средние величины площади висцерального и подкожного жира на уровне поясничных позвонков в основной группе до назначения препарата Галвус Мет и через 6 месяцев терапии представлены в табл. 2, в группе сравнения до назначения комбинации метформина с глибенкламидом и через 6 месяцев терапии представлены в табл. 3.
Большинство авторов отмечают, что наиболее важным показателем висцерального ожирения при томографических методах исследования висцерального ожирения является площадь, занимаемая висцеральным жиром на определенном уровне, измеренная на одном срезе [29, 30]. Кроме того, при определении продольного уровня необходимо ориентироваться на скелет [31]. В исследовании спустя 6 месяцев от начала комбинированной терапии в основной группе мы получили статистически значимое уменьшение площади висцерального жира на уровне пяти поясничных позвонков. Наиболее часто для визуализации жира абдоминальной области используется аксиальная проекция снимка висцерального жира на уровне L4. На том же уровне находится наибольший процент жира и лучше прослеживается разграничение подкожного и абдоминального жира, кроме того, данный уровень в большей степени коррелирует с общим объемом висцерального жира [32].
B. Сhowdhury (1994) доказал возможность использования этой методики для пролонгированных исследований, получив высокую корреляцию между повторными исследованиями после изменения положения пациента с погрешностью: для значения объема общей абдоминальной жировой ткани – 1,2 %, для подкожной – 1,9, для висцеральной жировой ткани – 3,9 %.
Из этого следует, что снижение общей массы тела на фоне проводимой терапии метформином и вилдаглиптином, вероятно, в большей степени происходит за счет объема скорее висцерального, чем подкожного, жира.
В группе сравнения на фоне проводимой терапии статистически значимые различия площади висцерального жира отмечены, но только на уровне L1. Не было получено статистически значимых различий между массой тела и площадью подкожного жира в абдоминальной области.
В основной группе также получены статистически значимые различия между показателями иммунореактивного инсулина и HOMA-IR, что косвенно свидетельствует об уменьшении степени ИР.
Причина уменьшения ИР на фоне проводимой терапии может быть обусловлена достижением компенсации углеводного обмена и снижением глюкозотоксичности. Однако с учетом отсутствия достоверного изменения индекса HOMA-IR в группе сравнения в отличие от основной группы можно предположить, что большую роль в уменьшении периферической ИР играет уменьшение массы тела, а именно: уменьшение площади висцеральной жировой ткани, подтвержденное результатами МРТ. Длительное влияние повышенных концентраций свободных жирных кислот (СЖК) в сыворотке крови ведет к пассивному поглощению полярных СЖК путем диффузии с помощью специфичных транспортных белков клеточных мембран. Компенсаторное поглощение пропорционально содержанию СЖК во вне клеточной среде полярных СЖК и нарушает активное (рецепторное) поглощение неполярных СЖК, что приводит к резистентности миоцитов и адипоцитов к инсулину [28].
Заключение
С точки зрения патогенеза СД2 применение вилдаглиптина пациентами с абдоминальным типом ожирения оправданно в большей степени, чем производных сульфонилмочевины. С учетом необходимости контроля не только углеводного, но и жирового обмена использование комбинации метформина и ингибитора ДПП-4 (вилдаглиптина) улучшает компенсацию углеводного обмена без возрастания риска гипогликемий, при этом отмечается уменьшение периферической ИР на фоне снижения массы тела преимущественно за счет уменьшения объема висцерального жира.
Таким образом, комбинированная терапия метформином и вилдаглиптином оптимальна, т.к. синергично усиливает терапевтические эффекты, воздействует на все основные патогенетические механизмы развития СД2 с минимальным риском побочных эффектов, способствуя замедлению прогрессирования СД2.
Полученные данные дают основания предлагать применение ингибиторов ДПП-4 как препаратов выбора на втором этапе терапии пациентов с СД2 и абдоминальным ожирением.


