Вакцинопрофилактика более чем за 200 лет существования доказала свою эффективность. Практически наиболее успешной стала программа ликвидации натуральной оспы. Это и определило появление международных программ. Выделяя цели тысячелетия, ООН в качестве четвертой обозначила сокращение детской смертности и назвала вакцинацию одним из путей ее решения [1]. В 2010 г.
ООН были сформулированы направления деятельности, обозначенные как приоритетные для всех правительств: обеспечение равного доступа к службе иммунизации и улучшение ее применения за счет оптимального сочетания стратегий; укрепление процесса принятия (…) решений по иммунизации посредством использования механизмов, позволяющих расширять возможности правительства; обеспечение хорошей подготовки специалистов по иммунизации, доступа к услугам, безопасности, доступности и правильного использования вакцин; мобилизация внутренних и дополнительных внешних ресурсов для выполнения целевых задач иммунизации; восстановление и поддержание доверия общественности к иммунизации как одному из наиболее безопасных и эффективных способов вмешательств в сфере охраны здоровья, а также поддержание высокого уровня охвата существующими вакцинами [2]. Текущее десятилетие (2011–2020) ВОЗ объявила Десятилетием вакцин [3–5].
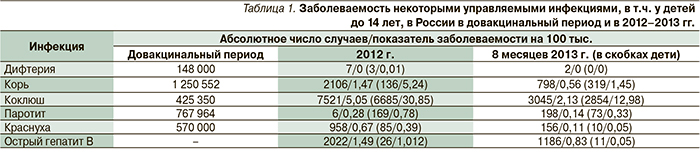
В России история вакцинации начинается с 1768 г., когда по приказу Екатерины II была проведена первая вариоляция, а в 1801 г. в Московском воспитательном доме профессор Московского университета Е.О. Мухин сделал первую вакцинацию полученной от Дженнера вакциной. Активно вакцинопрофилактика начала развиваться с середины ХХ в., и за прошедшие годы были выявлены ее положительные и отрицательные стороны. От науки эмпирической она пришла к методам доказательной медицины. Нет более массового мероприятия профилактической медицины, проводимого повсеместно. Тезис, будто сформирована вакцинозависимая популяция, несомненен, т.к. уже выросли поколения, у которых иммунитет к инфекциям образовался в результате не болезни, а вакцинации. Высокий уровень коллективного иммунитета, достигнутый в результате 95–99 %-ной привитости детей в декретированном возрасте и вакцинацией взрослых в рамках национальных программ, определил изменения закономерностей эпидпроцесса управляемых инфекций, создал условия для их ликвидации. В результате массовой иммунизации в нашей стране ликвидированы полиомиелит, дифтерия, снизилась заболеваемость краснухой, острым гепатитом В (табл. 1) [6]. Однако инфекции никуда не исчезли, что четко демонстрирует перенос сроков полной ликвидации полиомиелита с 2000-го на 2018 г. [7], подъем заболеваемости коклюшем в США и других странах [8–11], ситуация с корью, вспышки которой отмечаются за последние несколько лет как в Европе, так и в нашей стране [6, 12]. Причиной этих «неудач» вакцинации в первую очередь считается снижение уровня привитости. Так, в Европе в результате отказов от прививок накопилось значительное число незащищенных, и в 2011 г. за 9 месяцев было зарегистрировано 27 970 случаев кори, включая 24 энцефалита и 8 летальных исходов [12]. Это свидетельствует о том, что инфекция не изменилась и у одного из 1000 заболевших развивается энцефалит с соответствующими последствиями в виде интеллектуальных нарушений. Корь до настоящего времени остается причиной смерти детей [13]. Если не проводить прививки, нас вновь ждут тяжелые заболевания.
В нашей стране отмечен также завоз полиомиелита из Таджикистана в 2010 г.
По данным Роспотребнадзора [6], в Российской Федерации в 2011–2012 гг. возникли вспышки кори (в 2011 г. 627 случаев в 30 субъектах РФ, в 2012 г. – 2123 в 58 субъектах). Остается достаточно высокой заболеваемость коклюшем. В 2012 г. зарегистрировано 7220 случаев коклюша, в т.ч. 6941 у детей до 17 лет включительно (2011 г. – 4733 и 4582, в 2010 г. – 4795 и 4638 случаев соответственно). В структуре заболеваемости коклюшем доля детей до 17 лет на протяжении последних трех лет составляет 96–97 %. Максимальные показатели заболеваемости выявлены среди детей до 1 года – 87,6 на 100 тыс. (2011 г. – 61,6 и 2010 г. – 56,88). Это обусловлено отсутствием прививок против коклюша у детей и незаконченным курсом вакцинации из-за медицинских отводов или отказов родителей. Возросло и число школьников 6–10 лет, заболевших коклюшем. Это связано с тем, что после первичного комплекса прививок (вакцинации и первой ревакцинации), проводимых АКДС-вакциной у детей до 4 лет, иммунитет формируется только у 80–90 % привитых и сохраняется не более 4–6 лет [14]. Утрата иммунитета у ранее привитых приводит к заболеваемости легкими стертыми формами коклюша школьников, подростков, взрослых, а они заражают детей до 1 года, не получивших полного курса прививок, у которых могут возникать тяжелые формы инфекции. Решить проблему позволяют ревакцинации школьников и взрослых каждые 10 лет без ограничения возраста (в календаре США последняя ревакцинация предусмотрена в 65 лет), а в отсутствие плановых ревакцинаций – введение т.н. кокон-иммунизации, т.е. вакцинации всех взрослых (родители, дедушки, бабушки, братья, сестры, медицинские работники), которые будут контактировать с новорожденным, а также иммунизация беременных женщин в последнем триместре беременности (это рекомендуется в настоящее время в США) [15–17]. Однако для иммунизации взрослых против коклюша должна использоваться бесклеточная вакцина, т.к. цельноклеточная при повторном использовании в этой популяции способна вызывать побочные эффекты из-за более высокой реактогенности [18].
Выводы, сделанные из многолетнего опыта программ вакцинации, свидетельствуют о необходимости поддержания высокого уровня защищенности как за счет своевременных вакцинаций и ревакцинаций детей и подростков, так и путем совершенствования календаря прививок, введения дополнительных прививок взрослым и расширения спектра профилактируемых инфекций.
Календарь прививок России в настоящее время существенно отличается от таковых большинства экономически развитых стран и от календаря, рекомендованного ВОЗ всем странам вне зависимости от их экономического развития, в который для детей первого года жизни входят профилактика гемофильной типа В (ХИБ), пневмококковой, ротавирусной инфекций и для подростков – вакцинация против вируса папилломы человека (ВПЧ) [19]. Календари прививок Европы, Канады, Австралии, США и многих других стран мира включают не только профилактику этих инфекций, но и вакцинацию против ветряной оспы, менингококковой инфекции; иммунизация детей первых лет проводится комбинированными препаратами на основе бесклеточных коклюшных вакцин.
В нашей стране вакцинация против ХИБ предусмотрена сегодня только для детей с дефектами иммунитета и онкологических больных, проживающих в закрытых детских коллективах [20]. Однако к группе риска по развитию ХИБ, а также пневмококковой инфекции относятся все дети первых лет жизни. В 2008 г. 136 стран – членов ВОЗ проводили массовую, а не выборочную, как у нас, вакцинацию детей раннего возраста. Это позволило сократить число случаев смерти, обусловленных ХИБ, с 371 тыс. в 2000 г. до 203 тыс. в 2008-м.
В 2012 г. прививки проводят детям начиная с 2-месячного возраста уже в 173 из 230 стран мира [21]. Вакцинация пре-дупреждает тяжелые инвазивные формы заболевания, такие как сепсис, менингит, и неинвазивные, в первую очередь пневмонию. Вакцины, используемые для профилактики ХИБ, являются конъюгированными полисахаридными, выпускаются как в моноварианте, так и в виде комбинированных препаратов. Их относят к числу высокобезопасных: при применении ХИБ-вакцин практически отсутствуют серьезные нежелательные явления. Исследования, проведенные в нашей стране в 2001–2006 гг.
в Ярославле, Казани, Краснодаре, Екатеринбурге и Тюмени, показали, что заболеваемость ХИБ-менингитами колеблется от 5,1 до 9,7 случая в год на 100 тыс. Эти данные были подтверждены в 2004–2008 гг. в городах европейской части РФ, Сибири и на Дальнем Востоке. Доля менингитов, вызванных ХИБ, составляла 10–55 % (в среднем 25 %) всех бактериальных менингитов. Заболеваемость варьировалась от 1,6 (Якутск) до 20,0 (Тула) на 100 тыс. детей младше 5 лет в год. Точная частота пневмоний, связанных с этим возбудителем, неизвестна, но предполагают, что 5–10 % всех пневмоний у детей до 5 лет обусловлены ХИБ и, следовательно, заболеваемость ХИБ-пневмонией в РФ составляет не менее 150 на 100 тыс. детей младше 5 лет [22–25]. Это определяет необходимость изменения календаря прививок и распространения вакцинации против ХИБ на всех детей первого-второго года жизни с перспективой т.н. нагоняющей иммунизации для детей до 5 лет.
С 2014 г. в соответствии с законом РФ «Об иммунопрофилактике инфекционных болезней» [26] наш календарь прививок будет расширен и вводится вакцинация детей первого года жизни конъюгированной вакциной против пневмококковой инфекции. Впервые о необходимости профилактики пневмококковой инфекции для всех стран ВОЗ высказалась в 2005 г., опубликовав следующие данные: более 1,6 млн человек умирают ежегодно от заболеваний, вызванных пневмококком; в т.ч. 716 тыс. в возрасте до 5 лет, в основном младше 2 лет. ВОЗ назвала пневмонию «убийцей детей № 1» и с 2009 г. реализует программу предупреждения пневмоний, в который большой раздел посвящен иммунизации против инфекций, вызывающих пневмонию (коклюш, грипп, корь, ХИБ, пневмококковая инфекции) [27]. Пневмококк – основной возбудитель пневмоний, причем пневмококковая инфекция, как и ХИБ, проявляется в виде инвазивных (менингит, бактериемия, септические пневмонии) и неинвазивных (отит, пневмония, бронхит, синуситы) форм [28]. Их частота колеблется от 10–100 в Европе до 1000 на 100 тыс. человек среди австралийских аборигенов. Заболеваемость зависит от возраста, являясь максимальной для детей до 2 лет и пожилых людей. Так, по данным США, показатель заболеваемости среди детей 6–11 месяцев составляет 235, от 0 до 12 – 165, от 12 до 23 – 203, старше 7 лет – 6,1 на 100 тыс. человек; среди лиц 45–64 лет – 2,8–10,1, а старше 65 – 18,3 на 1000 человек, причем в этой возрастной группе пневмония с бактериемией в 10–60 % случаев приводит к летальному исходу [29]. Основная группа детей, страдающих от пневмококка, – дети первых двух лет жизни, что было известно давно, но эффективную профилактику оказалось возможным осуществлять только после создания конъюгированных вакцин (с 2000 г.) [30]. Проведенные за последние годы в разных регионах России исследования подтвердили, что в нашей стране, как и в других странах мира, в 55–76,9 % случаев острый средний отит вызван пневмококком в виде моноинфекции или в сочетании с другими бактериальными агентами [31–33]. Роль пневмококка в этиологии пневмонии установить сложно. Культуральное подтверждение пневмококковой этиологии этого заболевания при высеве из крови составляет 3–30 %, легочный аспират дает высев в 52 % случаев. Однако после введения массовой иммунизации конъюгированной пневмококковой вакциной в США, Европе и в других странах произошло снижение частоты рентгенологически подтвержденных случаев пневмонии среди детей до 70 % [34]. Это позволяет предполагать, что до 70 % пневмоний – пневмококковой этиологии. Установлен пейзаж серотипов, наиболее часто вызывающих пневмонии и отиты у детей, определено его соответствие 10- и 13-валентным конъюгированным вакцинам, зарегистрированным в мире и России [33, 35, 36]. В настоящее время обе конъюгированные вакцины применяют к детям до 5-летнего возраста, для 13-валентной вакцины показания в последние годы расширены, ее используют и лица старше 50 лет. Пневмококковая инфекция опасна не только для детей, но и для лиц ≥ 65 лет, а также для страдающих хроническими заболеваниями легких, сердца, почек, печени, онкологических больных, пациентов с иммунодефицитными состояниями, курящих вне зависимости от возраста. Заболеваемость в группах риска в 10–100 раз выше, чем среди здоровых того же возраста. Это определяет рекомендации по их селективной иммунизации. Для вакцинации групп риска и пациентов старше 65 лет используют полисахаридную 23-валентную вакцину, и многие страны рекомендуют ее в календарях прививок. Полисахаридные вакцины используют в мире с 1983 г. В России также накоплен значительный опыт их применения. Поскольку 13-валентная конъюгированная вакцина зарегистрирована для применения взрослыми старше 50 лет, она также может применяться пациентами групп риска. В календаре США все детям с высоким риском пневмококковой инфекции старше 2 лет после полного курса прививок конъюгированной вакциной рекомендуется однократное введение полисахаридной 23-валентной вакцины, а подросткам и взрослым – сначала одна доза конъюгированной, а через 8 недель – одна доза полисахаридной вакцины [15]. В календаре прививок нашей страны вакцинация групп риска и лиц старшего возраста против пневмококка пока не предусмотрена, но эта мера может быть реализована в рамках региональных программ или в индивидуальном порядке самими пациентами, если врачи будут их информировать о такой необходимости.
Кроме профилактики пневмоний ВОЗ считает высокоактуальным предупреждение диарей у детей [37]. Ведущей причиной гастроэнтеритов у детей младше 5 лет во всем мире являются ротавирусы. По оценкам, проведенным в 1986–2000 гг., ротавирусная инфекция (РВИ) была причиной 111 млн эпизодов гастроэнтеритов, 25 млн визитов к врачам, 2 млн госпитализаций и 592 тыс. летальных исходов. К двум годам практически каждый ребенок переболевает РВИ, 1 из 5 заболевших требует обращения к врачу, 1 из 65 – госпитализации и 1 из 293 погибает от обезвоживания. В странах Евросоюза РВИ ежегодно является причиной 3,6 млн заболеваний среди 23,6 млн детей до 5 лет, более 87 тыс. госпитализаций, 700 тыс. амбулаторных визитов к врачам и 231 случая смерти [38, 39]. В России за последние 3 года заболеваемость РВИ стабилизировалась на высоких показателях: 69,6–72,0 на 100 тыс. населения. В 2012 г. зарегистрированы более 100 тыс. заболевших, показатель заболеваемости составил 70,6 на 100 тыс. населения. Наиболее поражаемым контингентом при РВИ являются дети до 14 лет, составляющие 90,8 % в ее структуре, причем на долю детей до 3 лет приходится 66,2 % всех заболевших. По данным Референс-центра по мониторингу возбудителей кишечных инфекций, наибольшую распространенность имели G4[P]8 и G1[P]8 генотипы ротавирусов [6]. В настоящее время в мире лицензированы 2 ротавирусные вакцины: моновалентная человеческая и пятивалентная бычья-человеческая реассортантная. В РФ зарегистрирована только пятивалентная вакцина. ВОЗ рекомендует включить ротавирусную вакцину для детей младенческого возраста в национальные программы иммунизации всех стран мира и рассматривать ее как приоритет. К 2012 г. почти 40 стран внедрили вакцинацию против РВИ в национальные календари прививок. В США к 2008 г. за два года применения пятивалентной вакцины в календаре было зарегистрировано снижение частоты оказания медицинской помощи по поводу ротавирусных гастроэнтеритов и любых острых кишечных инфекций как в амбулаторном, так и в госпитальном звене. Защита от госпитализаций и обращений за неотложной медицинской помощью по поводу ротавирусных гастроэнтеритов составила 100 %, а по поводу любых острых кишечных нфекций – 59 % [40].
Не включена в отечественный календарь и профилактика папиломавирусной инфекции, ответственной за развитие генитальных кондилом и онкологических заболеваний, в первую очередь 90 % случаев рака шейки матки. Эффективность и безопасность иммунизации доказаны не только на этапе клинических исследований, но и при тщательном наблюдении после включения вакцин в календарь прививок в Австралии, США и европейских стран. Первой страной, достигшей практически полного исчезновения кондилом у привитых и резкого уменьшения их распространенности в популяции в целом, а также снижения частоты предраковых поражений шейки матки, была Австралия [41–44]. Безопасность вакцин против ВПЧ – важное положение, о котором необходимо знать прежде всего врачам, чтобы аргументированно предотвращать слухи о вреде этой вакцинации. Необходимость проведения прививок против ВПЧ в нашей стране определяется высокой частотой заболеваемости. По данным на 2010 г., в России рак шейки матки занимал 6-е место в структуре заболеваемости женщин злокачественными новообразованиями и 9-е – в структуре смертности; было зарегистрировано 14 719 новых случаев и умерли 6193 женщины [45]. Стандартизованный показатель заболеваемости колеблется от 10 до 28 на 100 тыс. в различных регионах России. Поскольку ВПЧ – вакциноуправляемая инфекция со сходным, например, гепатиту В путем передачи, она могла бы быть сведена к единичным случаям, как это произошло с острым гепатитом В. На сегодняшнем этапе важна широкая информационная работа для формирования понимания необходимости ВПЧ-вакцинации как врачами и организаторами здравоохранения, так и населением.
В современных условиях появилась возможность вакцинировать детей и взрослых против ветряной оспы – заболевания, которое из года в год остается одной из наиболее распространенных инфекций, тяжело протекает у подростков, взрослых, лиц с иммунодефицитными состояниями, может быть причиной летальных исходов, врожденных уродств и вызывает экономические потери – большие, чем грипп. Назрела необходимость оценки сравнительной эффективности программ иммунизации против гепатита А, менингококковой инфекции: массовая или селективная иммунизация наиболее целесообразна, тем более что в мире появились, хотя пока и не зарегистрированы в России, вакцины против менингококков 5 основных серогрупп: А, В, С, W135, Y, для детей первого года жизни, подростков и взрослых.
Одной из актуальных проблем модернизации календаря прививок является полный переход на инактивированную полиомиелитную вакцину для вакцинации и ревакцинации детей первых лет жизни. Проведение первых двух прививок инактивированной вакциной в календаре последних лет позволило снизить число осложнений, связанных с живой оральной вакциной, т.е. число вакцинассоциированных паралитических полиомиелитов (ВАПП) у привитых и контактных с ними непривитых детей (с 1998 по 2008 г. в стране зарегистрировано 108 случаев ВАПП). Однако сохранение третьей прививки и ревакцинаций с использованием живой вакцины сохраняет риск развития ВАПП у контактных с привитыми детей и поддерживает механизм формирования вакцинородственных штаммов, которые, как показал мировой опыт, также вызывают вспышки паралитических заболеваний. Поэтому ВОЗ считает необходимым постепенный переход на инактивированную вакцину во всех странах мира к 2018 г. [7].
Увеличение возможностей вакцинопрофилактики, рост числа применяемых вакцин приводят к увеличению числа инъекций, что неизбежно ставит вопрос о безопасности вакцинации и переходе на иммунизацию комбинированными вакцинами. Они имеют ряд преимуществ: уменьшается число инъекций, количество дополнительных веществ (консервантов, стабилизаторов), которые ребенок получает с каждой дозой вакцины; при этом не страдает специфический иммунный ответ на все компоненты комбинированной вакцины, поскольку их соотношение сбалансированно. Иммунологическое обоснование применения комбинированных вакцин хорошо известно. За счет реаранжировки генов человек может синтезировать 109–1011 разных антител. Расчеты показывают, что индивид способен ответить на 105 вакцин, введенных одномоментно [18]. Развитие иммунологии и аллергологии привело к пониманию того, что «использование живых рекомбинантных, а также многих убитых вакцин обеспечивает стимуляцию клеточного ответа» и «существует (…) теоретическое обоснование для применения бактериальных вакцин в лечении аллергических заболеваний» [46].
Конечно, вакцины – вещества, не безразличные организму и в редких случаях становятся причиной осложнений, или иначе – серьезных нежелательных явлений (serious adverse effect – SAE – общепринятый в мире термин). Для объективной оценки безопасности вакцин во всем мире проводится мониторинг этих состояний. Однако их классификации, используемые в нашей стране и за рубежом, различаются, что не позволяет полностью сопоставить данные. В России существует система активного надзора за поствакцинальными осложнениями, но в отличие от системы пассивного надзора по спонтанным сообщениям, принятой во всем мире, у нас ежегодно регистрируется не более 600–700 случаев подозрений на нежелательные явления [47] в отличие от США, где ежегодно подается до 10–15 тыс. спонтанных сообщений.
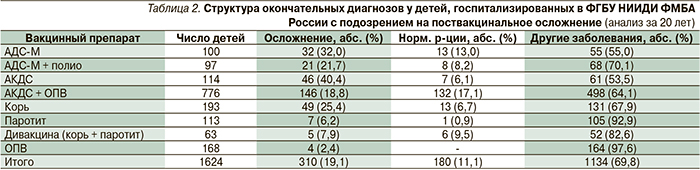
В большинстве случаев у привитых возникают случайные заболевания, связанные с прививкой только временным фактором. Наблюдения ФГБУ НИИДИ за многие годы показывают высокую безопасность отечественных вакцин [48] (табл. 2). Действительно, побочные эффекты вакцин составляют не более 2 % от побочных воздействий фармпрепаратов, но внимание к ним более пристальное со стороны как медиков, так и общественности. Поэтому полный учет нежелательных явлений, оценка их причин, гласность при расследовании и заключении о наличии или отсутствии связи каких-либо патологических состояний с введенной вакциной – важнейший механизм увеличения доверия к вакцинации со стороны медиков и населения в целом.
Конечно, невозможно одномоментно проводить внедрение всех существующих вакцин в наш календарь, т.к. сегодня они не выпускаются отечественной промышленностью, а препараты, включенные в национальный календарь, приобретаются за счет федерального бюджета. Поэтому такое решение требует клинических, эпидемиологических и фармакоэкономических обоснований.
Существует возможность защитить детей от большего числа инфекций за счет региональных программ или календарей, как это осуществляется в Москве, Санкт-Петербурге, Свердловской и Смоленской областях, Тюмени, Сургуте, Республике Саха и многих других регионах. Однако нет никаких документов, юридически регламентирующих правомочность массового применения в регионах вакцин, не включенных в календарь, в т.ч. в его раздел иммунизации по эпидемическим показаниям.
Перспективой развития вакцинопрофилактики является и создание календаря прививок для пациентов с различными хроническими заболеваниями (иммунодефицитами, онкологическими заболеваниями и т.д.) людей, ведущих особый образ жизни (путешественников и др.).
Вакцинопрофилактика – активно развивающаяся отрасль медицины, задача которой: улучшение качества жизни человека за счет предупреждения инфекций и их осложнений. В XXI в. вакцинопрофилактика будет включать не только профилактические, но и лечебные вакцины, возрастет число вакцин против вирусных, в т.ч. персистирующих, инфекций. Все это повлечет за собой изменения календаря прививок; совершенствование эпидемиологического надзора с использованием современных молекулярно-генетических методов контроля за инфекциями; создание единой информационной сети по вакцинопрофилактике в регионах и в целом в стране с базой данных о контингентах, привитости, нежелательных явлениях; совершенствование законодательной базы вакцинопрофилактики; развитие региональных программ иммунизации.


