Введение
Рвота (и тошнота – субъективное ощущение «боли в желудке», предшествующее рвоте) – один из защитных рефлексов организма, который проявляется насильственным ретроградным изгнанием содержимого желудка через рот. Данные симптомы являются частым проявлением кишечных инфекций. В то же время следует помнить, что возникновение рвоты в комплексе с другими симптомами может говорить о течении определенного заболевания, не всегда связанного с желудочно-кишечным трактом. Рвота служит косвенной причиной большого числа госпитализаций, особенно детей раннего возраста [1]. По данным когортного исследования в США (2004), около 3% обращений в отделение неотложной помощи происходит по причине рвоты, при этом 75% этих визитов среди детей младше 15 лет [2].
Наиболее частой причиной рвоты у детей являются острые гастроэнтериты (ОГЭ), которые также ассоциируются с болью в животе, диареей и лихорадкой [3]. Это, как правило, самоограниченные инфекции – чаще вирусной этиологии, такой как рота- или норовирус [3, 4]. Рвота встречается в 77% случаев ротавирусной инфекции – РВИ [5].
Однократная рвота может не иметь последствий. Многократная же в совокупности с диареей может стать причиной быстрого развития обезвоживания и электролитных нарушений. С потерей воды связана и потеря минералов, например натрия, что может приводить к серьезным последствиям, в т.ч. таким, как отек головного мозга. При наличии дисфагии рвота может стать причиной аспирации, а в некоторых случаях и асфиксии. Невозможность восполнения потерь с помощью пероральной регидратации по причине рвоты может приводить к необходимости внутривенной регидратации и госпитализации.
Патогенез синдрома рвоты достаточно сложен. Он контролируется серотонинергическими, дофаминергическими, гистаминовыми и мускариновыми рецепторами. По этой причине и механизм действия многочисленных противорвотных средств (ПРС) различен. Есть антагонисты серотониновых (ондансетрон), гистаминовых (прометазин), дофаминовых (метоклопрамид и триметобензамид) рецепторов [1, 6]. В российских стандартах специализированной медицинской помощи детям (МЗ РФ, 2012) со среднетяжелыми и тяжелыми формами острой кишечной инфекции в качестве антиэметиков рекомендовано два препарата: домперидон и метоклопрамид. По нашим данным, их введение не прекращает серийную рвоту, наблюдаемую при РВИ. Помимо этого метоклопромид обладает редкими побочными эффектами, такими как сонливость, экстрапирамидные реакции, галлюцинации, судороги и злокачественный нейролептический синдром.
Для подавления рвоты на фоне цитостатической, химио- и радиотерапии в отношении пациентов с онкологией применяются препараты группы сильнодействующих селективных антагонистов серотонинергических рецепторов 5-НТ3 (ондансетрон, трописетрон). Ондансетрон безопасен и эффективен в предотвращении и химиотерапии- , и радиационно-индуцированных тошноты и рвоты, а также рвоты у пациентов в послеоперационном периоде. При использовании данных препаратов в этих клинических случаях существует очень низкий риск серьезных побочных эффектов [9–13].
 Опубликованы результаты мета-анализа 11 статей, в которых оценивалась эффективность ондансетрона, домперидона, триметобензамида, пириламина фенобарбитала, метоклопрамида, дексаметазона и прометазина [14]. Исследователи пришли к выводу, что ондансетрон – единственный ПРС с доказанной эффективностью для снижения частоты рвоты при гастроэнтерите. Другие ПРС не продемонстрировали аналогичной эффективности и, следовательно, не были рекомендованы к применению. По результатам ряда исследований, применение ондансетрона значительно снижает риск развития упорной рвоты (относительный риск [ОР]=1,34), частоту парентеральной регидратации (ОР=0,41) и связанной с ней госпитализации у детей с ОГЭ (ОР=0,40) [15–20]. Ондансетрон (либо за неимением его другие антиэметики) следует назначать только в случаях, когда рвота препятствует проведению пероральной регидратационной терапии [21, 22].
Опубликованы результаты мета-анализа 11 статей, в которых оценивалась эффективность ондансетрона, домперидона, триметобензамида, пириламина фенобарбитала, метоклопрамида, дексаметазона и прометазина [14]. Исследователи пришли к выводу, что ондансетрон – единственный ПРС с доказанной эффективностью для снижения частоты рвоты при гастроэнтерите. Другие ПРС не продемонстрировали аналогичной эффективности и, следовательно, не были рекомендованы к применению. По результатам ряда исследований, применение ондансетрона значительно снижает риск развития упорной рвоты (относительный риск [ОР]=1,34), частоту парентеральной регидратации (ОР=0,41) и связанной с ней госпитализации у детей с ОГЭ (ОР=0,40) [15–20]. Ондансетрон (либо за неимением его другие антиэметики) следует назначать только в случаях, когда рвота препятствует проведению пероральной регидратационной терапии [21, 22].
Однако до последнего времени препараты данной группы не были рекомендованы для применения повсеместно. Еще в 2008 г. ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) из-за малого числа исследований не рекомендовал их систематически [7]. В новых рекомендациях 2014 г. ондансетрон был включен в основные методы лечения рвоты при остром ОГЭ, однако рекомендовано применять его с осторожностью при наличии гипокалиемии и гипомагниемии в связи с риском осложнений в виде нарушения сердечного ритма [8].
Ондансетрон доступен в пероральной, парентеральной и ректальной формах, он хорошо переносится из-за отсутствия седативного эффекта или экстрапирамидных реакций [24–26]. Во избежание побочных эффектов эксперты рекомендуют дозу 0,15 мг/кг, но не чаще, чем каждые 4 часа (3 введения) и не более 8 мг [27]. Наиболее распространенным побочным эффектом ондансетрона является диарея, которая, как правило, выражена незначительно и купируется без дополнительного лечения [28–30]. Пероральная регидратационная терапия должна быть начата через 1–30 минут после введения ондансетрона [31].
В нашей клинике эти препараты (ондансетрон, трописетрон) исследовались в качестве препаратов с 2002 г., но применялись спорадически у детей с наиболее тяжелой рвотой (имеется описание предварительного опыта применения [23]). Систематически ондансетрон стал применяться в нашей клинике с 2013 г., а в 2014 г. ESPGHAN также включил данный препарат в рекомендации по лечению ОГЭ. Накопленный опыт показал целесообразность, эффективность и безопасность применения ПРС данной группы с противорвотной целью.
Целью исследования было изучение результатов применения ПРС данной группы при РВИ у детей.
Материал и методы
Было проведено ретроспективное открытое наблюдательно-сравнительное исследование. В исследование были включены две группы: 60 детей для ретроспективного анализа и 100 – для проспективного анализа.
Критерий включения: дети в возрасте от рождения до 18 лет с лабораторно подтвержденной ротавирусной этиологией ОГЭ. Критерии исключения: гастроэнтерит другой этиологии, воспалительные заболевания кишечника и другие заболевания желудочно-кишечного тракта.
Исследование выполнено на базе отделения диагностики и восстановительного лечения ФГАУ НЦЗД Минздрава РФ в период с 2002 по 2007 г. и с 2013 по 2015 г.
Лечение детей проводилось в соответствии со стандартами, рекомендованными ESPGHAN [33] и Всемирной организацией здравоохранения [34]. Терапия включила регидратацию глюкозо-солевыми растворами, ПРС (ондансетрон, трописетрон), пеногасители (симетикон), пробиотики, спазмолитики (ситуационно). Всем детям назначалась пероральная регидратация глюкозо-солевым раствором; в зависимости от степени дегидратации и возможности проведения пероральной регидратации дети получали парентеральную регидратацию через периферический венозный катетер. По результатам исследования кислотно-щелочного состояния крови решался вопрос о выборе раствора для регидратации. В качестве ПРС применялся ондансетрон в дозе 0,1 мг/кг или трописетрон в дозе 0,2 мг/кг; для уменьшения метеоризма – симетикон, со спазмолитической целью применяли дротаверин (перорально или парентерально). При наличии декомпенсированного ацидоза перорально или внутривенно вводился 5%-ный раствор NaHСO3.
Ретроспективно были проанализированы данные 60 детей и проспективно – 100, находившихся на госпитализации и получавших лечение по поводу ротавирусного гастроэнтерита.
Лабораторное подтверждение РВИ основывалось на обнаружении ротавирусного антигена в копрофильтратах с помощью реакции латекс-агглютинации.
Также оценивали частоту рвоты после введения препарата, частоту внутривенной терапии у детей, получавших ПРС.
Исследование было одобрено Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (от 17.12.2013, № 11).
 Размер выборки предварительно не рассчитывался. Статистическая обработка данных проведена при помощи пакетов прикладных программ Statistica v. 6.0 (StatSoft Inc., США) и Microsoft Office Excel. Сравнение частот проведено при помощи χ2-теста в точном решении Фишера, достоверными считали различия при значении p<0,05. ОР и значения границ 95% доверительного интервала (ДИ) считались значимыми при значении больше 1 и свидетельствовали о наличии прямой связи между снижением частоты внутривенной регидратации и увеличением частоты применения ПРС.
Размер выборки предварительно не рассчитывался. Статистическая обработка данных проведена при помощи пакетов прикладных программ Statistica v. 6.0 (StatSoft Inc., США) и Microsoft Office Excel. Сравнение частот проведено при помощи χ2-теста в точном решении Фишера, достоверными считали различия при значении p<0,05. ОР и значения границ 95% доверительного интервала (ДИ) считались значимыми при значении больше 1 и свидетельствовали о наличии прямой связи между снижением частоты внутривенной регидратации и увеличением частоты применения ПРС.
Результаты исследования
По результатам анализа данных при применении трописетрона и ондансетрона в нашей клинике было выявлено снижение частоты рвоты и как следствие – необходимости во внутривенной регидратации на фоне приема данных препаратов. Также была доказана их безопасность и эффективность применения детьми с ротавирусным гастроэнтеритом. По окончании лечения у всех пациентов были купированы признаки эксикоза и кишечный синдром, электролитные и метаболические нарушения. Не отмечено летальных случаев и побочных эффектов в виде нарушения ритма сердца.
Полученные данные показали пользу применения ПРС группы селективных антагонистов 5-НТ3-рецепторов в виде снижения потребности во внутривенной регидратации у детей с ротавирусным ОГЭ.
Обсуждение
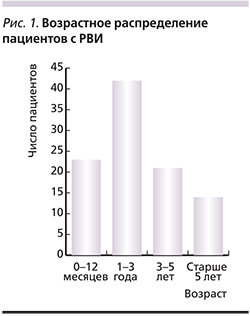
По данным анализа проспективной группы (n=100), рвота при поступлении отмечена в 59% случаев. Поскольку дети, требующие госпитализации, чаще были в тяжелом состоянии, ондансетрон получали все дети с повторной рвотой или в отсутствие эффекта от введения метоклопрамида на амбулаторном этапе (17% всех детей со рвотой). С учетом данных стационарного наблюдения всего препарат получили 73% детей, т.к. у части из их рвота присоединилась позже. Наиболее частой госпитализации требовали пациенты в возрасте от года до 3 лет (42%), меньше, но в равных количествах – дети первого года жизни и в возрасте от 3 до 5 лет (23 и 21% соответственно), наименьшее число – дети старше 5 лет (14%; рис. 1).
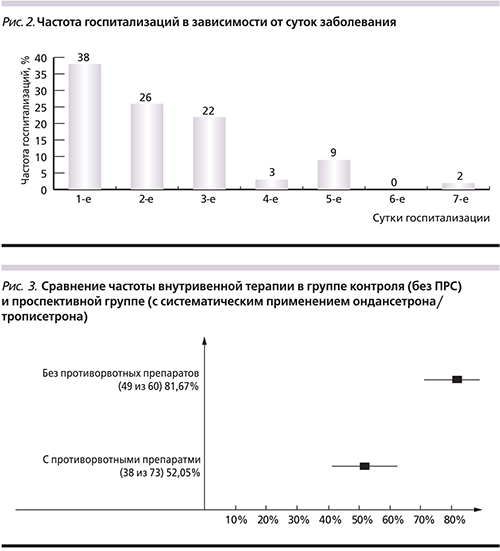
У 64,86% детей, из поступивших за первые сутки заболевания, после однократного выведения ондансетрона рвота купировалась на весь период болезни, остальным 35,14% препарат пришлось вводить повторно. Во всех возрастных группах преобладала госпитализация за первые трое суток заболевания, что может быть обусловлено клиническими проявлениями РВИ (рис. 2).
Мы не создавали контрольной группы, т.к. все дети проспективного наблюдения, поступавшие в стационар, получали ПРС при наличии рвоты. За контрольную группу мы взяли исторический контроль (n=60).
В отношении всех детей проспективной группы, получавших ПРС (n=73), дальнейшее лечение включило парентеральную регидратацию только в 52,05% (38/73), что значительно ниже данных исторического контроля, где ПРС не использовался систематически: из 60 детей с подтвержденной РВИ парентеральной регидратации потребовали 81,6% (49/60).
Таким образом, мы показали, что применение ондансетрона значительно снижает частоту внутривенной регидратации при РВИ (ОР=2,61, 95% ДИ от 1,176 до 5,814; p<0,01), которая может быть обусловлена неудачными попытками пероральной регидратации по причине рвоты (рис. 3).
Практика показывает, что в случае вовремя начатой и правильно проведенной пероральной регидратации при вирусных гастроэнтеритах эксикоз редко достигает высоких степеней и необходимость во внутривенном пути восполнения потерь жидкости чаще служит результатом несовершенного лечения на догоспитальном этапе, а не только тяжести заболевания.
Применение ондансетрона в нашей стране имеет возрастное ограничение – до 2 лет, однако иностранные данные показывали безопасность и эффективность его применения в отношении детей с 1-го месяца жизни еще в 2002 г. [32]. По нашим данным использования данного препарата «off label» с разрешения родителей до введения его в рекомендации ESPGHAN, не отмечено побочных эффектов в виде нарушения сердечного ритма. Для уменьшения риска побочных эффектов у всех детей при поступлении оценивали частоту сердечных сокращений, проводили кислотно-щелочной анализ крови с контролем уровня электролитов и для выявления метаболических нарушений. Также не превышались рекомендуемые разовые дозы для ондансетрона (0,1 мг/кг) и частота введения (не чаще, чем через 3–4 часа).
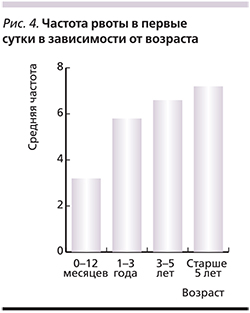
Средняя продолжительность рвоты во всех возрастных группах составила 41±28 часов. Однако было выявлено: чем старше ребенок, тем чаще рвота в первые сутки заболевания (рис. 4).
Средняя стоимость одной таблетки (4 мг) препарата составляет около 35 руб., что может удорожать лечение, но сокращение необходимости во внутривенной регидратации укорачивает длительность госпитализации и тем самым уменьшает стоимость лечения в целом.
Поскольку в анализ вошли данные исключительно детей, получавших стационарное лечение без учета амбулаторных случаев РВИ, показатели выборки могут быть неполными.
Важным фактором является приверженность родителей, отсутствие которой может стать причиной неадекватного проведения пероральной регидратации даже после введения ПРС.
Заключение
Таким образом, полученные данные показывают целесообразность назначения ПРС серотонинергического ряда при рвоте, вызванной РВИ, с целью уменьшения частоты внутривенной регидратации. Наши результаты совпадают с данными иностранных источников. Ондансетрон является безопасным и эффективным ПРС, который может применяться с месячного возраста в дозе 0,1 мг/кг не чаще, чем каждые 3–4 часа, при этом требуется контроль электролитного баланса крови и частоты сердечных сокращений с целью снижения риска осложнения в виде нарушения ритма. Такой побочный эффект, как увеличение длительности диареи, не значим для детей с РВИ. Сокращение необходимости во внутривенной регидратации после приема ондансетрона укорачивает длительность госпитализации и тем самым уменьшает стоимость лечения в целом.


