Введение и актуальность проблемы
В ежедневной клинической практике с симптомами диспепсии встречаются не только гастроэнтерологи, но и врачи других специальностей, что безусловно определено широкой распространенностью диспепсических жалоб в популяции, частота которых варьирует от 10 до 45 % [1–3]. При этом статистически доказано, что лишь у 40 % пациентов данные симптомы объясняются органической патологией органов пищеварения (язвенной болезнью желудка и двенадцатиперстной кишки, злокачественными новообразованиями, хроническим панкреатитом), в то время как превалирующее число больных попадает в рамки критериев синдрома функциональной диспепсии (ФД) [1, 4].
В соответствии с Римскими критериями третьего пересмотра (2006) синдром ФД определяется как гетерогенное расстройство, представляющее собой комплекс симптомов, включающих боли и чувство жжения в подложечной области, ощущение переполнения в эпигастрии после еды и раннее насыщение, которые отмечаются у пациента в течение 3 последних месяцев (при общей продолжительности жалоб не менее 6 месяцев) и не могут быть объяснены органическими, системными или метаболическими заболеваниями [5].
В странах Западной Европы ФД встречается среди 30–40 % населения и служит причиной 4–5 % всех обращений к врачу [1, 6]. В целом эти эпидемиологические данные можно экстраполировать и на нашу страну с оговоркой, что лишь 5 % таких больных получают квалифицированную медицинскую помощь. Действительно, в России в отличие от ряда европейских и азиатских стран диагноз ФД ставится достаточно редко. Как правило, если у пациента в процессе обследования не выявляются заболевания, входящие в группу органической диспепсии, ему выставляется диагноз «хронический гастрит». Между тем диагноз «хронический гастрит» без морфологического исследования гастробиоптатов практически не имеет доказательной основы и лишен клинического смысла.
В первую очередь это объясняется следующим: не существует никакой связи между морфологическими особенностями гастрита (включая выраженность воспаления) и наличием жалоб у пациента. Во многом эта проблема объясняется нехваткой информации по рассматриваемой патологии у врачей преимущественно поликлинического звена. Помимо этого нельзя не упомянуть и такой факт: в большинстве медицинских университетов тема ФД не введена в программы как обучения студентов старших курсов, так и подготовки специалистов в рамках последипломного усовершенствования врачей. Безусловно перечисленные выше факторы, к сожалению, несколько замедляют интеграцию современных алгоритмов обследования и лечения пациентов, страдающих ФД, в практическое здравоохранение в России.
Патогенетические звенья ФД
Несмотря на существенные продвижения в области изучения механизмов, индуцирующих симптоматику ФД, к настоящему моменту единой этиопатогенетической модели формирования рассматриваемой патологии не существует.

В настоящее время этиопатогенез ФД рассматривается как сложный многофакторный процесс, причинно-следственные связи которого продолжают активно изучаться, но центральное место в формировании ощущений пациента занимают нарушения моторики [7–9]. Наиболее вероятно, что именно комбинация ряда физиологических, генетических, экологических и психологических факторов ведет к развитию у конкретного пациента определенных комбинаций моторных нарушений желудочно-кишечного тракта (ЖКТ) и, как следствие, – к проявлению симптомов диспепсии [1, 3, 7–9].
Замедление эвакуаторной функции желудка может быть напрямую связано с диспепсическими явлениями, особенно с чувством переполнения в подложечной области после еды, вздутием живота и ранним насыщением. Есть много исследований, демонстрирующих, что задержка опорожнения желудка отмечается примерно у 40 % пациентов с ФД [10, 11]. Тем не менее, прямую связь между задержкой опорожнения желудка и диспепсическими явлениями не всегда удается обнаружить [12, 13]. Большое внимание в контексте патогенеза ФД в последнее время уделяется нарушению адаптивной релаксации (релаксационной аккомодации) желудка, выявляемой у 40–60 % пациентов. В результате данного нарушения моторики не происходит адекватного расслабления проксимального отдела желудка. Это приводит к быстрому попаданию пищи в антральный отдел желудка, его растяжению и появлению чувства раннего насыщения [14].
Помимо нарушения гастродуоденальной моторики ключевую роль в патогенезе ФД играет феномен висцеральной гиперчувствительности (ВГ) [1, 7, 9, 15, 16]. Некоторые исследования наглядно продемонстрировали, что группе пациентов с ФД присуща повышенная чувствительность к растяжению проксимального отдела желудка. Наличие данного патологического состояния нервно-мышечного аппарата желудка свидетельствует о нарушении сенсорных и афферентных связей между центральной нервной системой и ЖКТ. Экспериментально установлено, что у пациентов с ВГ боли в эпигастральной области возникают при значительно меньшем повышении внутрижелудочного давления по сравнению со здоровыми лицами за счет феномена гипералгезии [16]. ВГ выявляется примерно у 34 % пациентов с ФД [17].
Место соляной кислоты в патогенезе ФД оценивается неоднозначно. С учетом того, что антисекреторная терапия эффективна по отношению к ряду пациентов, считается, что соляная кислота может играть определенную роль в патогенезе ФД [7, 9]. Более того, существует мнение, будто желудочная секреция и ощущения, обусловленные выработкой кислоты в желудке, являются одними из основных патогенетических факторов в развитии диспепсических нарушений. Хотя, как было показано в исследовании S. Klatt и соавт., достоверных различий непосредственно в уровне чувствительности слизистой оболочки желудка к соляной кислоте у больных ФД с наличием болевого синдрома в эпигастральной зоне по сравнению с контрольной группой не существует [18]. Возможно, большее значение имеет повышение времени контакта слизистой оболочки желудка и двенадцатиперстной кишки с кислым содержимым и гиперчувствительность хеморецепторов с инициацией неадекватного гастралгического ответа больного с нарушенной моторикой [19].
Определенную роль в генезе ФД безусловно имеет и наследственный фактор. Установлено, в частности, что в возникновении данного заболевания может иметь значение полиморфизм гена GNB3 [20]. Данный ген кодирует белок G-семейства, функционирующий в качестве мембранного рецептора. Альтерация функций данного семейства белков может опосредовать нарушения внутриклеточной сигнальной трансдукции, играя непосредственную роль в формировании ВГ и моторных нарушений. В ряде исследований, проведенных в США и Европе, было продемонстрировано, что полиморфизмы генов GNB3, С825T и T825T характерны для пациентов с ФД [21, 22]. Помимо гена GNB3 в недавнем исследовании в Японии была выявлена достоверная ассоциация ФД с полиморфизмом G315C гена TRPV1 [23]. Последний кодирует одноименный полимодальный рецептор, воспринимающий различные стимулы, в т.ч. болевые, и играет непосредственную роль в формировании феномена ВГ [20].
Клиническая картина и диагностика
Клиническая картина ФД характеризуется крайней полиморфностью, при этом комплекс жалоб диспепсического характера намного шире клинических признаков, сформулированных Римским консенсусом. Так, у пациентов с ФД могут выявляться следующие симптомы: боль и чувство жжения в эпигастрии, вздутие живота, ощущение переполнения после еды, раннее насыщение, отрыжка, тошнота и рвота. При этом помимо жалоб гастроэнтерологического характера пациенты с ФД нередко предъявляют неспецифические жалобы на общую слабость, повышенную утомляемость и снижение работоспособности [3, 24].
Для систематизации гастроэнтерологических жалоб в единые клинико-патофизиологические кластеры Римским консенсусом было предложено различать два основных варианта ФД [5]:
- синдром эпигастральной боли (СЭБ);
- постпрандиальный дистресс-синдром (ПДС).
Для каждого из клинических вариантов были разработаны диагностические критерии (см. таблицу). В случае невозможности дифференцировки преобладающей симптоматики в конкретный тип диагноз ФД может быть выставлен без уточнения клинического варианта или определен как смешанный [5, 7].

В последнее время предметом активных исследований служит связь между ФД и другими заболеваниями, часто ассоциированными с данной патологией. Так, у пациентов с ФД нередко выявляются клинические признаки таких заболеваний, как гастроэзофагеальная рефлюксная болезнь (ГЭРБ) и синдром раздраженного кишечника (СРК). Такой «перекрест» симптоматики с труднодифференцируемыми доминирующими симптомами усложняет задачу клинициста по верификации диагноза [25]. Наличие ГЭРБ или СРК не исключает диагноза ФД, а служит поводом для постановки нескольких самостоятельных диагнозов и применения соответствующей диагностической и терапевтической тактики.
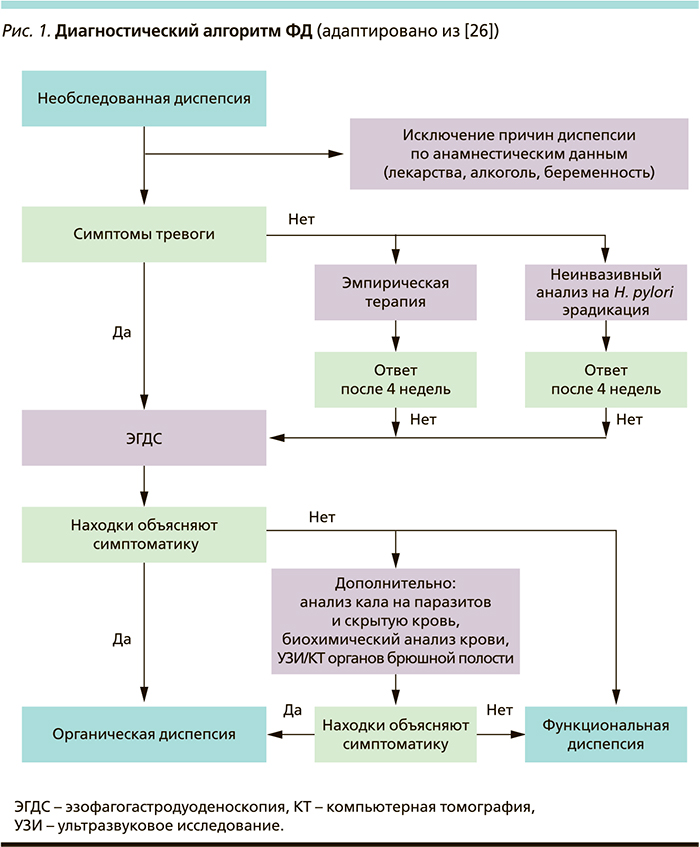
Диагностика ФД на первичном этапе предполагает исключение органического генеза явлений диспепсии. Многие органические, системные и метаболические заболевания, такие как язвенная болезнь, злокачественные новообразования ЖКТ и гепатобилиарной системы, паразитарные инвазии, хронические заболевания поджелудочной железы, сахарный диабет, гипо- и гипертиреоидизм, системная склеродермия, хроническая почечная недостаточность, электролитный дисбаланс, а также прием лекарственных препаратов (нестероидных противовоспалительных средств, холинолитиков, спазмолитиков, трициклических антидепрессантов, антагонистов кальция и др.) могут вызывать симптомы диспепсии [1, 7, 24, 26].
Важную роль на этом этапе играют не только рутинные лабораторные и визуализационные методы диагностики, но и клиническое выявление симптомов тревоги как ориентиров органической патологии.
Симптомы тревоги:
- немотивированное похудание;
- повторяющаяся рвота;
- кровотечение (рвота кровью или «кофейной гущей», мелена, гематохезия);
- дисфагия;
- лихорадка.
Повышенное внимание к этому аспекту связано прежде всего с тем, что ФД при наличии симптомов тревоги маловероятна, а недооценка их важности в случае скрыто протекающей органической патологии крайне опасна для прогноза.
В случае выявления симптомов тревоги пациенту независимо от возраста необходимо безотлагательное проведение эндоскопического исследования (эзофагогастродуоденоскопии) верхних отделов ЖКТ с прицельной биопсией и морфологическим изучением биопсийного материала. В случае обнаружения органической причины диспепсии устанавливается соответствующий диагноз. В отсутствие таковых формулируется диагноз ФД. Если у клинициста остаются сомнения в правомерности диагноза ФД, возможно применить дополнительные методы диагностики, в частности анализ кала на паразитоз (в эндемичных районах по аскаридозу, фасциолезу, лямблиозу, описторхозу) и скрытую кровь, расширенный биохимический анализ крови, ультразвуковое исследование и/или компьютерную томографию органов брюшной полости (рис. 1) [24, 26].
Лечение
К настоящему моменту аспекты рациональной терапии синдрома ФД продолжают активно обсуждаться. Гетерогенный характер популяции пациентов с ФД затрудняет формирование репрезентативной группы больных для клинических исследований, ввиду чего зачастую результаты клинических исследований в области терапии ФД носят диссонирующий характер.
Несмотря на малую доказательную базу, всем пациентам с ФД рекомендуется отказ от курения, алкоголя, кофеин-содержащих продуктов, дробное и частое (4–6 раз в сутки) питание небольшими порциями с ограничением жирной и острой пищи [26, 27].
Хотя накопленные на сегодня данные не дают оснований считать инфекцию Helicobacter pylori значимым этиологическим фактором в развитии ФД, проведение эрадикационной терапии может быть обоснованным в регионах с высокой инфицированностью H. pylori, к которым относится и Россия [24, 28]. В этом случае оправданна стратегия «test and treat», когда производится неинвазивное определение H. pylori и последующая эрадикация микроорганизма [7, 29].
Дальнейший выбор медикаментозной терапии должен определяться в зависимости от клинического варианта ФД (рис. 2). Так, при ПДС препаратами выбора остаются средства, стимулирующие моторику ЖКТ (прокинетики). В свою очередь при СЭБ – антисекреторные средства. При смешанных и недифференцированных клинических вариантах ФД целесообразно использование препаратов из обеих вышеназванных фармакологических групп [7, 24, 30]. Среди препаратов с прокинетическим действием в настоящее время наиболее широкое распространение получили антагонисты дофаминовых D2-рецепторов (метоклопрамид, домперидон) и прокинетики с двойным комбинированным механизмом действия (итоприда гидрохлорид). Эффективность данной группы препаратов для пациентов с ФД подтверждена результатами ряда исследований. В частности, в мета-анализе Кокрановской библиотеки, обобщившем результаты 24 исследований (3178 пациентов), эффективность прокинетиков в лечении ФД составила 57 %, что достоверно превысило таковую при приеме плацебо (47 %) [31]. Согласно результатам недавнего мета-анализа X. Huang и соавт. (2012), терапия ФД с преобладанием ПДС итоприда гидрохлоридом не только эффективна, но и ассоциирована с низким риском развития побочных эффектов [32].
В качестве антисекреторных средств на данный момент наиболее эффективными и безопасными остаются ингибиторы протонной помпы (ИПП) [33, 34]. Кроме этого, для ИПП, в отличие от предшествующих классов антисекреторных средств характерна предсказуемость подавления желудочной секреции как в первые дни лечения, так и при длительном применении [35]. Увеличение средних значений рН в желудке позволяет обеспечивать меньшую длительность контакта кислоты со слизистой оболочкой желудка и двенадцатиперстной кишки и облегчения симптомов у пациента. Более того, у части больных ПДС мощное подавление желудочной секреции может ускорить начало эвакуации из желудка за счет сокращения времени ощелачивания пищи в антральном отделе желудка и тем самым способствовать уменьшению интенсивности и частоты возникновения симптомов, обусловленных растяжением желудка [36, 37]. Кроме того, подавление выработки кислоты способствует уменьшению объема желудочного содержимого, что в свою очередь может уменьшить гиперчувствительность, возникающую в ответ на растяжение желудка [38].
Вышеперечисленные теоретические аспекты эффективности ИПП при лечении пациентов с ФД наглядно иллюстрируются результатами мета-анализа W.H. Wang и соавт. (2007), включившем 7 рандомизированных контролируемых исследований (в общей сложности 3725 больных ФД). Так, применение ИПП ассоциируется с достоверно более высокой результативностью по сравнению с плацебо (соответственно 40,3 и 32,7 %).
При этом число пациентов, которых необходимо пролечить для достиже-ния достоверных отличий (NNT) составило 14,6 (95 % доверительный интервал – 8,7–57,1) [39].
Данные опубликованных работ к сегодняшнему дню не позволяют выявить различия в терапевтической эффективности каких-либо представителей группы ИПП в рамках терапии ФД. Стоит отметить, что в настоящее время на российском рынке существует только два представителя ИПП с наличием зарегистрированных показаний к применению при ФД: омепразол и лансопразол. В настоящий момент в России до 90 % от всех реализованных ИПП составляет омепразол. В целом этот тренд во многом объясняется ценовой доступностью многочисленных генериков омепразола [40]. Однако стоит отметить, что в нашей стране нет единого реестра, в котором бы сравнивалась эффективность применения оригинального препарата и его генериков. Как известно, не всегда генерик обладает должной биологической, фармацевтической и терапевтической эквивалентностью с оригинальным препаратом в силу использования некачественных субстанций и вспомогательных веществ, а также малой доступностью ряда стран-производителей для контроля фармацевтической продукции (Индия, Китай, Пакистан, и др.).
В связи с этим в настоящее время практикующий врач нередко сталкивается с проблемой недостаточной эффективности генерических препаратов [41]. Характерной иллюстрацией подобного тренда служит ретроспективное исследование S. Cammarota и соавт. (2012) в Неаполе (Италия), в котором оценивались частота и причины замены оригинального ИПП на генерик, а также потенциальная фармакоэкономическая выгода от применения генериков ИПП. Результаты данной работы продемонстрировали, что замена оригинального ИПП на генерик повлекла за собой достоверный рост расходов (как прямых, так и косвенных) на лечение в среднем на 61,14 евро в год на человека [42].
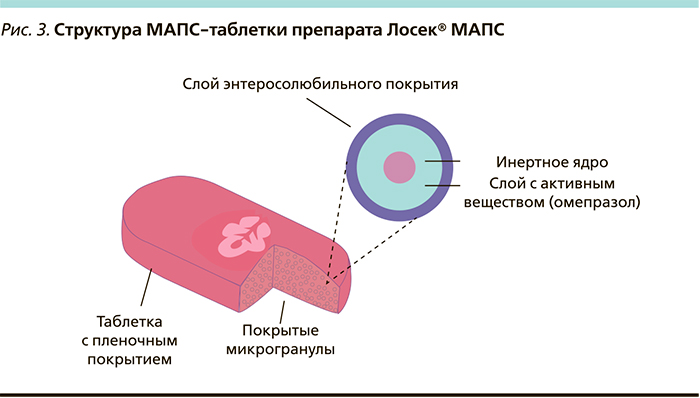
Существенным доводом в пользу назначения генериков всегда была их меньшая стоимость за упаковку (курс лечения) по сравнению с оригинальным препаратом, которая, как отмечается в фармакоэкономических исследованиях [42], нивелируется меньшей эффективностью генериков и ростом всех прочих затрат на лечение [43]. Однако с 2013 г. и это преимущество было нивелировано компанией AstraZeneca за счет существенного снижения цены на оригинальный препарат омепразола – Лосек. Таким образом, действительно качественный оригинальный препарат стал намного доступнее. Помимо этого стоит отметить, что среди всех омепразолов только Лосек выпускается в форме высокотехнологичной таблетки МАПС (англ. MUPS — Multiple Unit Pellet System). Эта лекарственная форма омепразола запатентована компанией AstraZeneca как самостоятельная ввиду ряда структурных особенностей. Каждая МАПС-таблетка состоит из множества микрогранул омепразола (более 1000), покрытых дополнительной энтеросолюбильной защитной оболочкой (рис. 3).
В силу данной структуры активно действующее вещество не подвергается агрессивному воздействию соляной кислоты, омепразол высвобождается лишь в щелочной среде двенадцатиперстной кишки, что обеспечивает предсказуемый и воспроизводимый антисекреторный эффект Лосека [40].
Возвращаясь к базисным аспектам терапии синдрома ФД, необходимо отметить, что ИПП и прокинетики в современных алгоритмах терапии ФД назначают в стандартных дозировках продолжительностью от 4 до 8 недель. В случае успешной терапии рекомендуется постепенная отмена препаратов или переход на режим терапии «по требованию» [7, 24, 30]. В отсутствие ответа на лечение со стороны пациентов с ФД возможно рассмотреть дальнейшее продолжение терапии с использованием низких доз антидепрессантов или анксиолитиков, хотя доказательная база такого лечения мала [44].
Дальнейшие перспективы развития и совершенствования фармакологического лечения ФД нацелены на разработку средств, влияющих на ВГ и адаптивную релаксацию желудка. Так, в пилотных исследованиях была показана эффективность агониста κ-опиоидных рецепторов азимадолина в нивелировании феномена висцеральной гиперчувствительности [45].
В настоящий момент в Японии по результатам рандомизированного плацебо-контролируемого исследования III фазы был разрешен к применению при ФД прокинетик принципиально нового механизма действия – акотиамид, являющийся антагонистом мускариновых М1- и М2-рецепторов, а также ингибитором ацетилхолинэстеразы [46]. Данный фармакологический профиль препарата позволяет ему нормализовывать адаптивную релаксацию желудка. Однако с учетом многофакторности патофизиологических процессов, ассоциированных с ФД, наиболее актуальным моментом является потенциальная разработка препаратов, воздействующих сразу на несколько патогенетических звеньев заболевания.
Заключение
Таким образом, к настоящему моменту патогенетический базис синдрома ФД остается малоизвестным. В результате практикующим врачам приходится основываться на эмпирически выработанных методах лечения данной патологии, выбирая препараты не только с оптимальным профилем эффективности и безопасности, но и с наличием зарегистрированных показаний к применению. Использование ИПП и/или прокинетиков длительностью от 4 до 8 недель на сегодняшний день представляется наилучшим вариантом лечения ФД. Дальнейшее изучение патофизиологических процессов, вовлеченных в формирование синдрома ФД, в перспективе позволит внедрить в клиническую практику высокоэффективные препараты для патогенетической терапии данного страдания.


