ВРоссии, как и во всем мире, наблюдается неуклонный рост числа детей-инвалидов.
В настоящее время дети-инвалиды составляют от 1,5 до 4,5 % детского населения страны. Рост относительного числа детей-инвалидов в стране за последнее десятилетие происходит на фоне снижения абсолютного количества детского населения – по данным ЮНИСЕФ в Российской Федерации сейчас проживают около 26 млн детей, т.е. на 7,5 млн меньше, чем в 2000 г. [1].
Сегодня, согласно статистике, до 40 % отечественных новорожденных имеют различные нарушения здоровья [2]. По данным литературы, существенную роль в развитии заболеваний нервной системы детей играет патология перинатального периода, обусловливая формирование от 60 до 80 % неврологических инвалидов в педиатрической популяции [3].
По данным Бюро медицинской статистики Департамента здравоохранения города Москвы за 2008–2012 гг., отмечается увеличение числа детей-инвалидов в возрасте 0–17 лет – с 131,4 до 160,4 на 10 тыс. населения. Соответственно увеличению показателя общей инвалидности нарастают и показатели самых частых нозологий, приводящих к инвалидности, при этом нозологическая структура инвалидности практически не меняется. На первом месте устойчиво остаются врожденные аномалии, на втором – болезни нервной системы, на третьем – психические расстройства (табл. 1).

Обращает внимание то, что на фоне роста рождаемости (31,9 % за пять лет) в Москве отмечается рост числа детей с перинатальной патологией, особенно детей, родившихся недоношенными (прирост на 33,3 % за пять лет) (см. рисунок). Дети, родившиеся недоношенными, в среднем составляют 6 % от общего числа родившихся. Около 13 % недоношенных детей с гипотрофией и около 10 % недоношенных детей без гипотрофии в дальнейшем формируют устойчивую неврологическую инвалидность, а именно детский церебральный паралич (ДЦП). Согласно данным статистики, около 50 % от всех случаев ДЦП составляют дети, рожденные недоношенными и по мере снижения гестационного срока, а также веса плода на момент рождения риск перинатальной патологии с исходом в ДЦП резко возрастает: по сравнению с доношенными детьми риск формирования церебрального паралича у детей, рожденных на 28–37-й неделе беременности, возрастает в 5 раз, а у детей, рожденных до 28-й недели гестации, – почти в 50 раз [15].
Среди факторов риска формирования устойчивой социально значимой неврологической патологии у детей большой удельный вес принадлежит материнской заболеваемости, которая, по данным многочисленных исследований, не только нарушает преконцепционное здоровье родительской пары, но и оказывает непосредственное негативное влияние на плод [4–7, 10, 11].
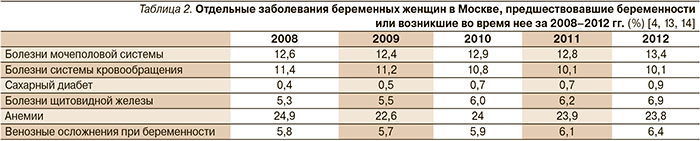
При изучении структуры общей патологии беременных женщин в Москве в динамике за пять лет отмечается рост доли больных среди беременных (с 77 до 80 %), в первую очередь за счет увеличения частоты сахарного диабета и болезней щитовидной железы (табл. 2).
Если с предикторами деткой неврологической инвалидности, действующими преконцепционно (до зачатия), антенатально (во время беременности) и интранатально (во время родов) возможно бороться с помощью режимных и профилактических мероприятий, то отрицательная неврологическая симптоматика неонатального периода требует проведения комплексных терапевтических мероприятий. Следует отметить, что негативное влияние на дальнейшее функционирование нервной системы ребенка могут оказывать не только вышеперечисленные факторы риска, но и сами лечебные процедуры (токсическое воздействие кислорода и т.п.) [7, 8]. Например, дети, потребовавшие реанимационных мероприятий в период новорожденности, относятся к группе безусловного риска развития стойких нарушений функционирования нервной системы [16].
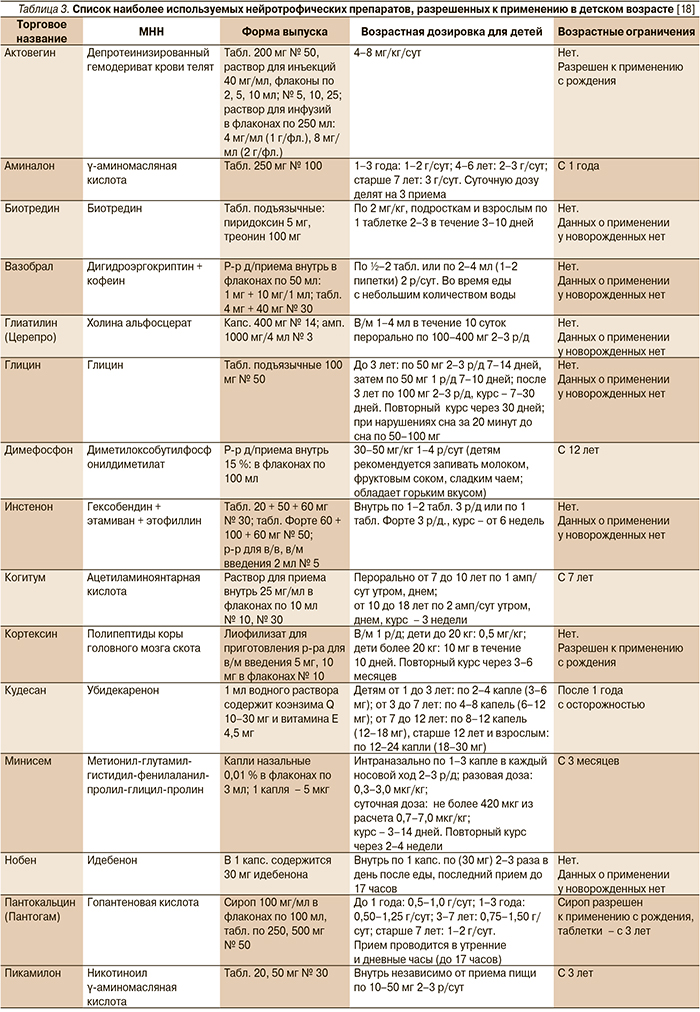
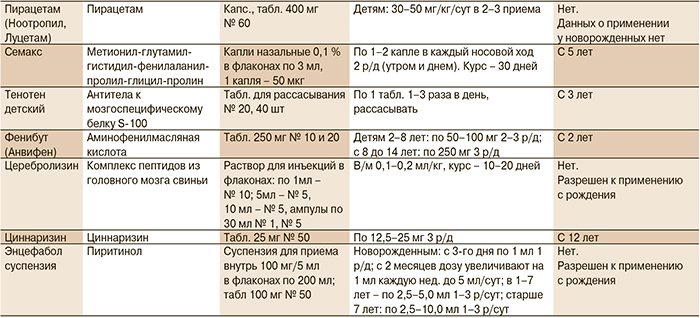
Медикаментозное лечение детей неонатального возраста до сих пор служит поводом для дискуссий специалистов различного профиля – от реаниматологов и педиатров до неврологов. Помимо отсутствия единой концепции показаний и противопоказаний к лекарственной коррекции неврологической симптоматики у детей первого месяца жизни врачи должны действовать в рамках правовых ограничений, лимитирующих применение большинства медикаментов в педиатрии, тем более в неонатологии (табл. 3) [17].

Таким образом, при относительном разнообразии лекарственных средств нейротрофического действия, допущенных к использованию пациентами моложе 18 лет, в периоде новорожденности не имеют абсолютных противопоказаний к применению только 12 препаратов, из них показания и опыт применения в неонатологии имеют только 5. Из оставшихся пяти нейротрофических препаратов два представлены в виде оральных форм, что может составлять значительные сложности на первом месяце жизни новорожденных пациентов с нарушениями сосания и глотания, и только три предназначены для парентерального применения.
Одним из упомянутых выше нейротрофических препаратов парентерального применения, изученных в неонатологии, является отечественный комплекс низкомолекулярных водорастворимых полипептидных фракций Кортексин. С целью получения фракции полипептидов с молекулярной массой, не превышающей 10 тыс. Да (10 кДа), используется метод уксусно-кислой экстракции; полученный экстракт подвергается многоступенчатой очистке и многократной фильтрации. Очистка активной субстанции препарата обеспечивает инфекционную и антигенную безопасность конечного продукта.
Кортексин обладает выраженной метаболической активностью: нормализация обмена нейромедиаторов; регуляция баланса тормозных/активирующих аминокислот и уровней серотонина и дофамина; ГАМКергическое действие; антиоксидантный эффект; нормализация биоэлектрической активности мозга. Обладая выраженным тканеспецифическим действием на клетки коры головного мозга, этот нейропептидный препарат оказывает церебропротекторное, ноотропное, нейротрофическое, нейрометаболическое, стимулирующее, антистрессорное, антиоксидантное, противосудорожное и иммунорегуляторное действия.
Основные показаниями к применению Кортексина: черепно-мозговая травма, нарушения мозгового кровообращения, нейроинфекции, астенические состояния и головные боли, энцефалопатии различного генеза, эпилепсия, нарушения психомоторного и речевого развития, памяти, мышления различного генеза, детский церебральный паралич и критические состояния новорожденных с перинатальным поражением нервной системы. Изучению эффективности Кортексина у детей посвящено множество различных исследований, ряд которых проведен в когорте пациентов первого месяца жизни с перинатальными поражениями нервной системы различного генеза.
В 2009 г. авторами из Украины был систематизирован и опубликован опыт наблюдения за 91 доношенным новорожденным, находившимся в критическом состоянии с протезированием функции дыхания в условиях отделения интенсивной терапии. Первую группу составили 65 новорожденных, которым в комплекс терапии был включен пептидный биорегуляторный препарат Кортексин. Группу сравнения составили 26 новорожденных с аналогичными неврологическими нарушениями, получавших стандартную схему терапии без применения Кортексина. С целью объективизации результатов исследования новорожденным в динамике проведены ультразвуковые исследования с допплерографией, компьютерная томография и электроэнцефалография с компьютерным картированием. Сравнительная оценка стойкости и выраженности неврологических симптомов, респираторных нарушений и длительности потребности в интенсивной терапии среди новорожденных в критическом состоянии с гипоксическим поражением нервной системы показала положительное влияние использования Кортексина в комплексном лечении [19].
Одним из наиболее крупных является исследование авторов из Белоруссии, опубликованное в 2012 г. [20]. В рамках этого исследования были обследованы и пролечены 100 новорожденных детей, находившихся на втором этапе выхаживания (50 детей составили основную группу и получали лечение Кортексином и 50 – группу сравнения и получали Пирацетам). Для объективизации результатов ультразвуковыми методами исследован бассейн внутренней сонной артерии и оценен венозный отток на примере вены Галена до начала лечения и после завершения курса терапии. Исходя из результатов исследования, были разработаны терапевтически эффективные дозы препарата – 0,5 мг/кг/сут внутримышечно курсом на 10 дней, что было подтверждено результатами нейросонографии с допплерометрией сосудов головного мозга до начала лечения и после курса терапии, а также данными неврологического статуса обследованных пациентов. Авторами был также сделан следующий вывод: использование препарата Кортексин в лечении острого периода перинатальных поражений нервной системы привело к снижению продолжительности терапии детей с указанной патологией до 21 ± 1,2 дня (p < 0,05) по сравнению с группой сравнения.
В том же (2012) году российскими авторами проведено исследование влияния Кортексина на формирование тонических и рефлекторных реакций в раннем неонатальном периоде жизни детей, внутриутробное развитие которых протекало в условиях хронической гипоксии. В рамках исследования проведено клинико-лабораторное обследование 41 ребенка (18 доношенных и 23 недоношенных), получавших монотерапию Кортексином в дозе 0,5 мг/кг в течение 10 дней, в раннем неонатальном периоде жизни. У всех детей исходно имелись неврологическая симптоматика и задержка формирования постурального, пассивного, активного тонуса и рефлекторных реакций. Авторы отмечают, что в результате лечения произошло улучшение общего состояния за счет снижения степени выраженности неврологических расстройств, формирования тонических и рефлекторных реакций. К концу лечения они соответствовали концептуальному возрасту: 38,9 % доношенных и 59,1 % недоношенных детей. В данном исследовании единственным методом объективизации были клинические шкалы 1976 и 1970 гг. (C. Amiel-Tisson и S.A. Dargassies) [21–23].
Таким образом, большинство авторов, использовавших Кортексин в лечении новорожденных с перинатальной патологией нервной системы, отмечают его положительный эффект, определяемый в первую очередь клинически – в виде редукции отрицательной неврологической симптоматики [22]. Однако с учетом отсутствия рандомизации в подборе пациентов, их немногочисленной выборки, отсутствия объективных методов оценки и анализа результатов полученные данные не могут быть сравнимыми между собой и не выходят за рамки доказательности IV уровня.
Отдельной проблемой в изучении и коррекции факторов формирования неврологических болезней в детской популяции является отсутствие междисциплинарного подхода к проблеме. Консолидация усилий специалистов различного профиля (неврологов, неонатологов, акушеров-гинекологов) на данной задаче поможет разработать перспективное планирование мероприятий по снижению детской неврологической заболеваемости и инвалидности.


