Боли в шейном отделе позвоночника нередко сочетаются с дефицитарной неврологической симптоматикой в руках, которая далеко не всегда является следствием вовлечения в патологический процесс шейных корешков спинномозговых нервов (радикулопатии). Почти в половине случаев выявляются туннельные невропатии, обусловленные механическим повреждением и/или нарушением кровоснабжения периферических нервов в анатомически узких фиброзных и фиброзно-костных каналах (туннелях). И около половины этих больных имеют сочетанное поражение нервных стволов помимо дистального еще и на проксимальном уровне: аксоплазматический ток скомпрометирован вследствие диско-радикулярного конфликта, что облегчает возникновение туннельных невропатий и обозначается в литературе как «синдром двойного аксоплазматического сдавления» (double crush syndrome) [16, 18, 20]. Как будет показано ниже, аксоплазматическое сдавление может быть не только двойным, но и тройным, и даже более. Именно поэтому уместнее употреблять термин «множественное аксоплазматическое сдавление» – МАС-синдром.
Выявление МАС-синдрома позволяет снижать гипердиагностику спондилогенных радикулопатий и избегать необоснованных нейрохирургических вмешательств на позвоночнике. С другой стороны, понимание роли спондилогенного фактора в развитии периферических туннельных невропатий дает возможность применения патогенетически обоснованных методов лечения, направленных на восстановление аксоплазматического тока за счет купирования диско-радикулярного конфликта или устранения сдавления проксимальных отделов нерва в составе сосудисто-нервных сплетений [18, 19].
Традиционно считается, что патогенез компрессионно-ишемических невропатий включает: 1) увеличение объема периневральных тканей, 2) повышение тканевого давления внутри туннеля, 3) нарушения кровообращения в компримированном участке, 4) гиперфиксация нерва [2, 4, 7].
Во всех существующих теориях развития туннельных невропатий фигурирует два фактора: декомпенсация в трофических системах нерва (дисметаболические и дизиммунные расстройства, окислительный стресс, нарушение аксоплазматического тока, поражение vasae nervorum) и локальные микротравмы периферических нервов [2, 4, 7, 18, 20]. Известно, что по наследству могут передаваться как недостаточность трофических систем периферических нервов, так и узость фиброзно-костных каналов (за счет особенностей строения и двигательного стереотипа). Поэтому неудивительно частое выявление больных туннельными невропатиями в отдельных семьях с наличием соответствующей патологии.
Однако в рутинной клинической практике часто не учитывается изначальное состояние периферического нерва, подвергающегося компрессии; между тем туннельные невропатии легче возникают в случаях, когда аксональные транспортные системы уже скомпрометированы в проксимальном (МАС-синдром при плексопатии или радикулопатии) или дистальном (полиневропатии или множественные мононевропатии) отделах. На фоне дефицита аксоплазматического тока и нейротрофических факторов, требующихся для регенерации аксона, компенсаторные возможности нерва снижаются. Именно поэтому каждому конкретному больному для уточнения механизмов патогенеза туннельных синдромов и подбора оптимальной тактики терапии необходимо учитывать острые, подострые и хронические повреждения на всех возможных уровнях периферической нервной системы, «проявляющие» наследственную или приобретенную узость фиброзно-костного канала [4, 20].
Клинические проявления туннельных невропатий включают симптомы нарушения сенсорных, вегетативно-трофических (если нерв смешанный, то и моторных) функций с возможными невропатическими болями в зоне, иннервируемой пораженным нервом, а также ноцицептивными болями в области компрессии нерва: болезненность при поколачивании, растяжении, давлении (статическая гипералгезия). Эти симптомы могут усиливаться после физической нагрузки или в ночное время в связи с нарушением кровоснабжения нерва в области туннеля. Клинические проявления невропатического болевого синдрома включают симптомокомплекс спонтанных и стимулзависимых болей в зоне иннервации периферического нерва, дистальнее зоны туннельной компрессии. Интенсивные стреляющие, дергающие боли обычно возникают в виде пароксизмов и не бывают постоянными, в то время как жгучие, ноющие боли могут быть постоянными и периодически весьма высокой интенсивности. Во многих случаях боли усиливаются при физической активности, длительной статической нагрузке или охлаждении. Спонтанные боли сопровождаются, как правило, стимулзависимыми болями – аллодинией, статической и динамической гипералгезией. Одним из наиболее ранних признаков туннельной невропатии являются ночные парестезии, а также утреннее онемение в конечностях, сопровождающееся жалобами на одеревенение и «опухание» пальцев рук, хотя при осмотре отека не обнаруживается, затруднение выполнения «тонких» целенаправленных движений (застегивание пуговиц, завязывание галстука и т. д.), необходимых для утреннего туалета и самообслуживания. В дебюте заболевания позитивная неврологическая симптоматика (боли, парестезии и онемение) преобладают над симптомами выпадения (негативной невропатической симптоматикой), которые проявляются снижением чувствительности различных модальностей, а при вовлечении двигательных волокон – гипорефлексией, слабостью и атрофией мышц. При вовлечении артерий и вен возможно развитие сосудистых расстройств, что проявляется побледнением, снижением локальной температуры или появлением цианоза и отечности в области поражения. Однако при изолированном поражении нерва сосудистые и трофические изменения тоже возможны за счет вовлечения автономных волокон, хотя выражены они чаще всего незначительно [2, 4, 7].
Локализация нарушений чувствительности при всей их топографической типичности весьма варьируется у разных пациентов вследствие преморбидных вариантов сенсорной иннервации кожи, существования зон перекрытия смежными нервами, а также нередкой асимметричности компрессии нервного ствола. То же можно сказать и о мышечной слабости зачастую анталгического, а иногда и психогенного характера. В силу неочевидности или непостоянства объективных признаков повреждения нерва традиционное неврологическое исследование должно быть дополнено специальными клиническими тестами, провоцирующими парестезии и боли и направленными на поиск места компрессии [4, 7, 12]:
Тест Тинеля – при перкуссии в зоне повреждения над проекцией нерва появляются боли и/или парестезии в области иннервации нерва, дистальнее места перкуссии.
Тест пальцевой компрессии Гольдберга – аналогично тесту Тинеля производится сдавление большим пальцем на протяжении минуты запястного канала по проекции срединного, локтевого или лучевого нервов. В ответ возникают парестезии и боли по ходу компримированного нерва.

Турникетный (манжеточный) тест – проксимальнее места предполагаемой компрессии нерва (на плече) накладывают манжету тонометра и повышают в ней давление до уровня обычного систолического или слегка выше него. Выжидают 1 минуту. При наличии туннельного синдрома появляются парестезии в зоне иннервации компримированного нерва. Этот тест может быть использован и для суждения о степени тяжести заболевания, если измерять время от начала манжетной компрессии до появления парестезии. С равным успехом тест применим для контроля над эффективностью лечения.
Тест поднятия конечностей (элевационный) – при невропатиях рук больной в положении сидя или стоя поднимает вытянутые руки вверх и в течение минуты удерживает их в таком положении. При этом больные отмечают появление парестезии в зоне иннервации компримированного нерва. При невропатиях ног в положении лежа поднимается поочередно на 1 минуту выпрямленная одна, а затем другая нога. Вследствие уменьшения гидростатического давления в артериях конечностей нарушается кровоснабжение нервов и возникают парестезии.
Тест форсированных максимальных по объему пассивных движений – выбирают такое направление движения, при котором пораженный нерв оказался бы в еще большей степени компрессии и добавочного натяжения. При подозрении на синдром запястного канала применяют максимальное пассивное сгибание кисти в лучезапястном суставе и удерживают руку в таком положении в течение 1 минуты. В результате возникают парестезии в I–III пальцах. Аналогичным образом применяют и тест пассивного разгибания кисти (тест Фаллена). При невропатии надлопаточного нерва применяют форсированное перекрестное (на другую сторону тела) приведение вытянутой руки, что приводит к усилению тракции и компрессии нерва, к усилению болей в зоне иннервации этого нерва. А при синдроме малой грудной мышцы – гиперабдукцию: при крайнем отведении руки плечевое сплетение, подмышечные артерия и вена плотно прижимаются к натянутой малой грудной мышце и перегибаются через основание клювовидного отростка. При синдроме передней лестничной мышцы поворот головы обследуемого в сторону больной руки, поднимание подбородка и одновременный глубокий вдох приводят к снижению артериального давления на этой руке и уменьшению и даже исчезновению пульсовой волны (проба Эдсона). Механизм всей этой группы пассивных провоцирующих движений, по существу, может быть отнесен к тракции нерва, нередко дополненной его гиперангуляцией и компрессией.
Не все вышеописанные тесты бывают положительными – даже на поздних стадиях туннельных невропатий [12]. Поэтому для точной диагностики поражения периферических нервов, определяющей стратегию терапии, необходимо точное знание особенностей наиболее типичных туннельных синдромов плечевого пояса [2, 4, 7].
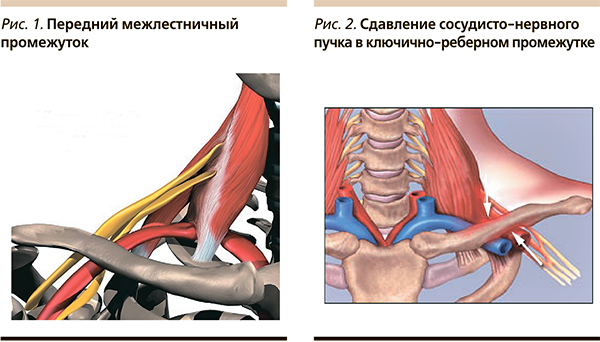
Наиболее проксимальным уровнем компрессии на уровне шеи считается синдром передней лестничной мышцы (синдром Наффцигера, скаленус-синдром, синдром Адсона, синдром Нонне, синдром Гота–Гюнольда и синдром Купера), вызван механическим сдавлением стволов плечевого сплетения и подключичной артерии в переднем межлестничном промежутке. Больные предъявляют жалобы на боли в шее и руке, чувство онемения в дистальных отделах руки. Боли усиливаются при движениях шейного отдела позвоночника. Объективно почти всегда определяются припухлость и болезненность в над- и подключичной ямке. Передняя лестничная мышца резко напряжена. При надавливании в области проекции лестничных мышц возникает боль, которая иррадиирует в руку. Компрессия подключичной артерии может приводить к ослаблению пульса на лучевой артерии больной руки. При поворотах головы и глубоких вдохах пульс может исчезать совсем (проба Адсона). Это объясняется дополнительным напряжением лестничных мышц при вдохе, поскольку они являются вспомогательными мышцами вдоха (рис. 1).
Следующим возможным уровнем поражения плечевого сплетения служит верхняя апертура грудной клетки (синдром ребро–ключица Фолконера–Уэддела, вызванный компрессией нижнего ствола плечевого сплетения и подкрыльцовой артерии в ключично-реберном промежутке за счет его сужения при аномально высоком I ребре, при гипертрофии подключичных мышц, а также при врожденных или приобретенных деформациях ключицы и ребра, опухоли верхушки легкого и т. д.) (рис. 2).
Наиболее дистальным вариантом поражения плечевого сплетения является синдром малой грудной мышцы (гиперабдукционный синдром Райта–Мендловича, клювовидно-пекторальный синдром) – сдавление патологически измененной, гипертрофированной малой грудной мышцей сосудисто-нервного пучка, включающего подмышечную артерию и вены.
Три вышеописанных варианта поражения плечевого сплетения часто являются вторым (средним) уровнем компрессии периферического нерва при МАС-синдроме. Характерно их развитие на стороне существующей хронической (в т. ч. и субклинической) радикулопатии. Но даже в отсутствие корешковой компрессии синдромы Наффцигера, Фолконера–Уэддела и Райта–Мендловича способны создавать проксимальную компрессию аксона, таким образом облегчая возникновение туннельных невропатий лучевого, локтевого и мышечно-кожного нервов.
Невропатии срединного нерва
Наиболее распространенной формой компрессионо-ишемической невропатии, встречающейся в популяции среди 3 % женщин и 2 % мужчин, является синдром запястного канала – компрессия срединного нерва сухожилиями сгибателей пальцев, окруженных фиброзными влагалищами и удерживателем сгибателей за счет утолщения связки, увеличения объема периневральных тканей либо мышечного перенапряжения. Боль и онемение распространяются на ладонную поверхность большого, указательного, среднего и безымянного пальца, а также на тыльную поверхность указательного и среднего пальца. Вначале симптомы возникают при выполнении каких-либо действий с использованием кисти (работа за компьютером, рисование, вождение), затем онемение и боль появляются и в состоянии покоя, иногда возникают ночью. Для верификации диагноза синдрома запястного канала проводится тест Тинеля. Боль может ощущаться также в области постукивания. Положительный симптом Тинеля обнаруживается примерно у половины пациентов с синдромом карпального канала, в случае отсутствия этого симптома проводится тест Дуркана (сдавление запястья в области прохождения срединного нерва вызывает онемение и/или боль в I–III, половине IV пальца руки, как при симптоме Тинеля) или тест пальцевой компрессии Гольдберга, тест Фалена (сгибание или разгибание кисти на 90 ° приводит к онемению, ощущению покалывания или боли менее чем за 60 секунд, у здорового человека тоже могут развиваться подобные ощущения, но не ранее чем через 1 минуту), элевационный, или манжеточный, тест. На более поздней стадии положительна оппозиционная проба (при выраженной слабости тенара пациент не может соединить большой палец и мизинец, либо врачу удается легко разъединить сомкнутые большой палец и мизинец пациента).
Компрессионно-тракционная невропатия пальцевых нервов руки (ветвей общего ладонного пальцевого нерва) в интерметакарпальных туннелях, образованных глубокой и поверхностной поперечными метакарпальными связками, натянутыми между головками метакарпальных костей. При синдроме интерметакарпального канала боль локализуется между соседними пальцами, распространяясь на тыл кисти и предплечье. Определяется пальпаторная болезненность в проекции головок метакарпальных костей, при этом появляются онемение, парестезии по смежным поверхностям пальцев, здесь же можно выявить зону гипестезии. Максимальное сгибание или разгибание пальцев усиливает боль и парестезии.
 Синдром круглого пронатора (синдром Сейфарта) – компрессия срединного нерва в верхней трети предплечья в фиброзно-мышечном канале, образованном локтевой и плечевой головками круглого пронатора, а также перегиб и трение нерва при прохождении фиброзной аркады в проксимальной части поверхностного сгибателя пальцев, имеющие место при повторных форсированных пронаторных движениях с одновременным сгибанием пальцев. При развитии синдрома круглого пронатора пациент жалуется на боль и жжение на 4–5 см ниже локтевого сустава, по передней поверхности предплечья, и иррадиацию боли в I–III, половине IV пальца и ладонь. При синдроме круглого пронатора будет положительным симптом Тинеля при постукивании неврологическим молоточком в области табакерки пронатора (на внутренней стороне предплечья) и пронаторно-флексорный тест (пронация предплечья с плотно сжатым кулаком при создании сопротивления этому движению, т. е. противодействие приводит к усилению боли). Усиление боли также может наблюдаться при письме (прототип пронаторно-флексорного теста). При исследовании чувствительности выявляется ее нарушение, захватывающее ладонную поверхность первых трех с половиной пальцев и ладонь. Чувствительная ветвь срединного нерва, иннервирующая ладонную поверхность кисти, обычно проходит выше поперечной связки запястья. Возникновение нарушения чувствительности на ладонной поверхности I пальца, тыльной и ладонной поверхности II–IV пальцев с сохранением чувствительности на ладони позволяет уверенно дифференцировать синдром запястного канала от синдрома круглого пронатора. Атрофия тенара при синдроме круглого пронатора, как правило, не так выражена, как при прогрессирующих синдромах запястного канала (рис. 3).
Синдром круглого пронатора (синдром Сейфарта) – компрессия срединного нерва в верхней трети предплечья в фиброзно-мышечном канале, образованном локтевой и плечевой головками круглого пронатора, а также перегиб и трение нерва при прохождении фиброзной аркады в проксимальной части поверхностного сгибателя пальцев, имеющие место при повторных форсированных пронаторных движениях с одновременным сгибанием пальцев. При развитии синдрома круглого пронатора пациент жалуется на боль и жжение на 4–5 см ниже локтевого сустава, по передней поверхности предплечья, и иррадиацию боли в I–III, половине IV пальца и ладонь. При синдроме круглого пронатора будет положительным симптом Тинеля при постукивании неврологическим молоточком в области табакерки пронатора (на внутренней стороне предплечья) и пронаторно-флексорный тест (пронация предплечья с плотно сжатым кулаком при создании сопротивления этому движению, т. е. противодействие приводит к усилению боли). Усиление боли также может наблюдаться при письме (прототип пронаторно-флексорного теста). При исследовании чувствительности выявляется ее нарушение, захватывающее ладонную поверхность первых трех с половиной пальцев и ладонь. Чувствительная ветвь срединного нерва, иннервирующая ладонную поверхность кисти, обычно проходит выше поперечной связки запястья. Возникновение нарушения чувствительности на ладонной поверхности I пальца, тыльной и ладонной поверхности II–IV пальцев с сохранением чувствительности на ладони позволяет уверенно дифференцировать синдром запястного канала от синдрома круглого пронатора. Атрофия тенара при синдроме круглого пронатора, как правило, не так выражена, как при прогрессирующих синдромах запястного канала (рис. 3).
Синдром супракондилярного отростка плеча (синдром ленты Стразера, синдром Кулона, Лорда и Бедосье) – невропатия срединного нерва в нижней трети плеча в непостоянном «надмыщелковом кольце», ограниченном медиальным надмыщелком плечевой кости, супракондилярным апофизом и фиброзной лентой Стразера. Из-за добавочного отростка срединный нерв смещается и натягивается (как тетива лука). Это делает его уязвимым к поражению. Супракондилярный апофиз, или добавочный отросток («шпора») плечевой кости, на ее дистальной антеромедиальной поверхности наблюдается в популяции в 0,5–1,0 % случаев, но в большинстве наблюдений это хоть и приводит к гиперангуляции нерва, но не вызывает туннельной невропатии. Для возникновения симптомов невропатии требуется участие других экзогенных и эндогенных факторов. Клинические проявления имеют почти полное сходство с синдромом круглого пронатора: в зоне иннервации срединного нерва определяются боль, парестезии, снижение силы сгибания кисти и пальцев. В отличие от синдрома круглого пронатора при поражении срединного нерва под связкой Стразера возможна механическая компрессия плечевой артерии с соответствующими сосудистыми расстройствами, а также выраженная слабость пронаторов: круглого и малого. В диагностике синдрома супрокондилярного отростка полезен следующий тест. При разгибании предплечья и пронации в сочетании с формированным сгибанием пальцев провоцируются болезненные ощущения с характерной для компрессии срединного нерва локализацией. При подозрении на то, что компрессия вызвана «шпорой» плечевой кости, показано рентгенологическое исследование. Лечение заключается в резекции надмыщелкового отростка («шпоры») плечевой кости и связки.
Невропатии локтевого нерва
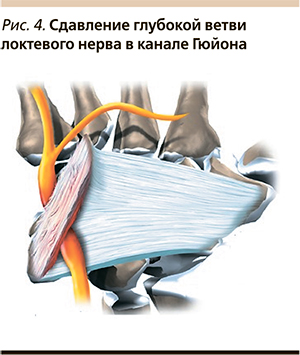
Синдром канала Гюйона развивается вследствие сдавления глубокой ветви локтевого нерва в канале, образованном гороховидной костью, крючком крючковидной кости, ладонной пястной связкой и короткой ладонной мышцей. Отмечаются жгучие боли и расстройства чувствительности в IV–V пальцах, затруднения щипковых движений, приведения и разведения пальцев. Этот синдром очень часто является результатом длительного давления рабочих инструментов, например вибрирующих, отверток, щипцов, поэтому встречается чаще у представителей определенных профессий (садовники, резчики кожи, портные, скрипачи, лица работающие с отбойным молотком). Иногда синдром канала Гюйона развивается после пользования тростью или костылем, а также при неэргономичном пользовании компьютерной мышью. К патологическим факторам, которые могут вызывать компрессию, также относятся увеличенные лимфатические узлы, переломы, артрозы, артриты, аневризма локтевой артерии, опухоли и анатомические образования вокруг канала Гюйона. На отличие синдрома канала Гюйона от такового кубитального канала указывает то, что при поражении нерва в области кисти боль возникает в области гипотенара и основания кисти, так же как и усиление и иррадиация в дистальном направлении при провоцирующих тестах. Расстройства чувствительности при этом занимают только ладонную поверхность IV–V пальцев. На тыле кисти чувствительность не нарушена, т. к. обеспечивается дорсальной ветвью локтевого нерва, отходящего от основного ствола на уровне дистальной трети предплечья (рис. 4).
Синдром кубитального канала развивается при компрессии локтевого нерва под коллатеральной связкой в надмыщелково-локтевом желобе и в щели между двумя головками локтевого сгибателя кисти у места верхнего прикрепления. Боль и парестезии ощущаются в латеральной части плеча, иррадиируют в мизинец и половину четвертого пальца. В начале заболевания неприятные ощущения и боль возникают только при давлении на локоть или после продолжительного его сгибания. В более выраженной стадии боль и онемение чувствуются постоянно. К другим признакам заболевания относится слабость в руке. Она проявляется потерей «уверенности» в руке: вдруг из нее начинают выпадать предметы при каких-то привычных действиях. Например, человеку трудно становится налить воду из чайника. В запущенных случаях кисть больной руки начинает худеть, появляются ямки между костями из-за атрофии мышц. На ранних стадиях заболевания единственным проявлением (помимо слабости мышц предплечья) может быть потеря чувствительности на локтевой стороне мизинца. При стертой клинической картине верификации могут помочь тест Тинеля (возникновение боли в латеральной части плеча, иррадиирующей в безымянный палец и мизинец при поколачивании молоточком над областью прохождения нерва в области медиального надмыщелка), эквивалент симптома Фалена (резкое сгибание локтя вызовет парестезии в безымянном пальце и мизинце), тест Фромена (из-за слабости abductor policis brevis и flexor policis brevis можно обнаружить чрезмерное сгибание в межфаланговом суставе большого пальца на пораженной руке в ответ на просьбу удержать бумагу между большим и указательным пальцами), тест Вартенберга (пациенты с более выраженной мышечной слабостью могут жаловаться на то, что при засовывании руки в карман мизинец отводится в сторону и не заходит в карман).
Синдром супинатора (синдромы Фрозе, Копелля–Томсона, «локоть теннисиста») – перегиб и сдавление, а также трение задней (глубокой) ветви лучевого нерва под апоневротическим краем короткого лучевого разгибателя кисти с одновременным ущемлением в фиброзной щели между поверхностным и глубоким пучками супинатора предплечья могут быть обусловлены мышечными перегрузками с развитием миофасциопатий или патологическими изменениями периневральных тканей. Проявляется болью в мышцах – разгибателях предплечья, их слабостью и гипотрофией. Тыльная флексия и супинация кисти, активная экстензия пальцев против сопротивления провоцируют боль. Активное разгибание III пальца при его прижатии и одновременном выпрямлении руки в локтевом суставе вызывает интенсивную боль в локте и верхней части предплечья.
Невропатии лучевого нерва
Сдавление лучевого нерва в области подмышечной впадины встречается редко. Возникает вследствие использования костыля («костыльный паралич») при этом развивается паралич разгибателей предплечья, кисти, основных фаланг пальцев, мышцы, отводящей большой палец, супинатора. Ослаблено сгибание предплечья, угасает рефлекс с трехглавой мышцы. Чувствительность выпадает на дорсальной поверхности плеча, предплечья, отчасти кисти и пальцев.
Синдром спирального канала (синдром «ночного субботнего паралича», «парковой скамейки») – компрессия лучевого нерва на уровне средней трети плеча в спиральном канале, образованном спиральной бороздой плечевой кости и головками трехглавой мышцы плеча. Лучевой нерв, идя из подмышечной области, огибает плечевую кость, где располагается в костной спиральной борозде (желобке), которая становится костно-мышечным туннелем, поскольку к этой борозде прикрепляются две головки трехглавой мышцы. В период сокращения трехглавой мышцы нерв смещается вдоль плечевой кости и за счет этого может травмироваться при форсированных повторных движениях в плечевом и локтевом суставах. Но чаще всего компрессия возникает вследствие прижатия нерва на наружно-задней поверхности плеча. Это происходит, как правило, во время глубокого сна (часто крепкий сон возникает после употребления алкоголя, поэтому получил название «синдром субботней ночи»), в отсутствие мягкой постели («синдром парковой скамейки»). Прижатие нерва может быть обусловлено расположением головы партнера на наружной поверхности плеча.
Радиальный туннельный синдром запястья – компрессионная невропатия поверхностной ветви лучевого нерва, связанная с переломом дистального отдела лучевой кости (синдром Турнера), сдавлением наручниками («арестантский» паралич) или лигаментитом канала короткого разгибателя и длинной отводящей мышцы I пальца тыльной связки запястья (болезнь де Кервена).
Невропатия мышечно-кожного нерва при микротравматизации сухожилием двуглавой мышцы плеча проявляется онемением наружной стороны предплечья вплоть до основания большого пальца и парезом двуглавой мышцы плеча.
Для объективной оценки тяжести поражения и процессов восстановления функций нерва, особенно на ранних стадиях заболевания в отсутствие объективной неврологической симптоматики, проводятся нейрофизиологические исследования: стимуляционная электронейромиография (ЭНМГ), количественное сенсорное тестирование. При ЭНМГ определяется снижение амплитуды и скорости распространения возбуждения по двигательным и чувствительным волокнам и/или увеличение резидуальной латенции [2, 5, 8, 15, 16].
Относительно новой, но весьма перспективной методикой оценки морфологических изменений в периферических нервах является ультразвуковая диагностика. Для ультразвуковых исследований используются датчики с частотой 7–17 МГц. Изображение нерва имеет ряд характерных признаков: в поперечной проекции он выглядит как овальное или округлое образование с четким гиперэхогенным контуром и внутренней гетерогенной упорядоченной структурой («соль–перец», «медовые соты»), а в продольной проекции нерв лоцируется в виде линейной структуры с четким эхогенным контуром, в составе которой правильно чередуются гипо- и гиперэхогенные полосы – «электрический кабель». В процессе сканирования оценивают анатомическую целостность нервного ствола, его структуру, четкость контуров нерва и состояние окружающих тканей. Метод ультразвуковой диагностики позволяет не только выявлять объемные новообразования (шванномы, невриномы и т. п.), вызывающие повреждение нерва, но и оценивать подвижность нерва в туннеле при динамических пробах, наличие рубцово-спаечных изменений, воспалительного отека или, наоборот, атрофии нерва при сопоставлении с нервом интактной конечности [6, 15]. Данные ультразвуковой диагностики полезны для определения тактики терапии: невролиза – при спаечном процессе, патогенетического воздействия на процессы реиннервации — при атрофии, блокад с нестероидными противовоспалительными препаратами (НПВП) (1,5 мл 1 %-ного раствора Мовалиса с 1 мл 2 %-ного раствора лидокаина) или глюкокортикоидами – при воспалительном отеке. Кроме того, ультразвуковой контроль малоинвазивных лечебно-диагностических воздействий (параневральных блокад) позволяет проводить их с максимальной точностью, а следовательно, – эффективностью.
В целях проверки диагностического предположения о наличии компрессии нерва ex juvantibus используются блокады с местными анестетиками параневрально в точки наибольшей болезненности («ловушечный пункт») или в точки предполагаемого сдавления, находимые по топографическим ориентирам [4, 7, 13]. Купирование парестезии и болей свидетельствует о том, что диагноз поставлен правильно. Проба отличается высокой чувствительностью при условии точного выполнения техники блокады, но не самой высокой специфичностью. Плацебо-эффект блокад при синдроме психогенных акропарестезий исключается при использовании 0,9 %-ного раствора NaCl вместо анестетика.
Лечение МАС-синдрома крайне проблематично из-за низкой эффективности традиционных способов лечения туннельных невропатий при этом заболевании и частых рецидивов клинической симптоматики [16, 18, 20]. Для того чтобы лечение МАС-синдрома было эффективным, необходимо понять причину и механизмы возникновения компрессии и применить комплексный подход к терапии. Радикальным методом лечения большинства туннельных синдромов служит оперативное вмешательство, которое заключается в рассечении тканей, сдавливающих нерв, и в создании оптимальных условий для нервного ствола, предупреждающих его травматизацию. Наличие грубых выпадений двигательных и чувствительных функций, быстрое нарастание симптоматики с развитием контрактур является абсолютным показанием к операции [14, 17]. Однако в подавляющем большинстве случаев прибегнуть к операции больных вынуждает безуспешность неправильно проведенного консервативного лечения, а не абсолютные показания к оперативному лечению.
С позиции клинической практики необходимо заметить, что даже задержка восстановительных процессов в нерве в течение нескольких месяцев не является показанием к оперативному лечению, т. к. в подавляющем числе наблюдений проведенная больным консервативная терапия не адекватна ни этиологической предиспозиции, ни патогенетическим механизмам развития компрессии нерва. Для успешной консервативной терапии необходима прежде всего фиксация конечности в функционально-выгодном положении – необходимо прекратить физическое воздействие в области компрессии [2, 4, 7, 8, 17, 19]. Для этого существуют специальные ортопедические приспособления: ортезы, бандажи, лангеты, которые позволяют добиваться иммобилизации именно в зоне повреждения. При этом они очень удобны в использовании, их можно легко надевать и снимать, что позволяет пациенту сохранять свою социальную активность. Вторым направлением успешного консервативного лечения туннельных невропатий и профилактики возникновения последующих туннельных синдромов служит этиотропная терапия, направленная на восстановление нарушенного метаболизма в поврежденном нерве [4, 7, 8].
Самым коротким и действенным путем купирования боли при наличии у врача необходимых манипуляционных навыков являются медикаментозные блокады. Инъекции глюкокортикоидов непосредственно в соответствующие каналы или ткани, окружающие нерв, относятся к методам патогенетического лечения туннельных невропатий [2, 3, 4, 13, 17]. Применение глюкокортикоидов обосновано противовоспалительным и противоотечным действиями непосредственно в тканях, в которые они вводятся, а также ремиелинизирующим действием при локальных аутоиммунных поражениях периферических нервов. Однако необходимо учитывать и возможное системное действие гормонов, поэтому в начале терапии целесообразно применение растворов короткодействующих глюкокортикоидов для оценки не только эффективности, но и безопасности этого вида лечения, а в отсутствие значимых побочных явлений (отеки, дисменоррея, неконтролируемая гипергликемия и/или артериальная гипертензия и т. п.) и в случае недостаточной эффективности препаратов короткого действия возможно осторожное применение микрокристаллических суспензий.
Нестероидные противовоспалительные препараты, по нашему мнению, также имеют потенциал для успешного использования в локальной инъекционной терапии туннельных синдромов. С учетом отсутствия системных публикаций на данную тему в доступной отечественной и зарубежной литературе приводим собственные данные по оценке эффективности использования раствора мелоксикама (Мовалиса 1 % – 1,5 мл) в комплексной терапии пациентов с туннельными синдромами различной локализации дополнительно к традиционным методам лечения.
Нами были обследованы 43 человека с клиническими проявлениями туннельных синдромов различной локализации: 14 мужчин и 29 женщин. Средний возраст обследованных составил 54,5 ± 5,4 года с разбросом от 44 до 65 лет. Компрессионно-ишемические синдромы у обследованных пациентов распределились следующим образом: карпальный туннельный синдром – 19 человек (44,2 % случаев), кубитальный туннельный синдром – 13 (30,2 % случаев) человек, фибулярный – 9 (20,9 % случаев) и тарзальный туннельный синдром – 2 (4,7 % случаев) человека.
Все пациенты были рандомизированы в случайном порядке на 2 группы в зависимости от назначенного лечения, включившего традиционный комплекс медикаментозных и немедикаментозных консервативных методов (иммобилизация пораженной конечности, лечебная физкультура и физиотерапевтическое воздействие, противовоспалительная терапия НПВП и противоболевая терапия с использованием антиконвульсантов и антидепрессантов, противоотечные препараты, антиоксиданты и нейротрофические средства), а также новокаиновую блокаду с дексазоном в область физиологического туннеля, для пациентов основной группы дополненную введением раствора Мовалиса (1 % – 1,5 мл) № 5 по черездневной схеме.
В основную (первую) группу вошли 22 человека (8 мужчин, 14 женщин), во вторую (контрольную) – 21 пациент (6 мужчин, 15 женщин), сопоставимые также по средним значениям возраста (55,5 ± 5,5 и 53,5 ± 5,3 года соответственно, при уровне р = 0,245, рассчитанном по методу Т-test Стьюдента).
При анализе клинической картины на этапе до начала лечения основной жалобой больных было онемение в областях конечностей, соответствующих зоне иннервации компримированных нервов, которое определялось у всех обследованных пациентов в обеих группах. Болевая гипестезия была выявлена у 17 (77,3 %) человек первой группы и у 15 (71,4 % случаев) – второй и статистически значимо не различалась при уровне р = 0,661, рассчитанном методом Хи-квадрат. При этом клинически выявленные гипотрофии определены лишь у 4 больных каждой из обследованных групп (18,2 и 19,1 % соответственно), у которых была выявлена и мышечная слабость (от 3 до 4 баллов), прямо коррелирующая со степенью отмеченной гипотрофии.
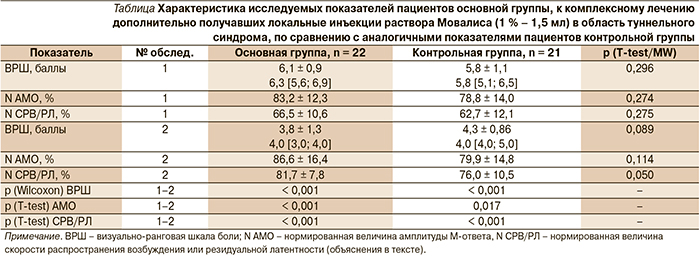
Проведенный тест Тинеля был положительным у 14 пациентов (63,6 % случаев) основной группы и у 11 (52,4 %) контрольной, что не имело статистически значимых различий на уровне р = 0,455 по методу Хи-квадрат. Степень выраженности болевого синдрома, определенная по визуально-ранговой шкале (ВРШ) от 0 до 10 баллов, также не различалась в обследованных группах на уровне р = 0,296 по методу Манна–Уитни и составляла в среднем 6,1 ± 0,9 балла, медиана – 6,3, квартильный разброс (25–75 перцентилей) – 5,6–6,9 балла для основной группы и 5,8 ± 1,1 (5,8 [5,1; 6,5]) – для контрольной (см. таблицу).
С целью объективизации клинических проявлений туннельных синдромов, подтверждения уровня и характера поражения периферических нервов в области предполагаемой компрессии пациентам обеих групп было проведено стандартное ЭНМГ-обследование с анализом амплитудных и временных/скоростных электрофизиологических показателей. Для унификации полученных результатов и проведения корректного сопоставления показатели были нормированы по отношению к 100 % величины, за которую в случае анализа амплитуд М-ответов (АМО) принималось минимальное значение нормы в 6,0 мВ для локтевого нерва и 3,5 мВ для срединного, большеберцового и малоберцового нервов [5]. При нормировании скоростей распространения возбуждения (СРВ) по исследованным нервам ориентировались на минимальные нормальные значения в 50 м/с для нервов рук и 40 м/с для нервов ног с целью оценки степени компрессии в кубитальном и фибулярном каналах соответственно. Для объективизации карпального и тарзального синдромов нормировали полученные значения резидуальной латентности (РЛ) по отношению к верхней границе нормы, определенной на уровне 2,5 мс для срединного и 3,0 мс – для большеберцового нервов. Все полученные таким образом данные статистически значимо не отличались от параметров нормального распределения по результатам проверки при помощи критерия Шапиро–Уилка на уровне р > 0,05, а их средние значения составили 83,2 ± 12,3 и 78,8 ± 14,0 % для нормированных показателей АМО в первой и второй группах соответственно. При этом, как видно из данных таблицы, статистика Стьюдента по сравнению двух независимых величин не выявила между ними значимого отличия (р = 0,274), дополнительно подтвердив сопоставимость рандомизированных групп в начале исследования. Исходные средние значения СРВ/РЛ в основной группе составили 66,5 ± 10,6 %, в контрольной – 62,7 ± 12,1 %, что также статистически значимо не различалось при уровне р = 0,275.
Повторное обследование проведено через две недели после начала соответствующей терапии в каждой группе в сходных условиях с анализом изучаемых параметров в динамике и межгрупповым сопоставлением полученных результатов. На момент контроля ведущей жалобой всех больных обеих групп по-прежнему было ощущение онемения в дистальных отделах пораженных конечностей. Вместе с тем его выраженность субъективно уменьшилась и в основном проявлялась после либо физической активности, либо статической нагрузки, либо ночного сна. Клинически выявляемая болевая гипестезия также сохранила свое исходное распределение, равномерно уменьшившись у четверых пациентов с полным восстановлением чувствительности в каждой из обследованных групп после проведенного лечения (59,1 и 52,4 % случаев соответственно). Изменений степени мышечных гипотрофий и слабости зафиксировано не было.
Субъективная оценка боли по ВРШ на момент контрольного исследования составила в среднем 3,8 ± 1,3 балла при медианно-квартильном соотношении (4,0 [3,0; 4,0]) балла в первой группе и 4,3 ± 0,86 (4,0 [4,0; 5,0]) – во второй. В обоих случаях было получено статистически высокозначимое уменьшение выраженности болевого синдрома на фоне проведенной терапии при уровне р < 0,001, рассчитанном по методу Вилкоксона. При этом межгрупповое сопоставление указывало на возможную тенденцию в значимости отличия показателей ВРШ боли по статистике Манна–Уитни на уровне р = 0,089 в пользу пациентов основной группы, которым дополнительно проведены блокады с Мовалисом (см. таблицу).
Анализ динамики нормированных АМО на фоне проведенного лечения выявил некоторое нарастание средних значений в первой группе обследованных – до 86,6 ± 16,4 % и до 79,9 ± 14,8 % – во второй, что, тем не менее, было подтверждено в качестве значимого улучшения посредством статистики Вилкоксона на уровне р < 0,001 и р = 0,017 соответственно. При этом достоверной разницы в результатах восстановления функции поврежденных аксонов в местах компрессии в зависимости от использованного терапевтического комплекса отмечено не было, согласно параметрической статистике Стьюдента с уровнем р = 0,114. В свою очередь в таблице отражены признаки отмеченного восстановления миелиновой оболочки декомпримированных нервов, которое было объективизировано как существенным приростом нормированных СРВ/РЛ в пределах 13–19 % на фоне лечения при р < 0,001 по методу Стьюдента для зависимых выборок, так и пограничным значением различия средних по группам, составившим 81,7 ± 7,8 и 76,0 ± 10,5 % на уровне р = 0,050.
Таким образом, добавление локальных инъекций с раствором Мовалиса в использованной дозе и кратности уже на раннем этапе проводимой комплексной терапии изученных туннельных синдромов верхних и нижних конечностей позволило объективизировать преимущественный клинический эффект с более полным воздействием на патогенетические механизмы, лежащие в основе обратимого периферического аксоплазматического сдавления обследованных нервов, при доступности процедур для лечащего врача и хорошей переносимости пациентами.
Альтернативной методикой патогенетической терапии туннельных невропатий в отсутствие у врача навыков проведения блока служат компрессы с димексидом, анестетиками, глюкокортикоидами и витаминами груп-пы В на 20–30 минут в области повреждения нерва. Курс терапии составляет до 5 процедур, проводимых ежедневно или через день. При непереносимости димексида можно проводить ультразвуковую терапию с гидрокортизоновой мазью. Количество процедур – от 10 до 15, однако эффективность этого вида терапии ниже [7].
Для симптоматической терапии невропатического болевого синдрома при туннельных невропатиях применяются антиконвульсанты, трициклические антидепрессанты и трансдермальные системы с лидокаином. Антидепрессанты (это относится к трициклическим, например амитриптилину, а также к селективным ингибиторам обратного захвата серотонина и норадреналина, например дулоксетину, венлафаксину) повышают активность эндогенной подавляющей боль (антиноцицептивной) системы мозга за счет повышения концентрации ключевого нейромедиатора антиноцицептивной системы – норадреналина. Антиконвульсанты со своей стороны эффективно «успокаивают» расторможенные ноцицептивные структуры головного и спинного мозга, подавляя периферическую и центральную сенситизацию, являющуюся основным патогенетическим механизмом формирования невропатической боли при поражении периферических нервов [2, 3, 9].
Для патогенетической терапии туннельных невропатий в зависимости от преобладающих механизмов поражения нервов также могут применяться антиоксиданты (α-липоевая кислота), ингибиторы холинестеразы (прозерин, ипидакрин), вазоактивные препараты (пентоксифиллин, гингко-билоба и др.), репаранты (солкосерил, актовегин). В качестве физиотерапевтических мероприятий наиболее эффективны массаж дистальнее и проксимальнее места компрессии, ультразвук с глюкокортикоидами на область компрессии, электрофорез с лидазой [4, 5, 7, 8, 14, 17]. Используются методики мануальной терапии (неоперативный невролиз), позволяющие воздействовать на механизм гиперфиксации нерва за счет уменьшения рубцово-спаечного процесса в туннеле. При наличии мышечно-тонического синдрома и/или поражения фасеточных суставов при МАС-синдроме необходимо воздействие на всех уровнях поражения аксональных транспортных систем, в т. ч. и на вертебральном, что также может требовать участия вертеброневролога [4, 13, 19].
Ключевым направлением в симптоматическом и патогенетическом лечении острой боли в спине является применение НПВП, блокирующих выработку медиаторов воспаления – простагландинов – за счет ингибирования фермента циклооксигеназы (ЦОГ). Эти препараты должны назначаться в качестве первого шага ступенчатой терапии боли в спине, прежде всего врачами общей практики (терапевтами, врачами ЛФК, хирургами, семейными врачами и даже провизорами аптек), а не только узкими специалистами (неврологами, ортопедами, ревматологами) [1, 2, 9].
Следует иметь в виду и другое: эта группа препаратов обладает рядом существенных побочных эффектов. Открытие двух изоформ ЦОГ: тканевой, или конституциональной, ЦОГ-1, постоянно присутствующей в большинстве тканей, и индуцибельной – ЦОГ-2, существенно увеличивающей свой уровень на фоне воспаления, позволило лучше понимать механизмы, лежащие в основе эффективности и токсичности НПВП. Обе изоформы ЦОГ продуцируются и в периферических тканях, и в клетках ЦНС. Под влиянием ЦОГ-1 осуществляется синтез простагландинов, участвующих в реализации физиологических функций. ЦОГ-2 образуется в зоне воспаления, в клетках спинного и головного мозга под действием повреждающих стимулов с периферии. Неселективные НПВП блокируют активность обеих изоформ ЦОГ, что приводит к ряду побочных эффектов, связанных с ингибированием ЦОГ-1, прежде всего к поражению желудочно-кишечного тракта, причем на всем его протяжении (стоматит, эзофагит, гастрит, язва желудка и двенадцатиперстной кишки, энтерит, язвенный колит, проктит). Следует обратить внимание на то, что, являясь хорошими анальгетиками, неселективные НПВП блокируют висцеральные болевые ощущения, и язвенное поражение желудочно-кишечного тракта у таких больных зачастую протекает бессимптомно, заканчиваясь либо кровотечением, либо перфорацией язвы с последующим развитием перитонита. Применение парентеральных форм неселективных НПВП (инъекции и суппозитории) не позволяет избегать вышеуказанных побочных явлений, т. к. при этом создается высокая концентрация препарата в сыворотке крови, что сопровождается системным воздействием на организм. Нестероидные противовоспалительные препараты, обладающие повышенной избирательностью по отношению к индуцибельной ЦОГ, т. е. селективные блокаторы изофермента ЦОГ-2, имеют более высокую, чем неселективные, степень безопасности в отношении желудочно-кишечного тракта. Выделяют избирательно селективные ЦОГ-2-ингибиторы (мелоксикам, нимесулид) и высокоселективные (или специфические) ЦОГ-2-ингибиторы (коксибы), при этом, чем выше селективность НПВП по отношению к ЦОГ-2, тем выше риск сосудистых осложнений [2]. Именно поэтому ряд высокоселективных ЦОГ-2-ингибиторов, например вальдекоксиб, был запрещен к применению. Использование нимесулидов в большинстве европейских стран и США запрещено или ограничено 14-дневным сроком ввиду их высокой гепатотоксичности и риска развития фульминантного некроза печени. С учетом вероятности риска развития эрозивно-язвенных процессов в желудке больных с высоким риском НПВП-гастропатий на фоне приема селективных ингибиторов ЦОГ-2 также оправданна профилактика осложнений в виде назначения ингибиторов протонной помпы (омепразола), мизопростола. Наилучший профиль безопасности среди НПВП в отношении желудочно-кишечного тракта показал мелоксикам (Мовалис), являющийся производным энолиновой кислоты [1]. Таким образом, НПВП группы селективных ингибиторов ЦОГ-2, например Мовалис, в дозе 15 мг 1 раз в день могут считаться препаратом выбора для купирования острых болевых синдромов во всех случаях, когда необходимо максимально быстро устранить боль, не вызывая серьезных побочных эффектов. При однократном применении Мовалис обладает кумулятивными свойствами с достижением максимальной его концентрации через 3–5 дней приема. Именно поэтому для более быстрого получения лечебного эффекта целесообразно проводить т. н. ступенчатую терапию, которая заключается во внутримышечном введении 15 мг Мовалиса в первые три дня лечения, а затем переводе больного на таблетированную форму Мовалиса по 15 мг в течение 20 дней. Дополнительной возможностью быстрого купирования боли при МАС-синдроме стало появление новой пероральной формы препарата Мовалис в форме суспензии по 15 мг (2 мерные ложки), которая по сравнению с таблетированной формой имеет улучшенную фармакокинетику – ускоренное всасывание (Tmax 3–7часов), обеспечивающее начало действия препарата через 30 минут после приема, с достижением Сmax через 2 часа, что позволяет быстрее купировать выраженный миофасциальный и/или фасеточный болевой синдром в шейном отделе позвоночника при МАС-синдроме в тех случаях, когда отсутствует возможность применения инъекций. Таким образом, новая форма мелоксикама в виде суспензии дает возможность врачам амбулаторной практики использовать суспензию как альтернативу быстрым таблетированным формам НПВП, таким как лорноксикам, нимесулид, коксибы и др.
Воздействие на шейный миофасциальный синдром при МАС-синдроме может осуществляться введением в триггерные зоны мышц растворов анестетика (2 %-ного лидокаина или 0,5 %-ного новокаина) и 1,5 мл 1 %-ного раствора Мовалиса путем паравертебральных блокад. Показана также эффективность фораминальных блокад с использованием глюкокортикоидов в лечении хронических радикулопатий, играющих ключевую роль в патогенезе МАС-синдрома [10].
Для активации регенеративных процессов в периферических нервах успешно применяется нейротропный комплекс Мильгамма, содержащий большие дозы витаминов группы В (В1 В6, B12) и лидокаин. Применение витамина В12 способствует не только ремиелинизации, но и снижению интенсивности болевого синдрома. Пиридоксин (В6) участвует в синтезе сфингозина – структурного элемента мембраны нервного волокна, и нейромедиаторов (серотонина, норадреналина). Таким образом, оба нейротропных компонента улучшают скорость проведения нервного импульса, улучшают его репаративные свойства. Доказано патогенетическое воздействие тиамина на улучшение аксоплазматического тока и восстановление трофической функции нейрона. Анестетик лидокаин в составе Мильгаммы предназначен для обеспечения безболезненности процедуры инъекции, что повышает комплаенс больных. Наиболее эффективен курс из 10 внутримышечных инъекций Мильгаммы с последующим переходом на драже Мильгамма-композитум 2–3 раза в день в течение 2–8 недель (в зависимости от тяжести невропатии). Курс нейротропной терапии при МАС-синдроме повторяется 2 раза в год [3, 4, 11].
Понимание патогенетических механизмов развития туннельной невропатии у каждого конкретного пациента обусловливает индивидуальный подбор этиотропной, патогенетической и симптоматической терапии, способной не только облегчить состояние больного (уменьшить выраженность болевого синдрома, купировать воспаление и отек, улучшить вегетативно-трофические функции), но и предотвратить появление повторных компрессий периферических нервов. Прогноз пациента с туннельной невропатией зависит от своевременного начала терапии – до наступления необратимых метаболических процессов в нерве, а также атрофии и контрактур в иннервируемых мышцах.



