Введение
Рак молочной железы (РМЖ) является наиболее частым онкологическим заболеванием и ведущей причиной смертности от рака среди женщин в Европе [1]. Распространенность и заболеваемость в России в 2012 г. составили соответственно 381,2 и 39,2 случая на 100 тыс. населения [2].
В результате повышения качества лечения на ранних стадиях заболевания в большинстве развитых стран численность пациенток с метастатическим РМЖ (мРМЖ) сократилась, однако приблизительно у трети женщин, получавших когда-либо лечение по поводу ранних стадий болезни, в конечном итоге развивается метастатический рак [3]. Кроме того, примерно у 6 % пациенток мРМЖ диагностируется при первом обращении к врачу [1].
Появление в последние годы большого количества новых препаратов способствует увеличению выживаемости больных мРМЖ [4], однако по-прежнему остаются пациентки, у которых либо отсутствует ответ на терапию, либо со временем развивается резистентность к ней, и в этой ситуации мРМЖ становится фатальным заболеванием [5–7]. Кроме того, следует отметить, что достижения в лекарственной терапии последних лет касались главным образом лечения HER2-положительного РМЖ (лапатиниб, пертузумаб, трастузумаба эмтанзин) [1, 8–10], а также совершенствования лекарственных форм уже имеющихся препаратов, например разработка наб-паклитаксела, что позволяет применять паклитаксел в более высоких дозах [11]. В то же время возможности терапии мРМЖ на более поздних этапах (после нескольких линий химиотерапии), а также РМЖ с тройным негативным фенотипом, который составляет 15–20 % всех случаев и отличается агрессивным течением, по-прежнему ограничены [12–14].
Поскольку мРМЖ все еще остается неизлечимым заболеванием, одной из главных целей лечения наряду с поддержанием хорошего качества жизни, в т. ч. путем уменьшения токсичности препаратов, является продление ее сроков. Вместе с тем среди исследований, проведенных с участием женщин с мРМЖ, редко встречаются такие, в которых в качестве первичной конечной точки была выбрана общая выживаемость, хотя для многих пациенток даже при наличии риска токсичности терапии большое значение имеют ее преимущества в отношении выживаемости [15, 16]. Поиск публикаций, проведенный в сентябре 2010 г., выявил данные только о пяти исследованиях III фазы с участием пациенток с мРМЖ, ранее получавших антрациклины и таксаны, и только в одном из них общая выживаемость была выбрана в качестве конечной точки (которая не была достигнута) [15].

В связи с недостаточным объемом исследовательских данных, которые показывали бы увеличение выживаемости среди пациенток с мРМЖ, отсутствует какой-либо стандарт лечения больных мРМЖ, ранее получавших терапию, особенно женщин с тройным отрицательным подтипом заболевания [1, 15, 17, 18]. Вместо этого при выборе схемы терапии рассматриваются такие аспекты, как предыдущее лечение, время до рецидива, предпочтения пациенток и врачей, доступность лекарственных препаратов, токсичность и качество жизни [1, 5, 6].
В данном обзоре рассматривается новый химиотерапевтический препарат эрибулин, недавно одобренный в России для лечения больных местно-распространенным или мРМЖ с прогрессированием после применения не менее двух схем химиотерапии распространенного заболевания (в т. ч. антрациклины и таксаны). Одобрение эрибулина Европейским агентством по лекарственным средствам (European Medicines Agency) в 2011 г. [19] было основано на результатах исследования III фазы EMBRACE – первого исследования, в котором было продемонстрировано значительное увеличение выживаемости пациенток, ранее получавших антрациклины и таксаны по поводу метастатической болезни [15].
Эрибулин – нетаксановый ингибитор микротрубочек с уникальным механизмом действия
Эрибулина мезилат представляет собой синтетический аналог галихондрина B, первоначально выделенного из морской губки Halichondria okadai [20]. Это нетаксановый ингибитор микротрубочек, механизм действия которого отличается от механизма действия других препаратов, воздействующих на тубулин, включая таксаны, алкалоиды барвинка и эпотилоны. Он угнетает образование митотического веретена, связываясь с участками, расположенными на плюс-конце микротрубочки, тем самым селективно подавляет ее рост, не влияя на фазу укорачивания, и вызывает преобразование тубулина в изолированные нефункциональные агрегаты. Это препятствует митозу и в конечном итоге ведет к снижению пролиферации клеток и увеличению апоптоза [21–25]. Эрибулин также обладает способностью необратимо блокировать митоз, которая редко встречается среди ингибиторов микротрубочек [26].
Способность эрибулина индуцировать необратимую блокаду митоза наряду со стойким удержанием препарата в опухолевых клетках может способствовать более высокой противоопухолевой активности по сравнению с другими ингибиторами микротрубочек [4]. Кроме того, вследствие мутаций β-тубулина в опухолевых клетках может развиваться резистентность к ингибиторам микротрубочек. Однако в доклинических исследованиях клетки рака яичников, резистентные к паклитакселу, проявляли почти идентичную чувствительность к эрибулину по сравнению с нерезистентными к паклитакселу материнскими клетками [27]. Это является еще одним подтверждением уникальности механизма действия эрибулина и указывает на его потенциал с точки зрения преодоления химиорезистентности. Механизм действия эрибулина, включая его воздействие на гены в клетках кровеносных сосудов, имеющие отношение к ангиогенезу (например, на фактор роста эндотелия сосудов), ремоделирование сосудистой системы, а также на морфологию, миграцию и инвазию клеток, продолжают изучать [28–30].
На основании данных об активности эрибулина и его контролируемом профиле токсичности, зарегистрированных в исследованиях I [31–34] и II фаз [35, 36], было проведено исследование III фазы EMBRACE.
Эффективность эрибулина по сравнению с терапией по выбору врача
В исследованиях III фазы, как правило, проводится сравнение нового препарата с имеющейся стандартной терапией. Поскольку четкий стандарт лечения пациенток с местно-распространенным и мРМЖ после применения антрациклинов и таксанов отсутствует [1, 12, 17], в качестве препарата сравнения, отражающего терапевтические решения, принимаемые в реальных клинических условиях, в исследовании EMBRACE была использована терапия по выбору врача [15].
Дизайн исследования EMBRACE приведен на рисунке (a). В группе терапии по выбору врача 96 % пациенток получали химиотерапию (наиболее часто применялись винорелбин, гемцитабин и капецитабин), 4 % – гормональную и никто из пациенток не получал биологическую или оптимальную поддерживающую терапию в качестве единственного вида лечения. Исходные демографические характеристики и биологические особенности опухоли были хорошо сбалансированы между сравниваемыми группами, а выборка исследования была репрезентативной относительно общей популяции женщин с местнорецидивирующим или мРМЖ, ранее получавших лечение. Из пациенток, рандомизированных для участия в исследовании EMBRACE, 25 % представляли Восточную Европу, у 19 % присутствовал тройной негативный фенотип опухоли [15].
Применение эрибулина позволило увеличить медиану общей продолжительности жизни по сравнению с терапией по выбору врача на 2,5 месяца (13,1 и 10,6 месяца соответственно, p = 0,014), что соответствует увеличению данного показателя на 23 % (табл. 1). Это различие является не только статистически значимым, но и клинически важным для этой популяции больных [15].
Существенное и клинически значимое преимущество в выживаемости среди пациенток, получавших эрибулин, было подтверждено результатами незапланированного обновленного анализа общей выживаемости, проведенного по требованию органов нормативного регулирования как США, так и Европы (соответственно 13,2 и 10,5 месяца, p = 0,014; табл. 1) [15, 37]. Одно- и двухлетняя выживаемость составила 54,5 и 21,9 % в группе терапии эрибулином и 42,8 и 19,2 % в группе терапии по выбору врача соответственно [37].
Увеличение общей выживаемости среди пациенток, получавших эрибулин, не зависело от возраста, рецепторного статуса, предыдущей терапии капецитабином, количества пораженных органов, локализации метастазов (все эти критерии были определены заранее) и от времени до появления первого метастатического очага (незапланированный критерий) [38–40]. Поисковый анализ данных, полученных в исследовании EMBRACE, показал, что преимущество эрибулина по общей выживаемости перед терапией по выбору врача было более выраженным среди пациенток, получивших не более трех предыдущих схем терапии (13,3 и 10,7 месяца; отношение рисков [ОР] = 0,77, 95 % доверительный интервал [ДИ] – 0,61–0,90; p = 0,039), чем среди пациенток, получивших более трех предыдущих схем терапии (11,7 и 10,0 месяцев; ОР = 0,90, 95 % ДИ – 0,60–1,35; p = 0,607), хотя исследование не обладало достаточной статистической мощностью для демонстрации статистической значимости результатов данного анализа [41].
Вторичными конечными точками исследования EMBRACE были выживаемость без прогрессирования заболевания и частота объективного ответа [15]. Как и в случае общей продолжительности жизни, медиана времени до прогрессирования заболевания (согласно исследовательской оценке) была значительно выше в группе терапии эрибулином, чем в группе терапии по выбору врача (3,6 и 2,2 месяца соответственно; p = 0,002) (табл. 1). Согласно независимой оценке, медиана времени до прогрессирования была также выше среди пациенток, получавших эрибулин, однако данный результат не был статистически значимым (табл. 1).

Таким образом, фактически эрибулин стал первым препаратом, при использовании которого в монотерапии продемонстрировано статистически и клинически значимое увеличение выживаемости больных местно-распространенным и мРМЖ, получавших ранее антрациклины и таксаны. Результаты исследования EMBRACE и последующее одобрение эрибулина в США (2010) [42] и Европе (2011) [19] показывают, что увеличение продолжительности жизни пациенток, страдающих мРМЖ, является реальной и достижимой целью.
Эффективность эрибулина на ранних этапах лечения мРМЖ
Приблизительно в одно время с исследованием EMBRACE началось второе исследование III фазы, в котором проводилось сравнение терапии эрибулином и капецитабином женщин с местно-распространенным и мРМЖ. Капецитабин является одобренным и широко применяемым в этой группе больных препаратом монохимиотерапии в Европе [12, 43, 44], хотя его преимущества в отношении выживаемости не изучались в рамках исследования с достаточной статистической мощностью.
Дизайн исследования 301 приведен на рисунке (б). Критерии включения были аналогичны таковым в исследовании EMBRACE, пациентки получали исследуемый препарат в первой, второй или третьей линиях терапии местно-распространенного или метастатического заболевания, в то время как в исследовании EMBRACE исследуемый препарат применялся только в терапии третьей и последующих линий [15, 43]. Исходные демографические характеристики пациенток и биологические особенности опухолей были в целом хорошо сбалансированы [43]. Медиана числа предыдущих схем химиотерапии была равна 2, при этом большинство больных получали исследуемый препарат в первой (20,0 %) или второй (52,0 %) линиях терапии метастатического заболевания [45]. Примерно у четверти пациенток из числа рандомизированных в данное исследование опухоли имели тройной отрицательный фенотип [43].
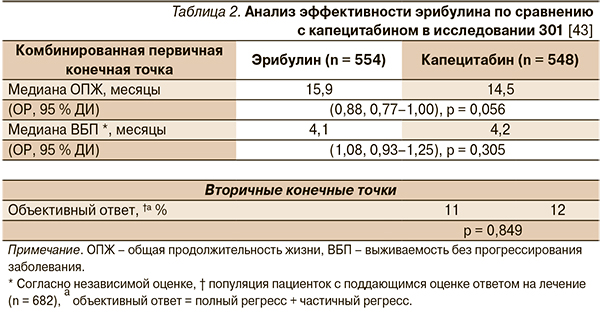
В качестве комбинированной первичной конечной точки исследования 301 были выбраны общая выживаемость и выживаемость без прогрессирования заболевания. Терапия эрибулином обеспечила более длительную общую продолжительность жизни по сравнению с капецитабином, однако это отличие не было статистически значимым (15,9 и 14,5 месяца, p = 0,056; табл. 2). Тенденция к большей продолжительности жизни в группе терапии эрибулином наметилась уже на раннем этапе и сохранилась на протяжении всего исследования. Одно-, двух- и трехлетняя выживаемость среди пациенток, получавших эрибулин и капецитабин, составила соответственно 64,4 и 58,0 % (p = 0,035), 32,8 и 29,8 % (p = 0,324) и 17,8 и 14,5 % (p = 0,175) [43].
Согласно независимой оценке, в группах терапии эрибулином и капецитабином получены сходные показатели времени до прогрессирования заболевания (4,1 и 4,2 месяца, p = 0,305) (табл. 2). Отмеченная тенденция к увеличению общей выживаемости без увеличения выживаемости без прогрессирования заболевания среди пациенток, получавших эрибулин, могла быть обусловлена несбалансированностью терапии, полученной после окончания исследования: эрибулин был одобрен ближе к завершению исследования, что ограничило число пациенток, которые смогли перейти с капецитабина на эрибулин. В сравниваемых группах была также зарегистрирована сходная частота объективного ответа (11,0 и 11,5 %; p = 0,849) (табл. 2) [43].
Токсичность и безопасность эрибулина
В исследовании EMBRACE отсутствовала возможность оценить влияние исследуемого препарата на качество жизни, т. к. использование различных препаратов терапии по выбору врача осложнило бы интерпретацию данных [15]. Однако, поскольку поддержание качества жизни пациентки является одной из основных целей терапии мРМЖ, оно оценивалось в качестве вторичной конечной точки в исследовании 301. У пациенток, получавших эрибулин, улучшение как общего состояния здоровья (общего качества жизни), так и когнитивной функции было значительно более выраженным, чем у пациенток, получавших капецитабин (6,5; p = 0,048 и 15,3; p < 0,001 соответственно). При этом эмоциональное состояние улучшилось в большей степени у пациенток, получавших капецитабин, чем у пациенток, получавших эрибулин (3,3; p = 0,033). Что касается побочных эффектов, то осложнения со стороны желудочно-кишечного тракта (включая тошноту, рвоту и диарею) чаще встречались в группе капецитабина, а нарушение вкусовых ощущений, приливы и алопеция – в группе эрибулина [46].
Нежелательные явления, отмеченные в исследованиях EMBRACE и 301, соответствовали выявленному ранее профилю побочных эффектов эрибулина. Общая частота и доля серьезных нежелательных явлений у пациенток, получавших эрибулин, в обоих исследованиях были сопоставимыми. Доля пациенток, у которых были отмечены нежелательные явления, приведшие к прекращению лечения, была сопоставимой в обоих исследованиях. Наиболее распространенные нежелательные явления, отмеченные не менее чем у 25 % пациенток, представлены в табл. 3 [15, 43].
Наиболее распространенными проявлениями гематологической токсичности 3/4-й степеней тяжести (отмеченными не менее чем у 10 % пациенток) после терапии эрибулином в исследованиях EMBRACE и 301 были нейтропения (45 и 46 % соответственно) и лейкопения (14 и 15 % соответственно) [15, 43]. Нейтропения была причиной редукции доз и увеличения интервалов между введениями, а также назначения гранулоцитарного колониестимулирующего фактора [15]. Частота фебрильной нейтропении, связанной с применением эрибулина, была низкой (5 и 2 % больных, получавших эрибулин в исследованиях EMBRACE и 301 соответственно) [15, 43].
В исследовании EMBRACE наиболее распространенным нежелательным явлениям, приведшим к прекращению терапии эрибулином, стала периферическая нейропатия (всех степеней тяжести), отмеченная у 35 % пациенток и приведшая к прекращению лечения 5 % пациенток. В исследовании 301 периферическая сенсорная нейропатия была отмечена у 13 % пациенток, получавших эрибулин, и у 7 % пациенток, получавших капецитабин [43].
В недавнем исследовании II фазы (n = 104) сообщается о более низкой частоте периферической нейропатии после терапии эрибулином по сравнению с иксабепилоном: все степени тяжести – 31 и 44 % соответственно, и 3/4-й степеней тяжести – 10 и 20 % соответственно. В группе терапии эрибулином было меньше пациенток, прекративших лечение вследствие нежелательных явлений, чем в группе терапии иксабепилоном (12 и 32 % соответственно) [47, 48].
Таким образом, результаты анализа безопасности, проведенного в исследованиях EMBRACE и 301, показывают, что эрибулин хорошо переносится и имеет клинически приемлемый и контролируемый профиль побочных эффектов. Эрибулин является водорастворимым и для приготовления не требует липофильных растворителей, в связи с чем исчезает необходимость в премедикации для профилактики реакций гиперчувствительности [49].
Эффективность эрибулина в различных подгруппах больных
В исследованиях EMBRACE и 301 было продемонстрировано, что эрибулин эффективен в различных подгруппах пациенток. Результаты субанализов показали, что в отдельных популяциях пациенток его эффект может быть еще более выраженным.
Запланированные заранее поисковые анализы данных, полученных в исследованиях EMBRACE и 301, свидетельствуют о возможном более выраженном эффекте эрибулина в подгруппе пациенток с тройным отрицательным фенотипом заболевания по сравнению с терапией по выбору врача (9,5 и 7,0 месяца; ОР = 0,71, 95 % ДИ – 0,46–1,10) [50] и капецитабином (14,4 и 9,4 месяца; ОР = 0,78, 95 % ДИ – 0,55–0,90; p = 0,0062) [45].

Кроме того, результаты заранее запланированного поискового анализа данных, полученных в исследовании 301, указывают на то, что преимущество эрибулина перед капецитабином по общей выживаемости является более выраженным среди пациенток с HER2-отрицательным (15,9 и 13,5 месяца; ОР = 0,84; 95 % ДИ – 0,73–0,98; p = 0,0299) и ER-отрицательным заболеваниями (14,4 и 10,5 месяца; ОР = 0,78, 95 % ДИ – 0,64–0,96; p = 0,0162). Более выраженный эффект в отношении общей выживаемости наблюдался при терапии эрибулином пациенток с невисцеральными проявлениями болезни, поражением нескольких органов, прогрессированием более чем через 6 месяцев после последней химиотерапии, наличием терапии антрациклинами и (или) таксанами в анамнезе.
Таким образом, данные, полученные в исследованиях III фазы, свидетельствуют, что эрибулин обеспечивает существенное и клинически значимое увеличение выживаемости ранее леченных пациенток с мРМЖ по сравнению с терапией по выбору врача и сравнимую эффективность лечения по сравнению с широко применяемым препаратом капецитабин. Помимо высокой эффективности эрибулин обладает хорошей переносимостью, клинически приемлемым и контролируемым профилем побочных эффектов.
Особый интерес представляют результаты субанализов данных, полученных в этих исследованиях, указывающие на то, что в отдельных подгруппах больных эффект эрибулина может быть более выраженным, что заслуживает дальнейшего изучения. В настоящее время продолжаются исследования по изучению действия эрибулина при тройном отрицательном и HER2-положительном подтипах заболевания, а также на более ранних стадиях РМЖ, в т. ч. в комбинации с другими препаратами.



