Введение
Согласно данным Всемирной организации здравоохранения, употребление амфетаминов является наиболее распространенным после каннабиоидов – более 35 млн человек регулярно употребляют амфетамины/метамфетамины. За последние десятилетия произошел значительный рост количества синтетических веществ данной группы, более того, они становятся наиболее доступными и популярными запрещенными веществами, получившими широкое распространение среди лиц молодого возраста. Широкую распространенность получило употребление психостимуляторов метамфетаминового ряда и в популяции больных шизофренией. Пациенты с шизофренией в 6,4 раз чаще имеют зависимость от психоактивных веществ (ПАВ), чем в общей популяции [11].
Среди психиатров наибольшее распространение получила теория «самолечения», предложенная E.J. Khantzian [7], заключающаяся в рассмотрении применения психостимуляторов больными шизофренией как попытки облегчить процессуальные симптомы. Другие исследователи считают, что больные шизофренией употребляют ПАВ с целью уменьшения негативных и аффективных проявлений заболевания, прежде всего апатии, ангедонии, депрессии [12]. Однако из клинической практики известно, что употребление ПАВ очень часто приводит к ухудшению психического состояния пациентов. В последнее время появляются работы, посвященные исследованиям взаимосвязи выраженности аффективных нарушений и употребления ПАВ среди больных шизофренией. При этом в большинстве случаев невозможно выяснить, являются ли проявления депрессии и тревоги вторичными или первичными по отношению к употреблению ПАВ.
В некоторых работах показано, что употребление алкоголя, каннабиоидов, кетамина, ЛСД и ПАВ может индуцировать проявление симптомов деперсонализации и дереализации [12].
У больных шизофренией, употребляющих психостимуляторы, чаще диагностируются аффективные и поведенческие нарушения, а обострения течения шизофрении связаны с возобновлением употребления ПАВ.
С биологической точки зрения употребление ПАВ больными шизофренией представляется парадоксальным: позитивные симптомы шизофрении, согласно дофаминовой теории, связаны с гиперпродукцией дофамина, а психостимуляторы как раз повышают выброс дофамина в ЦНС, причем в тех же структурах (лимбическая система, базальные ядра, префронтальная кора и т. д.), что и при развитии приступа шизофрении. Механизм действия амфетаминов связан прежде всего с высвобождением норадреналина, дофамина и серотонина из пресинаптических нервных окончаний, ингибицией обратного захвата норадреналина и дофамина.
Данный парадокс привносит некоторые сомнения в правильности гипотезы самолечения. В то же время открывается и альтернатива: пациенты, страдающие шизофренией, биологически уязвимы к дофаминовым эффектам психостимуляторов.

Действительно, согласно данным ряда авторов, амфетамин способен вызывать «сенсибилизацию» [2]. Сенсибилизация ассоциирована с усилением вызываемого ПАВ выброса дофамина в терминальных полях аксонов [8]. Усиленный выброс дофамина в ответ на прием амфетамина больными шизофренией был выявлен в нейровизуализационных исследованиях нескольких авторов [1], что еще раз обосновывает сходство патогенетических механизмов при развитии амфетаминовых психозов и шизофрении.
Установлено, что вследствие постепенного истощения дофаминовой системы при хроническом употреблении ПАВ метамфетамины служат причиной сокращения плотности рецепторов допамина в мезолимбической, мезокортикальной и нигростриальной областях головного мозга.
Хроническое употребление амфетаминов способствует образованию пролонгированного психоза. Трудность дифференциальной диагностики психотических расстройств при употреблении ПАВ и шизофрении может быть обусловлена определенной схожестью нарушений функционирования нейромедиаторных систем.
Длительное время продолжается дискуссия о возможной стратегии дифференцирования данных психотических состояний, однако четких клинических дифференциальных критериев не выявлено. На основании литературных данных, посвященных вышеуказанной проблеме, можно констатировать следующее:
Неосложненный амфетаминовый психоз редуцируется быстро, если прекращается употребление наркотика, за исключением пациентов, страдающих шизофренией, характеризуется персекуторными бредовыми идеями, слуховыми и зрительными галлюцинациями [3].
Клинически острый амфетаминовый психоз фактически не отличим от приступа параноидной шизофрении [5].
У потребителей ПАВ, имеющих в анамнезе амфетаминовый психоз, в 5 раз больше вероятность возникновения шизофрении, чем у потребителей метамфетамина, не переносивших такой психоз [4].
Таким образом, особенности течения амфетаминового психоза затрудняют дифференциальную диагностику с острым приступом шизофрении на фоне употребления ПАВ.
В работах, посвященных изучению течения шизофрении с коморбидной наркологической патологией, отмечается более выраженная прогредиентность: увеличение частоты обострений, частоты сопутствующих употреблению ПАВ инфекционных и соматических заболеваний, случаев агрессивного и аутоагрессивного поведения. Клиническая картина характеризуется в целом большей резистентностью к психофармакотерапии.
После купирования позитивных расстройств на первый план в клинической картине выступают негативные и когнитивные нарушения той или иной степени выраженности.
Недостаточность когнитивных функций является базовым расстройством в структуре шизофрении. На сегодняшний день общепризнанной считается концепция наличия специфического когнитивного дефицита у больных шизофренией, затрагивающего различные сферы внимания, памяти, исполнительскую функцию [6].
Именно выраженность когнитивного дефицита во многом определяет социальное функционирование больных и долговременный прогноз течения заболевания, в связи с тем что когнитивные нарушения диагностируются у больных вне зависимости от наличия или отсутствия обострений и не прослеживается степень их выраженности от количества перенесенных обострений. Принято считать, что нарушения когнитивных функций напрямую связаны с альтерацией различных нейроморфологических структур головного мозга, прежде всего префронтальной коры и лимбической системы. При употреблении ПАВ в патогенетический процесс также вовлекаются вышеуказанные структуры головного мозга. Соответственно, логично предположить, что у больных шизофренией, употребляющих ПАВ, когнитивный дефицит должен быть более выражен по сравнению с пациентами без наличия наркологической коморбидной симптоматики.
Работы, в которых отражены результаты медикаментозной терапии психотических расстройств, вызванных употреблением амфетаминов, показали, что наиболее целесообразно применение антипсихотиков второго поколения: оланзапина [9], рисперидон и арипипразол [10].
Дизайн исследования
Основной целью настоящего исследования явились определение дифференциально-диагностических критериев для разграничения случаев параноидной шизофрении, сочетающихся с употреблением ПАВ амфетаминого ряда, от приступов этого заболевания в отсутствие такой зависимости и разработка дифференцированной антипсихотической терапии пациентов с коморбидной патологией в виде зависимости от ПАВ.
Основная задача включала проведение сравнительного анализа скорости наступления и выраженности лечебного эффекта при применении антипсихотиков второго поколения.
Кроме того, основная задача заключалась в проведении сравнительного анализ когнитивного функционирования больных после купирования обострения у пациентов с наличием указанной зависимости и больных шизофренией в отсутствие в анамнезе указаний на употребление ПАВ.
Материал исследования. Иссле-дование проведено на базе отделения биологической терапии психически больных НИИ им. В.М. Бехтерева. В процессе сбора анамнестических данных, клинического обследования было выделено две группы больных: первая группа – 25 пациентов, страдавших параноидной шизофренией (F 20.0 согласно МКБ-10), у которых психотическое состояние развилось после длительного употребления ПАВ. Вторая группа – 28 больных параноидной шизофренией без указаний на употребление ПАВ в анамнезе. Сводные демографические характеристики больных представлены в табл. 1.
В обеих группах преобладали мужчины: 15 – в группе употребляющих ПАВ и 19 – в группе без употребления ПАВ.
Клиническая картина обострения включала симптомы, соответствующие критериям диагноза «шизофрения параноидная» F 20.0 по МКБ-10. Для пациентов, уже имевших в анамнезе психотический приступ, мотивом к возобновлению употребления ПАВ стали тяга к ПАВ, нарушения аффективной сферы в виде затяжной гипотимии, дистимических состояний, астено-апатические проявления в рамках негативного симптомокомплекса. Следует отметить, что при возобновлении приема ПАВ такими пациентами экзацербация параноидной симптоматики возникала достаточно быстро – через 2–3 месяца от начала употребления ПАВ. Манифестации, как правило, предшествовало увеличение частоты и кратности употребляемых ПАВ – до 0,5–1,0 г в сутки амфетамина/метамфетамина, а также прием ПАВ в течение нескольких дней подряд. Поводом к обращению служило развитие на высоте продолжительного и интенсивного наркотического эксцесса острой психотической симптоматики с экзогенными включениями. Однако через несколько часов или 1–2 дня экзогенные включения редуцировались, а в психическом статусе больных превалировала параноидная симптоматика. В структуре параноидного приступа у больных данной группы на первый план выступали галлюцинаторно-бредовые расстройства, аффективные нарушения с преобладанием депрессивного полюса, особенно выраженного на выходе из психотического состояния, недостаточная критическая оценка своего состояния.
Длительность стационарного лечения составляла от одного до трех месяцев. Купирование психотической симптоматики, сопровождавшейся той или иной степени выраженности психомоторным возбуждением, проводилась галоперидолом до 20 мг в сутки в первую неделю. В дальнейшем пациенты переводились на терапию антипсихотиками второго поколения: рисперидон (средняя дозировка – 7,4 мг), оланзапин (средняя дозировка – 28,3 мг), палиперидон (средняя дозировка – 9,3 мг), арипипразол (средняя дозировка – 28, 6 мг).
Для оценки терапевтической эффективности исследовались клинические показатели с использованием их оценок по шкале PANSS. На момент включения больных в исследование суммарный балл по PANSS находился в пределах от 79 до 96 баллов, средний балл – 91,8, что свидетельствует о выраженности продуктивных расстройств. Через 4 недели от момента начала антипсихотической терапии суммарный балл по PANSS составлял в среднем 67,4 балла, что указывало на значительную редукцию психотической симптоматики во всех терапевтических группах. Через 8 недель от начала терапии атипичными антипсихотиками суммарный балл по PANSS составил при терапии рисперидоном 45,6 (редукция – 20,5 % от исходного уровня), палиперидоном – 44,8 (редукция – 28 % от исходного уровня), арипипразолом – 41,7 (редукция – 24 % от исходного уровня), оланзапином – 43,9.
Больные шизофренией без употребления ПАВ продемонстрировали сопоставимые показатели редукции рейтинга баллов по шкале PANSS во всех терапевтических группах к 8-й неделе терапии. При этом стоит отметить, что показатели тревоги, напряжения, бредовой дереализации, галлюцинаторного поведения пациентов с наличием в анамнезе употребления ПАВ на стартовом обследовании превышали таковые по сравнению с пациентами без употребления психостимуляторов. Для пациентов изучаемой группы было также более характерно возникновение побочных эффектов в виде различных проявлений ЭПС, особенно на инициальном этапе терапии, что служит косвенным подтверждением наличия у них органически неполноценной почвы вследствие употребления психостимуляторов.
Изучение когнитивных нарушений у больных проведено на 4-й неделе стационарного лечения в состоянии формирующейся лекарственной ремиссии. Для оценки когнитивного функционирования была применена батарея психологических методик: тест комплексной фигуры Рея–Остерица (предназначен для стандартизированной оценки зрительно-пространственной конструктивной способности, зрительно-моторной памяти), тест вербальной беглости (позволяет оценивать вербальную ассоциативную продуктивность, нарушения лексической системы, запас семантической памяти, способность к психической гибкости), тест вербального (слухоречевого) заучивания Рея (для изучения вербальной памяти, заучивания и процесса удержания информации, а также субъективной организации памяти), Висконсинский тест сортировки карточек (для оценки исполнительной функции, психической гибкости, уровня абстрактного мышления и способности формировать, поддерживать и координировать эффективную стратегию категориального мышления).
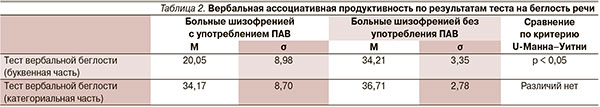
Получены достоверные различия между группами пациентов (p < 0,05) при выполнении буквенной части теста вербальной беглости (см. табл. 2). Больные шизофренией с коморбидной патологией по сравнению с больными без опыта употребления психоактивных веществ при выполнении данной части задания генерировали значительно меньшее количество слов (M = 20,05 ± 8,98), им было труднее переключаться, они чаще допускали ошибки. При выполнении второй части задания (категориальная часть) существенных различий выявлено не было.
При выполнении испытуемыми теста вербального (слухоречевого) заучивания (RAVLT) по объему и скорости заучивания различий выявлено не было (табл. 3). В то же время значимые различия (р < 0,05) определены при отсроченном воспроизведении и выполнении задания на распознавание. Таким образом, при примерно равных показателях кратковременной слухоречевой памяти, скорости и качества процессов заучивания выявлены различия по показателям долговременной памяти, а также воспроизведению стимульного материала в условиях интерференции.
В ходе выполнения теста сложной фигуры Рея–Остерица больные шизофренией со склонностью к злоупотреблению психоактивных веществ обнаружили ограничение объема отсроченного, долговременного запоминания (табл. 4). Для больных шизофренией без склонности к употреблению психоактивных веществ при воспроизведении по памяти фигуры были характерны следующие
ошибки: пропуск второстепенных деталей изображения, добавление лишних элементов, не присутствоваших в стимульном материале, дублирование деталей, искажение симметрии и целостности фигуры, что отражает выраженные нарушения перцептивной организации, исполнительских функций пациентов. Для больных шизофренией с «двойным диагнозом» характер ошибок был другим: искажение размеров фигуры, пропуск существенных деталей изображения, что больше указывает на нарушения конструктивных способностей.
При выполнении Висконсинского теста сортировки карточек существенных различий в уровне выявленных нарушений исполнительской функции между группами больных обнаружено не было.
Таким образом, для пациентов с употреблением ПАВ в отличие от больных без склонности к злоупотреблению психоактивными веществами были характерны более выраженные нарушения объема семантической памяти. Наряду с дефицитом исполнительской функции у больных с коморбидным употреблением ПАВ выявлены более значительные нарушения конструктивного праксиса, что характерно для обследуемых с наличием органического поражения головного мозга. Отмеченные в результате обследования ограничения объема слухоречевой и зрительной долговременной памяти у больных шизофренией со склонностью к злоупотреблению психоактивными веществами указывают на более выраженный дефект мнестических функций, что также сближает пациентов этой клинической группы с больными эндогенно-органическими и экзогенно-органическими поражениями головного мозга. Похожие результаты, касающиеся избирательности внимания, описаны в работе R. Salo и соавт., 2011. Пациенты с амфетаминовыми психозами демонстрировали большие нарушения избирательности внимания, согласно тесту Струпа на внимание, по сравнению с больными шизофренией.
При этом в целом можно сказать, что пациенты с сопутствующим употреблением ПАВ продемонстрировали схожий профиль нарушений когнитивного функционирования, присущий шизофреническому процессу с небольшими отличиями, касающимися показателей, характерных для пациентов с органическим поражением ЦНС.
Полученные данные еще раз свидетельствуют об общности нейробиологических механизмов шизофрении и последствий употребления психоактивных веществ амфетаминового ряда. Больные шизофренией с соответствующей коморбидной патологией, таким образом, страдают от более выраженного когнитивного дефицита.
Для них предпочтительна терапия антипсихотиками второго поколения, поскольку наличие экзогенно-органических факторов в виде употребления ПАВ приводит к худшей переносимости традиционных антипсихотиков и как следствие – к несоблюдению режима приема поддерживающей терапии. Необходимы дальнейшие лонгитудинальные исследования, в т. ч. и с применением методов нейровизуализации для уточнения параметров когнитивного функциониро-вания данной группы больных в динамике.