Введение
Несмотря на изменение границ самого понятия терапевтической резистентности (ТР) и появление новых антипсихотических препаратов, число больных, не реагирующих на медикаментозное лечение, остается постоянным. Диапазон проявлений ТР при шизофрении колеблется в пределах от 5–10 до 60 % случаев вне зависимости от характера антипсихотической терапии [1–4]. Современные алгоритмы фармакотерапии резистентных психозов, разрабатываемые на основании систематизированных анализов контролируемых исследований и консенсусных решений, предлагают две основные терапевтические стратегии: применение нейролептиков с ожидаемым противорезистентным действием (например, клозапин) и усиление эффекта антипсихотической терапии: использование комбинаций нейролептиков, назначение высоких дозировок, метод «зигзага», применение т. н. аугментации или наслаивания (комбинирование нейролептиков с препаратами других групп). Нелекарственные подходы к лечению включают «шоковые» методы: инсулинокоматозную и электросудорожную терапию (ЭСТ); методы, способные изменять реактивность организма и усиливать терапевтический ответ (гемосорбция, плазмаферез). Из широкого ряда биологических мер преодоления лекарственной устойчивости ЭСТ выделяется прежде всего за счет неоднократно доказанной способности кардинально изменять ход терапевтического процесса [5–8]. С начала 1990-х гг. в литературе наблюдается определенный интерес к новому варианту использования ЭСТ в сочетании с нейролептиками [9–12]. Предполагается, что при этом происходит взаимное потенцирование терапевтического эффекта, о чем косвенно свидетельствуют некоторые общие механизмы действия, выявляемые в нейрофизиологических исследованиях. В литературе имеются указания к сочетанному применению клозапина и ЭСТ, однако данные получены на малых группах больных, в отдельных клинических наблюдениях и носят противоречивый характер [13]. Чрезвычайно мало исследований сравнительной эффективности применения атипичных нейролептиков (АН) и традиционных нейролептиков (ТН) в комплексе с ЭСТ в преодолении ТР у больных шизофренией. Целью работы явилось изучение сочетанного применения ЭСТ с нейролептиками 1-го (ТН) и 2-го (АН) поколений в преодолении ТР у больных шизофренией. В процессе работы решались следующие задачи: 1) оценка эффективности ЭСТ; 2) комплексный анализ безопасности комбинации ЭСТ с АН и ТН у терапевтически резистентных больных шизофренией; 3) выявление факторов, влияющих на характер динамики психического состояния в ходе ЭСТ.
Материал и методы
 В исследование были включены больные параноидной шизофренией с признаками ТР к АН и ТН, получавшие курсы ЭСТ в отделении биологической терапии психически больных СПбНИПНИ им. В.М. Бехтерева. Критерием включения больных в исследование был диагноз параноидной шизофрении с приступообразным (эпизодическим) типом течения в соответствии с диагностическими критериями МКБ-10. Наличие ТР устанавливалось с использованием принятых параметров диагностики: незначительное снижение тяжести продуктивных психопатологических расстройств или полное отсутствие положительной динамики в состоянии больного после последовательного лечения двумя нейролептиками различных фармакологических групп в течение 6–8 недель в среднетерапевтических или максимально допустимых дозировках [14]. Минимальная сумма баллов по шкале PANSS (Шкала оценки позитивных и негативных синдромов) к началу исследования составляла не менее 60, что соответствовало наличию актуальной психотической симптоматики в рамках обострения или дебюта психоза.
В исследование были включены больные параноидной шизофренией с признаками ТР к АН и ТН, получавшие курсы ЭСТ в отделении биологической терапии психически больных СПбНИПНИ им. В.М. Бехтерева. Критерием включения больных в исследование был диагноз параноидной шизофрении с приступообразным (эпизодическим) типом течения в соответствии с диагностическими критериями МКБ-10. Наличие ТР устанавливалось с использованием принятых параметров диагностики: незначительное снижение тяжести продуктивных психопатологических расстройств или полное отсутствие положительной динамики в состоянии больного после последовательного лечения двумя нейролептиками различных фармакологических групп в течение 6–8 недель в среднетерапевтических или максимально допустимых дозировках [14]. Минимальная сумма баллов по шкале PANSS (Шкала оценки позитивных и негативных синдромов) к началу исследования составляла не менее 60, что соответствовало наличию актуальной психотической симптоматики в рамках обострения или дебюта психоза.
Из исследования были исключены пациенты с аддикциями, наличием эндокринных, хронических соматических и неврологических заболеваний, находившиеся в стадии декомпенсации в течение последних 6 месяцев.
Продолжительность актуального психотического состояния до начала исследования составила 6,48 ± 4,14 недели, число перенесенных приступов – 4,91 ± 1,5 при длительности приступа 3,8 ± 1,7 месяца. Длительность межприступных периодов достигала 9,8 ± 3,3 месяца. В клинической картине преобладал галлюцинаторно-параноидный синдром (89,6 % случаев).
 В 1-ю группу были включены больные, которым курс ЭСТ назначался на фоне приема АН (рисперидон – от 4,0 до 8,0 мг/сут [4,70 ± 1,41 мг/сут]; оланзапин – до 30 мг/сут [9,30 ± 5,87 мг/сут]; палиперидон – до 12,0 мг/сут [8,3 ± 4,41 мг/сут]). Во 2-ю группу были включены пациенты, которым курс ЭСТ назначался на фоне сохраненного приема ТН (галоперидол – 20,0–60,0 мг/сут [31,60 ± 3,57 мг/сут]) АН и ТН назначались в таблетированной форме. Обе группы были сопоставимыми по демографическим и клиническим показателям: 1-я группа – 22 пациента (16 мужчин и 6 женщин в возрасте 28,6 ± 2,6 года), 2-я группа – 24 пациента (19 мужчин и 5 женщин в возрасте 31,8 ± 5,2 года). Сохранение приема стабильной суточной дозы АН и ТН было обязательным условием на всем протяжении исследования.
В 1-ю группу были включены больные, которым курс ЭСТ назначался на фоне приема АН (рисперидон – от 4,0 до 8,0 мг/сут [4,70 ± 1,41 мг/сут]; оланзапин – до 30 мг/сут [9,30 ± 5,87 мг/сут]; палиперидон – до 12,0 мг/сут [8,3 ± 4,41 мг/сут]). Во 2-ю группу были включены пациенты, которым курс ЭСТ назначался на фоне сохраненного приема ТН (галоперидол – 20,0–60,0 мг/сут [31,60 ± 3,57 мг/сут]) АН и ТН назначались в таблетированной форме. Обе группы были сопоставимыми по демографическим и клиническим показателям: 1-я группа – 22 пациента (16 мужчин и 6 женщин в возрасте 28,6 ± 2,6 года), 2-я группа – 24 пациента (19 мужчин и 5 женщин в возрасте 31,8 ± 5,2 года). Сохранение приема стабильной суточной дозы АН и ТН было обязательным условием на всем протяжении исследования.
ЭСТ проведена по современной модифицированной методике, решение о назначении принимала клинико-экспертная комиссия [15–17].
Для премедикации использовано 0,5–0,1 % атропина сульфата с 1,0–1,0 %-ным раствором димедрола внутримышечно или внутривенно.
Анестезиологическое пособие проведено раствором пропофола в дозе 150–200 мг внутривенно струйно на фоне миорелаксации раствором дитилина в дозе 160–190 мг. Для проведения ЭСТ использован аппарат ЭСТЕР. В среднем частота импульсов составляла 27–77 Гц; длительность импульсов – 1,0–1,5 мс при амплитуде 550 мА. При подборе минимальной судорожной дозы использован принцип независимой настройки каждого параметра стимуляции. Состоявшимся считался припадок с длительностью моторных проявлений не менее 20 секунд.
В исследовании были использованы следующие методы: клинико-психопатологический, психометрический и медико-статистический. Для объективизации клинических данных применены следующие шкалы: PANSS; Шкала общего клинического впечатления – CGI-S; Шкала глобальной оценки динамики психического состояния CGI-I; Шкала оценки побочного действия – UKU. Обследование больных с использованием психометрических шкал проводилось еженедельно в дни, свободные от сеансов ЭСТ. Первое обследование осуществлено до начала курса ЭСТ, второе – на 7-й, третье – на 14-й и четвертое (заключительное) – на 21-й день наблюдения.
Математико-статистическая обработка данных проведена с использованием программы «Microsoft Excel 2010» и включала подсчет средних величин показателей эффективности и безопасности (М ± м) на различных этапах терапии; сравнение средних значений по критерию Стьюдента; корреляционный анализ по критерию Спирмена.
Результаты
Выраженность психопатологической симптоматики по шкале PANSS на момент включения в исследование в группе сочетанной терапии ЭСТ и АН составила 92,8 ± 11,6 балла, а в группе, получавшей ЭСТ с ТН, – 89,6 ± 16,7 балла (состояние пациентов квалифицировалось как средней тяжести или тяжелое). Нарастание выраженности антипсихотического эффекта в ходе комбинированной терапии (психотропной и ЭСТ) отчетливо прослеживается на основании данных, приведенных на рис. 1.
Редукция суммарного балла по шкале PANSS в группе АН после первой недели лечения составила 10,8 %, к концу исследования – 32,0 %. В группе ТН редукция достоверно не различалась, хотя и была несколько менее выраженной. При втором обследовании она составила 7,8 %, а на момент окончания терапии достигла 28,7 %.
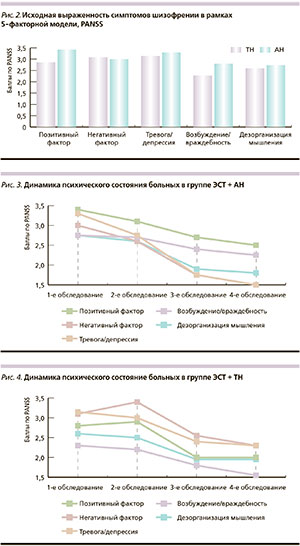
Регистрация динамики основных клинических параметров в терапевтических группах проведена с учетом пятифакторной структуры шкалы PANSS, включившей такие группы симптомов, как «позитивный фактор», «негативный фактор», «возбуждение–враждебность», «тревога–депрессия» и «дезорганизация мышления». Использование этой модели позволило провести дифференцированную оценку отдельных компонентов психотического состояния и их связь с побочными эффектами терапии. Исходно значимых различий в выраженности симптомов, отнесенных к тому или иному фактору, отмечено не было (рис. 2).
В течение первой недели, после 4 сеансов ЭСТ, наиболее отчетливая положительная динамика в группе АН прослеживалась в отношении негативной и аффективной симптоматики; явных изменений показателей позитивных расстройств и дезорганизации мышления выявлено не было, а возбуждение обнаружило тенденцию к нарастанию (рис. 3). Уже к четвертому сеансу (7-й день наблюдения) степень редукции негативной симптоматики составила более 20 %. Начиная со второй недели лечения наблюдалось стремительное нивелирование негативной, аффективной симптоматики и расстройств мышления при более плавной положительной динамике позитивных симптомов и возбуждения. На протяжении третьей недели терапии различия в темпе редукции различных кластеров симптоматики стали менее отчетливыми, но в большей степени сохранились в отношении аффективных и негативных симптомов.
При применении ЭСТ в сочетании с ТН в течение первой недели лечения заметной динамики психического состояния не наблюдалось, тенденция к нарастанию негативных расстройств была отмечена, вероятно, за счет явлений заторможенности. На протяжении дальнейшего периода исследования имело место достаточно равномерное и плавное нивелирование всех психопатологических составляющих.
При втором обследовании (на 7-й день через неделю после начала терапии) явных различий в изменении психического состояния в группах сравнения выявлено не было (рис. 3, 4). Статистически значимые различия в характере влияния АН и ТН на выраженность психотической симптоматики были установлены при третьем обследовании – через две недели после начала терапии (рис. 3, 4). Под влиянием терапии ТН + ЭСТ продуктивные симптомы редуцировались более отчетливо, чем при применении АН в сочетании с ЭСТ (p < 0,05). Для ТН была зарегистрирована большая активность в отношении симптоматического кластера «возбуждение–враждебность». Больные, получавшие АН, в свою очередь продемонстрировали более отчетливый терапевтический ответ в отношении показателей «тревога–депрессия» и «негативная симптоматика» (p < 0,05). В отношении кластера “дезорганизация мышления” эффективность сравниваемых вариантов лечения не различалась. Таким образом, уже в первые две недели комбинированной терапии были обнаружены существенные различия в характере влияния на отдельные компоненты психотического состояния.
На 21-й день лечения, после 9-го сеанса ЭСТ, была отмечена редукция психотической симптоматики по всем кластерам (рис. 3, 4). В группе ЭСТ + ТН наиболее отчетливая тенденция к редукции прослеживается в отношении симптоматических кластеров «позитивный фактор» и «возбуждение–враждебность», в то время как группа ЭСТ + АН показала большую терапевтическую активность в отношении показателей «тревога–депрессия», «негативная симптоматика» и «дезорганизация мышления». К 9-му сеансу ЭСТ была обнаружена достоверная разница в динамике продуктивной симптоматики в группах сравнения: ТН – 12,1 ± 2,3; АН – 15,6 ± 3,3 балла (p < 0,05).
Уточняющие данные об индивидуальных спектрах комбинированной психотропной терапии и ЭСТ были получены при расчете степени редукции выраженности психических расстройств по отдельным симптоматическим кластерам. В целом для ТН по сравнению с АН была выявлена значительно большая активность в отношении продуктивных симптомов (редукция среднего балла составила 40,2 против 32,4 %), возбуждения и агрессии (31,9 против 20,2 %). Терапия АН + ЭСТ обнаружила большую эффективность в отношении негативной симптоматики (редукция среднего балла составила 50,3 против 25,4 %), тревоги и депрессии (55,2 против 29,3 %).
Достоверных различий в степени редукции дезорганизации мышления между группами установлено не было (34,4 против 31,2 %).
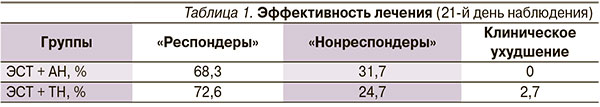
Было выделено 3 варианта ответа на проводимую терапию – положительный эффект, отсутствие эффекта, клиническое ухудшение. Критерием положительного терапевтического эффекта считалась редукция первоначального рейтинга по шкале PANSS более чем на 20 %. Пациенты, ответившие этим требованиям, составили группу «респондеров».
Группа «нонреспондеров» объединила случаи с редукцией первоначального рейтинга по шкале PANSS менее чем на 20 %. При условии роста суммарной оценки по шкале PANSS, зарегистрированной на момент включения больных в исследование, был использован показатель «клиническое ухудшение».
Данные табл. 1 указывают на высокую эффективность сочетанного применения ЭСТ и нейролептиков. Группы сравнения практически не различались по числу «респондеров». Число «нонреспондеров» было несколько больше при применении АН, однако признаки клинического ухудшения в результате терапии были выявлены только в группе с ТН.
Анализ скорости наступления терапевтического эффекта с использованием шкалы глобальной оценки динамики психического состояния позволил выделить два типа терапевтического эффекта. В первом случае значимые изменения, соответствовавшие градации «выраженное или существенное улучшение» по CGI-I, были зарегистрированы спустя 2 недели после начала терапии, что было расценено как «быстрый» терапевтический эффект (23,5 %). Остальные случаи положительной динамики отнесены к варианту «постепенно наступающее улучшение» (76,5 %).
Через две недели исследования число «респондеров» с быстрым терапевтическим ответом в группах сравнения было равным (20,3 и 21,0 % соответственно). Схожие данные получены и при рассмотрении темпов дальнейшей терапевтической динамики. Так, в группе ТН + ЭСТ к началу 3-й недели терапии «выраженное или существенное улучшение» было зарегистрировано в 78,8 % случаев, в группе АН + ЭСТ – в 73,2 %.
Психическое состояние больных к окончанию курса лечения (9 сеансов ЭСТ и психофармакологической терапии) характеризовалось следующими особенностями. Большинство (74,4 %) больных достигли полной редукции галлюцинаторных переживаний и явлений психического автоматизма, дезактуализацию персекуторных бредовых идей, что позволяет говорить о формировании терапевтической ремиссии. У 20,1 % больных имелась резидуальная психопатологическая симптоматика: фрагментарные проявления психических автоматизмов в виде ощущения периодической путаницы в мыслях, элементы стереотипного мышления, бредовые переживания. Необходимо отметить, что к окончанию исследования у всех пациентов значительно редуцировались нарушения мышления, характерные для острого параноидного приступа: дезорганизация, непоследовательность, резонерство, атактические соскальзывания и замыкание. В то же время среди значительного числа пациентов обнаружена негативная симптоматика в виде снижения энергетического потенциала, эмоциональная отгороженность, формальная критика к болезни и перенесенному психотическому состоянию.
Выявлено, что такие факторы, как длительность и возраст начала заболевания, достоверно влияют на характер динамики психического состояния в ходе комбинированной терапии (r = 0,35, p < 0,001 и r = 0,32, p = 0,044 соответственно). Так, например, в группе АН + ЭСТ редукция симптоматики была более выражена среди больных с ранним началом заболевания. В группе ТН + ЭСТ более выраженная редукция симптоматики наблюдалась у пациентов с большей длительностью заболевания.
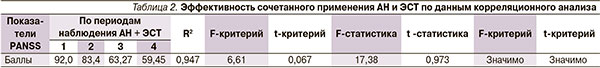
По результатам исследования были построены регрессионные модели парной корреляционной зависимости психического состояния пациентов от длительности лечения. По приведенным в табл. 2 и 3 данным прослеживается эффективность сочетанного применения ЭСТ и нейролептической терапии в процессе лечения.
Таким образом, полученные данные подтверждают способность ЭСТ изменять ход терапевтического процесса и свидетельствуют о целесообразности применения ЭСТ в сочетании с нейролептиками для преодоления ТР. Сравнительная оценка эффективности сочетанной терапии больных параноидной шизофренией с ТР позволила установить терапевтические «мишени»: предпочтительное применение ЭСТ + АН для редукции негативной и аффективной симптоматики, особенно в случае начала заболевания в раннем возрасте, и ЭСТ + ТН – для редукции продуктивной симптоматики, возбуждения–агрессии у больных со значительной длительностью заболевания.