Среди больных неврологической патологией депрессия (ДП) встречается значительно чаще, чем в общей популяции, и наиболее сложна для диагностики, т. к. в клинической картине преобладают стертые хронические формы, имеются особенности клинической феноменологии, симптомы ДП нередко перекрываются другими проявлениями органических неврологических заболеваний (двигательными, когнитивными, речевыми). Депрессией называют состояние, характеризующееся сниженным фоном настроения, подавленностью, пессимистическим взглядом на будущее, низкой самооценкой, чувством вины, мотивационной инертностью, снижением всех видов активности – психической и физической. Таким образом, при ДП страдают и эмоциональная, и интеллектуальная, и волевая, и телесная сферы.
Распространенность ДП среди больных с органической неврологической патологией весьма различается по данным разных исследователей. Так, депрессивные расстройства у больных, перенесших инсульт, выявляются от 5 до 68 %; при сосудистой деменции – от 0 до 71 %, составляя в среднем 30 %; при эпилепсии – от 9 до 55 %; при рассеянном склерозе – от 10 до 60 %; при болезни Паркинсона – от 25 до 50 %; при болезни Альцгеймера – от 30 до 50 % [1, 2, 12, 22, 27]. Депрессия может формироваться в связи с поражением мозга гипоксического, дизиммунного, метаболического, токсического характера, при изменении гормонального статуса, авитаминозах, заболеваниях желудочно-кишечного тракта, онкологических заболеваниях, ревматоидном полиартрите [6, 7, 22, 27 и др.].
Провоцировать возникновение ДП может ряд фармакологических средств [4, 6, 7]. В действительности всегда бывает очень трудно определить, возникла ли ДП в ответ на лекарственную терапию, или она является психологическим ответом на нарастающий неврологический дефицит или на развивающуюся резистентность к применяемым средствам.
Причинно-следственные отношения ДП и органического заболевания ЦНС могут быть различными:
- «психологическим ответом» на неврологический дефект;
- прямым следствием (симптомом) органического поражения ЦНС;
- может начаться вне связи с органическим заболеванием, задолго до его развития и ее симптомы лишь усугубляются при присоединении неврологической патологии;
- фактором риска развития нейродегенеративных и цереброваскулярных заболеваний.
Наиболее существенные факторы риска развития ДП следующие: возраст пациента старше 65 лет, низкая социальная поддержка, социальная изоляция, отсутствие значимых межличностных связей, развод, алкогольная или лекарственная зависимость, большое количество стрессовых событий – смерть или тяжелая болезнь близкого человека, уход с работы, наличие хронических соматических и неврологических заболеваний [9, 11].
Патогенез ДП весьма сложен и продолжает постоянно уточняться [1–4, 6, 19, 22, 28, 29, 35, 37, 39, 40]. Преимущественное значение имеют дефицит норадреналина, серотонина, в меньшей степени – дофамина в ЦНС.
Большинство норадренергических нейронов локализуется в области мозгового ствола в голубом пятне. Проекции в префронтальную кору модулируют настроение и внимание; в лимбическую область – психомоторную активность и утомляемость.
S.M. Stahl предложил гипотетическую схему дефицита норадреналина. Она включает нарушение внимания, оперативной памяти; замедление информационных процессов, депрессивное настроение, психомоторную заторможенность, повышенную утомляемость.
Большинство серотонинергических нейронов локализуется в стволе мозга, в ядрах шва. Серотонинергические проекции во фронтальную кору регулируют настроение; в базальные ганглии – контролируют двигательную активность; в лимбическую систему – ответственны за возникновение тревоги и паники, в гипоталамус – участвуют в контроле аппетита, в центры сна мозгового ствола – формируют медленноволновой сон. Гипотетическая схема дефицита серотонина по S.M. Stahl [39] проявляется депрессивным настроением, тревогой, паникой, фобиями, обсессивно-компульсивными расстройствами, булимией и нарушением сна. На основе представлений о функциях моноаминов была сформулирована «классическая» моноаминовая теория ДП, по которой главную роль в патогенезе играет снижение уровня моноаминов в ЦНС. Затем появились две ее модификации — «рецепторная» и «генная» моноаминовые гипотезы. «Рецепторная» теория акцентирует внимание на состоянии рецепторов постсинаптической мембраны. Так, доказано, что вследствие недостаточности моноаминов в синаптической щели происходит увеличение количества и сенсибилизация рецепторов постсинаптической мембраны. «Генная» теория ДП является развитием двух предыдущих и предполагает, что в патогенезе ДП значительную роль играют внутриклеточные изменения, начинающиеся в результате нарушенного взаимодействия моноаминов с рецепторами постсинаптической мембраны. Прежде всего они заключаются в изменении каскада внутриклеточных химических процессов и нарушении работы критически важных генов, от которых зависит нейрорегуляторная деятельность нейротрофических факторов и, соответственно, нормальное функционирование нейронов. Наиболее значительную роль играет снижение синтеза мозгового нейротрофического фактора, что способствует ускорению процессов апоптоза.
Для обсуждения патогенеза ДП в последнее время широко привлекают понятие нейрональной пластичности мозговых структур [14, 15, 17, 22, 23, 28, 36, 42]. Основанием этой гипотезы послужили многочисленные данные нейровизуализационных исследований, свидетельствующих о структурных повреждениях мозга при ДП. Это в основном уменьшение объема серого вещества в орбитофронтальной, медиальной префронтальной, височной и теменной зонах коры, вентральном стриатуме и гиппокампе; снижение метаболизма глюкозы в лимбических структурах и префронтальной коре. Наибольшие изменения при депрессии обнаруживаются в гиппокампе. Y.I. Sheline [37, 38], систематизировав многочисленные нейровизуализационные изменения, сопутствующие большой ДП, обнаружил наиболее специфичные морфологические изменения в одном или более образованиях, входящих в состав лимбикостриопаллидоталамического пути. Лимбикоталамокортикальная его часть сопряжена с такими образованиями, как миндалина, гиппокамп, медиодорзальные ядра таламуса, медиальная и вентролатеральная префронтальная кора. Предполагается наличие дисфункции в связях лимбических и корковых областей с хвостатым ядром, скорлупой и бледным шаром [22].
Нарушения нейрональной пластичности при ДП связывают в основном со стрессиндуцированной гиперреактивностью гипоталамо-гипофизарно-надпочечниковой системы с гиперактивностью кортикотропин-релизинг фактора, адренокортикотропного гормона и кортизола, что приводит к снижению синтеза мозгового нейротрофического фактора, изменению метаболизма фосфолипидов и субстанции-Р, к значительному изменению чувствительности глутаматных NMDA- и AMPA-рецепторов с усилением цитотоксического действия на нейроны глутамата; нарушению кальциевого гомеостаза, ингибиции транспорта глюкозы и повышению выработки свободных радикалов. Нарушается также и взаимодействие глутаматергических и моноаминергических систем. Предполагается, что при ДП в ряде структур головного мозга, более всего в гиппокампе, именно эти механизмы ответственны за атрофические изменения.
Для диагностики ДП необходимо использовать принятые диагностические критерии МКБ-10 (см. таблицу).
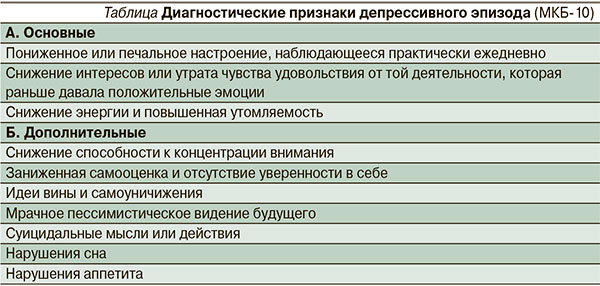
Важным диагностическим критерием является обязательное присутствие основных депрессивных проявлений практически ежедневно, большую часть дня и не менее двух недель подряд.
У пациентов с неврологической патологией наиболее часто наблюдаются легкая или умеренная степень депрессивных расстройств и субсиндромальные ДП.
При легком депрессивном эпизоде основные проявления ДП выражены слабо. Достаточно присутствия двух из трех основных симптомов и только двух дополнительных. В клинической картине может доминировать один моносимптом – повышенная утомляемость, снижение энергии, нарушения сна или аппетита. Депрессивные проявления могут быть замаскированы тревожными, болевыми, вегетативными жалобами. Обычно при легкой ДП наблюдается минимальное снижение социального функционирования.
При ДП средней тяжести должны присутствовать два основных и три или четыре дополнительных симптома; они выражены умеренно, при этом более отчетливо определяются затруднения в социальном и профессиональном функционировании.
Особого внимания заслуживает субсиндромальная ДП, наиболее распространенная среди неврологических больных старшего возраста. В популяции пожилых людей частота субсиндромальной ДП колеблется от 13 до 27 %, в то время как в домах престарелых достигает 50 % [21, 24, 27]. Необходимость выделения субсиндромальной ДП диктуется тем, что она, очевидно, снижает качество жизни пациента, а в 50 % случаев в течение двух лет переходит в клинически выраженную ДП. L.L. Judd [21] определяет субсиндромальную ДП как любые два или более одновременно существующих симптома ДП, длительно или постоянно присутствующих в течение хотя бы двух недель, приводящих к нарушению социального функционирования и не подпадающих под диагностические критерии МКБ-10 или DSM-IY [34]. В данном определении существенно, что для выделения субсиндромальной ДП не требуется обязательного присутствия основных депрессивных симптомов.
У неврологических больных наиболее часто наблюдаются «малые» и субсиндромальные, а по типу течения – хронические ДП (дистимии).
Следует отдельно выделить ДП с поздним началом, которая впервые появляется после 50–65 лет. Среди пожилых пациентов, госпитализированных по поводу ДП, для 50 % это был первый в их жизни депрессивный эпизод [8, 11, 31]. Выделение ДП с поздним началом имеет особое значение, т. к. ее происхождение все чаще связывают с имеющимся органическим поражением мозга цереброваскулярного или нейродегенеративного характера. Особенности клинической картины ДП с поздним началом и ее одновременное возникновение с сосудистыми поражениями мозга послужили причиной создания концепции сосудистой ДП. При сосудистых поражениях мозга ДП является наиболее частым психопатологическим симптомом и чаще всего сочетается с когнитивными расстройствами. Так, постинсультная ДП развивается у 20–50 % пациентов в первый год после развития инсульта [18, 33]. Выраженность постинсультной ДП зависит от многих причин – локализации и тяжести инсульта, возраста больного, стадии инсульта, степени неврологического и особенно когнитивного дефекта, преморбидных особенностей личности, изменения социальных и межличностных связей после инсульта. Так, постинсультная ДП чаще встречается при поражении левой лобной области и левых базальных ганглиев по сравнению как с другими областями левого полушария, так и с правым полушарием [22, 26]. Определяющая роль локализации инсульта в возникновении ДП наиболее очевидна только в первые месяцы после инсульта, затем в происхождении ДП неменьшую роль начинают играть преморбидные особенности личности, социальные и другие внешнесредовые факторы [18]. Частота возникновения ДП в зависимости от срока инсульта неоднозначна. С наибольшей частотой ДП встречается среди больных через 3–6 месяцев после инсульта. В первый год после инсульта ДП определяется у половины пациентов [18]. По данным В.И. Скворцовой, В.А. Концевого и соавт., среди постинсультных ДП преобладали ДП легкой степени тяжести, в 20 % – средней и только в 3 % были обнаружены тяжелые ДП [5]. По нозологической принадлежности постинсультные ДП делятся в основном на органические (сосудистые) и/или психогенные (реакция на инвалидизацию) [32].
Концепцию сосудистой ДП сформулировали в 1997 г. G.S. Alexopoulos и соавт. и K.R. Krishnan и соавт. [10, 25, 41]. Она базируется на основном положении, будто ишемические изменения в мозге могут вызывать ДП. Авторы предлагают следующие отличительные черты сосудистой ДП: поздний возраст начала (после 60 лет), одновременное начало ДП и доказанного (клинически и нейровизуализационно) цереброваскулярного заболевания. Для сосудистой ДП свойственны потеря интересов, возможности получать удовольствие и психомоторная заторможенность и не характерны такие типичные проявления, как чувство вины, тоски. Менее характерна ажитация. Одной из самых характерных черт сосудистой ДП является апатия. Для сосудистой ДП весьма характерны нарушения когнитивных функций в виде легких или умеренных когнитивных расстройств.
В исследованиях G.S. Alexopulos [8–11] у подавляющего большинства больных с поздним началом ДП, в частности при сосудистой ДП, отмечено не только снижение внимания и памяти, но и ослабление управляющих (исполнительных) функций. Обобщив многочисленные клинико-визуализационные исследования при ДП с поздним началом, G.S. Alexopulos и соавт. доказывают основополагающую роль в происхождении ДП снижения объема субкортикальных и лимбических структур, включая подколенную область передней цингулярной борозды, головки хвостатого ядра, скорлупы, гиппокампа и амигдалы. Самые значительные повреждения белого вещества при поздних ДП обнаруживаются в подкорковых структурах и их фронтальных проекциях, в основном в орбитофронтальной коре. Фронтостриарная дисфункция (кортикостриопаллидоталамо-кортикальные пути), по мнению автора, играет патогенетическую роль в происхождении ДП с поздним началом и объясняет снижение управляющих функций. Нарушения памяти при ДП с поздним началом, по данным M. Ballmaier и соавт., коррелируют с атрофическими изменениями в гиппокампальных структурах, чего не наблюдается при депрессиях с ранним началом [13].
При ДП с поздним началом преобладают «малые» и субсиндромальные ДП. Клиническая картина характеризуется более выраженными соматическими жалобами (варианты маскированной ДП) с ипохондрической фиксацией на соматических проявлениях, сочетанием с тревожными расстройствами, астенией, нарушениями когнитивных функций. Депрессивные состояния у пожилых людей имеют четкую тенденцию к рецидивирующему или хроническому течению. Пациенты пожилого возраста нередко отрицают такую характерную для ДП черту, как печаль и сниженное настроение [20]. На первый план выходят жалобы на необъяснимые соматические неприятные ощущения, чувство беспомощности, беспокойства, повышенную раздражительность. У неврологических больных для ДП может быть характерен негативизм с пренебрежением к рекомендациям по лечению и режиму.
При беседе и наблюдении за пациентом с ДП неврологу необходимо уделять особое внимание следующим проявлениям:
Изменение настроения – чувствует ли себя пациент депрессивным или несчастным; выглядит ли он депрессивным или часто плачет; есть ли у пациента суточные изменения настроения с наиболее плохим настроением в первую половину дня; получает ли пациент прежнее удовольствие от того, что его радовало раньше (напевает, радуется внукам и т. д.)?
Изменения речи – сохранила ли речь пациента прежнюю скорость и силу голоса; если для пациента было свойственно напевать со словами или без слов продолжает ли он это делать?
Изменение активности – снизилась ли активность пациента и/или создается впечатление, что он менее энергичен; не появилась ли у пациента, напротив, избыточная не свойственная ему активность (крутит руки или делает другие стереотипные движения); изменяется ли его активность в течение суток с явным ухудшением утром?
Изменения сна – изменился ли сон у пациента; появились ли регулярные нарушения ночного сна, например ранние утренние пробуждения?
Изменения аппетита – изменился ли аппетит и есть ли потеря веса?
При лечении ДП у неврологических больных препаратами первого выбора считаются представители класса селективных ингибиторов обратного захвата серотонина (СИОЗС): флуоксетин, флувоксамин, сертралин, пароксетин, циталопрам, эсциталопрам [4, 6]. Существенное преимущество этого типа препаратов не только в их высокой клинической эффективности в отношении депрессивных симптомов, но и в более широком клиническом эффекте: противотревожном, антипаническом, стимулирующием или активирующем (в зависимости от конкретного антидепрессанта – АДП), анальгетическом. При этом СИОЗС не имеют таких выраженных побочных эффектов, как, например, трициклические антидепрессанты (ТЦА), которые не относятся к препаратам первого выбора для неврологических больных в связи с выраженностью побочных эффектов и значительными лекарственными взаимодействиями [1, 4, 6]. Поэтому неврологам не следует назначать ТЦА больным с цереброваскулярными и нейродегенеративными заболеваниями, а также пациентам с соматической патологией (сердечно-сосудистыми заболеваниями, болезнями печени и почек, сахарным диабетом). Если невролог считает, что данному больному необходимо назначение ТЦА, ему необходимо обсудить тактику лечения с психиатрами.
При выборе АДП основным критерием для невролога являются хорошая переносимость препарата, его безопасность и минимум лекарственных взаимодействий.
В настоящее время одну из серьезных проблем составляет «недолеченность» ДП при лечении либо неправильно выбранном АДП, либо в течение недостаточного срока, либо недостаточной дозой.
В связи с этим неврологам необходимо соблюдать следующие правила назначения АДП:
При выборе АДП следует иметь в виду не только выраженность ДП, но и сопутствующие психопатологические симптомы: тревогу, панику, нарушения сна, астению и т. д. Например, наиболее выраженный антитревожный эффект наблюдается у пароксетина и эсциталопрама, а эффективность в отношении нарушений сна наиболее представлена у флувоксамина. Сравнительно независимое исследование 12 АДП показало: по переносимости, клинической эффективности преимущества у препаратов группы СИОЗС– эсциталопрама и сертралина [16].
Необходим индивидуальный подбор дозы АДП. Для лечения ДП у больных общемедицинской практики психиатры советуют не превышать следующие суточные дозы: флуоксетина 20 мг,
флувоксамина 50–100 мг; сертралина 50–100 мг; пароксетина 20 мг, циталопрама 20 мг; эсциталопрама 5–10 мг [6]. Причем неврологическим больным следует начинать лечение с половины дозы и увеличивать ее постепенно – не быстрее чем раз в две недели. Для оценки клинической эффективности АДП следует выждать не менее 3 недель, т. к. действие АДП отсрочено по времени, а весь спектр клинической эффективности появляется постепенно и последовательно.
Длительность лечения АДП в неврологической практике должна быть достаточной и при назначении лечебной дозы составлять не менее 8 недель, при поддерживающей терапии – обычно не менее полугода.
Если выбранный АДП группы СИОЗС, по мнению врача или пациента, недостаточно эффективен или плохо переносится (об этом можно судить по прошествии 3 недель), врач вправе поменять препарат на другой из той же группы. При повторной неэффективности или непереносимости необходима консультация психиатра для уточнения диагноза и отработки тактики лечения АДП другого класса.



