Современные рекомендации по диагностике и лечению сердечно-сосудистых заболеваний (ССЗ) большое значение придают выявлению и коррекции факторов риска (ФР) развития патологий сердечно-сосудистой системы. Эти ФР во многом универсальны, т. е. характерны для большинства ССЗ и хорошо известны.
В настоящее время ФР подразделяют на:
- «модифицируемые» – частота сердечных сокращений, ожирение, уровень холестерина, уровень артериального давления (АД), нарушение толерантности к углеводам (НТГ) или сахарный диабет 2 типа (СД2), курение;
- «немодифицируемые» – возраст, пол, расовая принадлежность, отягощенный семейный анамнез;
- «мягкие» – агрегационное состояние крови, низкий уровень липопротеидов низкой плотности (ЛПНП) и α-липопротеина, высокий уровень С-реактивного белка – СРБ, гомоцистеина, мочевой кислоты, тканевого активатора плазминогена-1, фактора некроза опухоли α (ФНО-α), интерлейкинов (ИЛ) 1–8 и т. д.
Каждый ФР имеет свой удельный вес в вероятности развития того или иного заболевания сердечно-сосудистой системы. При этом совместное воздействие нескольких ФР на одного пациента способствует существенному увеличению риска развития сердечно-сосудистых осложнений: c 5,5 % – у пациентов с 1 ФР до 21,8 % – с 8 и более ФР.
В 1991 г. V. Dzau и E. Braunwald сформулировали понятие «единый сердечно-сосудистый континуум», которое в течение последних 20 лет конца ХХ – начала ХХI вв. прочно вошло в научно-медицинскую практику. Применительно к практической медицине «континуум» (от английского «continuous» – постоянный, непрерывный) подразумевает непрерывную последовательность этапов развития заболевания – от ФР до летального исхода [1].
Метаболический синдром (МС) в контексте «сердечно-сосудистого континуума» – комплекс метаболических нарушений, ССЗ, патогенетически взаимосвязанных через инсулинорезистентность (ИР). Метаболические нарушения включают НТГ или СД2 с характерной атерогенной дислипидемией (повышение уровней триглицеридов – ТГ, ЛПНП, снижение уровня липопротеидов высокой плотности – ЛПВП), которые сопровождаются развитием артериальной гипертензии (АГ), ишемической болезни сердца (ИБС; рис. 1).
За последние 20 лет основные компоненты МС – нарушения углеводного и липидного спектров крови – рассматриваются клиницистами как доминирующие ФР ССЗ.
Зарубежные и отечественные исследователи в клинической медицине, эксперты Всемирной организации здравоохранения характеризуют МС, основной клинический признак которого – абдоминальное ожирение с ИР и атерогенной дислипидемией, как «пандемию ХХI в.». В 2012 г. Международная федерация диабета представила эпидемиологические данные распространенности СД как составную часть МС: в 47 странах Европейского региона (в т. ч. в России), в которых проводились исследования, зарегистрированы 52,8 млн пациентов в возрасте от 20 до 79 лет, страдавших СД, что составляет 8,1 % от населения. Согласно прогнозам, этот показатель к 2030 г. увеличится до 9,5 %, что составит 64 млн человек [1, 3, 8].
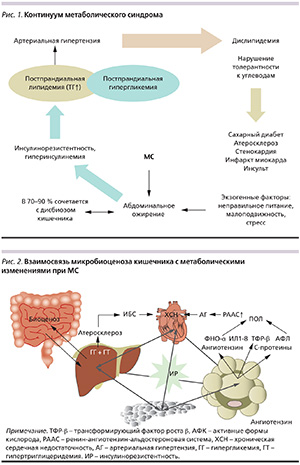 Клинические исследования последних 20 лет (конец ХХ – начало ХХI вв.), основанные на современных научных достижениях теоретической и практической медицины, продемонстрировали четкую взаимосвязь нарушений углеводного (предиабет – НТГ или СД) и липидного (атерогенез) спектров крови (компоненты МС) с функциональным состоянием печени (развитие неалкогольной жировой болезни печени – НЖБП) и статусом микробиоценоза кишечника (дисбиозом) [1–3, 5, 8, 13, 17].
Клинические исследования последних 20 лет (конец ХХ – начало ХХI вв.), основанные на современных научных достижениях теоретической и практической медицины, продемонстрировали четкую взаимосвязь нарушений углеводного (предиабет – НТГ или СД) и липидного (атерогенез) спектров крови (компоненты МС) с функциональным состоянием печени (развитие неалкогольной жировой болезни печени – НЖБП) и статусом микробиоценоза кишечника (дисбиозом) [1–3, 5, 8, 13, 17].
Нормальная микрофлора пищеварительного тракта (полость рта и кишечник) у человека имеет чрезвычайно большое общебиологическое значение: помимо осуществления трофики она ответственна за формирование до 80 % общего иммунного и регионального статусов. Наиболее важными и изученными функциями микрофлоры кишечника являются обеспечение антиинфекционной защиты, формирование и стимуляция иммунной системы макроорганизма, обеспечение всасывания минералов, воды, синтез витаминов группы В и К, регуляция липидного и углеводного обменов, регуляция моторики кишечника. Все это определяет микрофлору кишечника как самостоятельный орган. Выявлено, что абдоминальный тип ожирения с индексом массы тела (ИМТ) > 25 кг/м2 в 70–90 % случаев сочетается с дисбиозом кишечника и в такой же пропорции – со стеатозом или стеатогепатитом как следствие нарушения липидного обмена [2–5, 10, 18, 19].
В связи с этим возникают определенные трудности при назначении гиполипидемических препаратов, в частности статинов, которые, обладая известными гепатотоксическими побочными эффектами, могут усугублять функциональное состояние печени при наличии доклинических форм НЖБП на фоне дисбиоза – вплоть до развития лекарственного гепатита. В случаях нераспознанного стеатоза или стеатогепатита побочные эффекты лекарственных препаратов могут быть следствием нарушения их метаболизма в печени (патология ферментной цитохромной системы печени Р450).
Кишечный микробиоценоз – высокоорганизованная система, реагирующая и оказывающая влияние качественными и количественными сдвигами на гомеокинез человека в различных жизненных условиях «здоровье–болезнь», исходное формирование которого начинается с полости рта.
Дисбиоз – изменение состава кишечной флоры человека. В настоящее время установлено, что дисбиоз (патогенные изменения состава микрофлоры кишечника) играет важную роль в развитии метаболических нарушений при МС, рассматривается в качестве индуктора системных воспалительных реакций, стимулированных воспалительными цитокинами кишечника (ФНО-α, ИЛ-1–8, трансформирующим фактором роста β, СРБ и др.). Микрофлора кишечника является в определенном смысле фактором, определяющим чувствительность инсулинозависимых тканей организма (печени, мышц, жировой ткани) к инсулину, что обусловлено снижением концентрации липополисахаридов и гиперпродукцией кишечником провоспалительного цитокина ФНО-α. Присутствие отдельных патогенных бактерий (дисбиоз) в кишечнике, провоцируя системное воспаление с активацией свободнорадикальных перекисных реакций («оксидативный стресс»), способствуют формированию ИР (рис. 2).
Еще в 1935 г. клиницисты высказали предположение об участии микрофлоры кишечника в холестериновом обмене через метаболизм экзогенных и эндогенных стеринов, а в 2001 г. Корнейро Де Мура патогенетически обосновал участие микробиоценоза толстой кишки в качестве одного из звеньев нарушений холестеринового метаболизма: холестерин под действием микроорганизмов толстого кишечника последовательно метаболизируется в копрастанол/копрастанон и частично выводится с калом [6].
В свою очередь при реакции брожения в кишечнике копрастанол и копрастанон выделяют ацетат и пропионат, которые, диффундируя в кровь через процессы всасывания, достигнув печени, оказывают разнонаправленное действие на синтез холестерина (ацетат активирует, а пропионат угнетает синтез холестерина; рис. 3).
Альтернативный биологический механизм влияния микрофлоры кишечника на метаболизм холестерина в организме «хозяин–человек» обусловлен облигатным участием бактерий кишечника в метаболизме желчных кислот (ЖК), в частности холевой кислоты (ХК). Конъюгированная ХК (КХК) из печени поступает в тонкий кишечник и частично реабсорбируется в гепатоциркуляторную систему. Невсосавшаяся в дистальных отделах подвздошной кишки КХК в толстой кишке подвергается деконъюгации микробной холеглицингидролазой и дегидроксилированию при участии 7-α-дегидроксилазы. При нормальном биоценозе образовавшаяся дезоксихолевая кислота связывается с пищевыми волокнами и выводится из организма с калом. Эти процессы активизируются при повышении рН в кишечнике с образованием ионизированной дезоксихолевой кислоты, которая хорошо всасывается в толстой кишке. Всосавшаяся дезоксихолевая кислота пополняет пул ЖК в гепатоциркуляции, что является активирующим фактором для синтеза холестерина. Повышение рН в толстой кишке может быть следствием недостатка пробиотических компонентов в питании, к которым относятся разновидности углеводов (олиго-, ди-, полисахариды), с развитием дефицита нормальной микрофлоры кишечника, в частности бифидо- и лактобактерий. Таким образом, нарушение качественного состава микрофлоры (дефицит лакто- и бифидобактерий) сопровождается ростом рН, активацией ферментов с увеличением синтеза дезоксихолевой кислоты, ее растворимости (ионизация) и повышением всасывания, что приводит к росту уровней ЖК, ТГ и холестерина в крови.
Установлено, что бифидобактерии в присутствии солей ЖК секретируют деконъюгазы, которые расщепляют таурин- и глицинсодержащие амины ЖК в труднорастворимые осадки, связывающие толстокишечный холестерин с последующим выведением его с каловыми массами. Одновременно деконъюгазы уменьшают выход холестерина из печеночных клеток за счет ингибирования ГМГ-КоА-редуктазы, оказывают лимитирующее влияние на количество рецепторов для ЛПНП у форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов).
 Необходимо отметить, что аналогичными свойствами обладают лактобактерии и некоторые другие кишечные микроорганизмы. При этом трансформация холестерина в экскретируемые формы происходит при участии ЖК, выработка которых трансформируется при заболеваниях печени.
Необходимо отметить, что аналогичными свойствами обладают лактобактерии и некоторые другие кишечные микроорганизмы. При этом трансформация холестерина в экскретируемые формы происходит при участии ЖК, выработка которых трансформируется при заболеваниях печени.
В патогенезе атерогенной дислипидемии долевое участие принимают продукты метаболизма кишечной микрофлоры, в частности короткоцепочечные жирные кислоты (КЖК), которые являются основным продуктом микробной ферментации углеводов, жиров и белков. КЖК – монокарбоновые кислоты с 8 атомами углерода в цепи. К ним относятся уксусная, пропионовая, масляная, изомасляная, валериановая, изовалериановая, капроновая, изокапроновая кислоты. Неразветвленные летучие ЖК – уксусная, пропионовая и масляная образуются при анаэробном брожении углеводов, они тормозят развитие условно-патогенных штаммов, которые в большинстве своем обладают протеолитическим типом метаболизма, что способствует угнетению гнилостных процессов и подавлению образования аммиака, ароматических аминов, сульфидов, эндогенных канцерогенов. Разветвленные КЖК – изомасляная, изовалериановая образуются при метаболизме белков из валина и лейцина соответственно.
Помимо поддержания локальной резистентной колонизации сапрофитной микрофлоры за счет регуляции рН внутрикишечного содержимого КЖК через снижение рН одновременно контролируют моторику кишечника, опосредованно осуществляя дезинтоксикационную функцию.
В формировании атерогенной дислипидемии принимают также участие эндотоксины, провоспалительные цитокины (ФНО-α, ИЛ-1–8, СРБ), оксид азота, вырабатываемые условно- или патогенной микрофлорой кишечника через формирование системного воспаления, лежащего в основе оксидативного стресса, приводящего к процессам перекисного окисления липидов и атерогенеза [3, 5].
В свою очередь атерогенная дислипидемия, провоспалительные цитокины, вырабатываемые микроорганизмами кишечника, способствуют формированию стеатоза, стеатогепатита и развитию НЖБП, что ограничивает применение статинов, гепатотоксический эффект которых известен и клинически проявляется повышением уровней трансаминаз.
Таким образом, при МС (в ряде случаев) атерогенная дислипидемия может являться следствием системного воспаления, истощения антиоксидантной системы и нарушениями холестеринового метаболизма, вызванных нарушениями качественного состава биоценоза кишечника и полости рта. МС на ранних этапах его развития следует рассматривать как следствие общебиологической реакции на хроническое системное воспаление, индуцированное и поддерживаемое дисбиотическими нарушениями пищеварительного тракта.
В настоящее время клинической практикой подтверждена патогенетическая взаимосвязь состояния биоценоза пищеварительного тракта не только с заболеваниями желудочно-кишечного тракта (ЖКТ), но и с атеросклерозом, НТГ, СД2, АГ, ИБС (компоненты МС), бронхиальной астмой, экземой, пиелонефритом и мочекаменной болезнью, гепатитом и желчнокаменной болезнью, что определяет статус полиморбидности [1–3, 5, 11, 16, 19].
По данным эпидемиологических исследований, распространенность воспалительных заболеваний полости рта, в частности пародонта, у взрослого населения РФ составляет 81–100 % [4, 7, 9]. В свою очередь патология пародонта редко бывает изолированной и не связанной с другими сопутствующими заболеваниями, что определяет понятие полиморбидности.
В настоящее время на одного пациента моложе 20 лет, страдающего хроническим пародонтозом, приходится 2,8, в возрасте 21–40 лет – 2,9, в возрасте 41–60 лет – 4,5 одновременно протекающих заболеваний [7, 9]. В основе полиморбидности нередко лежит общность повреждающих ФР и патофизиологических механизмов развития патологии.
Как показывает современный клинический опыт, наличие сопутствующих хронических заболеваний различных отделов пищеварительного тракта (гингивит, пародонтоз, дисбиоз ЖКТ) взаимно способствует появлению и их хронизации, устойчивости к лечению. Накоплено достаточно сведений об этиологических ФР и патогенезе воспалительных заболеваний пищеварительного тракта, основными из которых являются нарушения микробного статуса (микробиоза), начиная с полости рта и заканчивая нижними отделами кишечного тракта, что сопровождается интенсификацией системного и регионарного перекисного воспаления («оксидативный стресс»), истощением антиоксидантной системы, нарушением общего и местного иммунитета.
В ранних публикациях указывается на наличие микроорганизмов в полости рта при хронических воспалительных заболеваниях, не свойственных этому биотопу. В настоящее время ряд авторов доказали, что дисбиоз полости рта, верхних дыхательных путей и пищевода являются следствием дисбиоза кишечника через различные механизмы транслокации патогенной флоры [9–11, 15, 18]. Однако в представленных публикациях не определены четкие механизмы взаимосвязи биоценозов различных отделов пищеварительного тракта между собой.
Сочетание различных ФР развития хронических воспалительных заболеваний и изменения микрофлоры полости рта могут являться запускающими и прогностически неблагоприятными факторами для качества жизни пациента. Неблагоприятные взаимовлияния биоценозов различных отделов ЖКТ редко учитываются в клинической практике, что может являться причиной низкой эффективности при проведении профилактических и лечебных мероприятий по устранению рецидивов и прогрессирования различных патологий.
Целью исследования явилась оценка влияния эндобиоза пищеварительного тракта на липидно-углеводный обмен.
Материал и методы
Было проведено обследование и по показаниям лечение 69 пациентов в возрасте от 35 до 55 лет: 15 пациентов с ИМТ < 25 кг/м2 (группа сравнения), 54 – с ИМТ ≥ 25 кг/м2 (исследуемая группа пациентов с клиническими и лабораторными признаками МС). Всем больным до и после лечения (24 недели) проведено лабораторное исследование липидного и углеводного обменов с расчетом показателей ИР (HOMA – Homeostasis Model Assessment IR) и индекса атерогенности (ИА), уровня системного воспаления (СРБ) и активности процессов перекисного окисления липидов (ПОЛ) по уровню концентрации продуктов их деградации – малонового деальдегита (МДА).
В стандартную программу лечения (β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, фенофибраты) пациентов с ИМТ ≥ 25 кг/м2 были добавлены симбиотики и антиоксиданты Всем больным обследовали полость рта с целью выявления воспаления пародонта с обучением правилам гигиенического ухода за полостью рта, проведением стандартной профессиональной гигиены с устранением местных факторов, способствующих скоплению и активации микробной флоры полости рта. Для объективной оценки клинического состояния пародонта определили гигиенические индексы: индекс Green–Vermillion (1964), индекс Silness Loe (1962); индексы кровоточивости: индекс кровоточивости Muhlemann в модификации Cowell (1975); также регистрировали степень подвижности по Miller в модификации Flezar и глубину пародонтальных карманов [4]. Микробный статус полости рта осуществлен с помощью полимеразной цепной реакции (ПЦР) в реальном времени [4, 12].
Результаты исследования и обсуждение
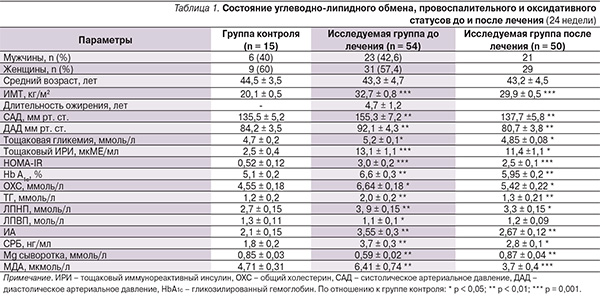
В табл. 1, 2 представлены исходно суммарные результаты обследования пациентов в группах контроля и исследования (до и после 24 недель лечения). В процессе наблюдения 4 пациента группы исследования были исключены в связи с несоблюдением регламента обследования и лечения.
Как видно из табл. 1, при практической идентичности демографических показателей (возраст и пол) статистически достоверная разница ИМТ (р < 0,001) сопровождалась статистически достоверной разницей в показателях углеводно/липидного обмена и уровней АД. Высокий уровень АД в группе пациентов МС с бóльшей степенью вероятности обусловлен активацией симпатоадреналовой системы, компенсаторной гиперинсулинемией и как следствие – ИР и относительным снижением концентрации Mg сыворотки крови. В исследуемой группе относительно низкий уровень тощаковой гликемии (5,2 ± 0,1 ммоль/л) на фоне ИР (HOMA-IR в группе исследования превышал аналогичный показатель в группе сравнения без признаков МС в 5,8 раза, p < 0,001) поддерживался компенсаторной гиперинсулинемией: уровень тощакового иммунореактивного инсулина (ИРИ) в группе исследования превышал аналогичный показатель в группе сравнения в 5,2 раза (p < 0,001). Интегральный показатель липидного спектра крови – ИА – в группе пациентов с признаками МС превышал аналогичный показатель в группе сравнения (ИА = 2,1 ± 0,15) в 1,7 раза (p < 0,01), что свидетельствует о нарушениях холестеринового обмена в сторону атерогенности плазмы крови. В группе исследования отмечена активация оксидативных процессов – уровень МДА статистически достоверно превышал аналогичный показатель в группе сравнения в 1,4 раза (р < 0,05) с одновременно повышенным системным воспалением – уровень СРБ в исследуемой группе превышал аналогичный показатель в группе пациентов без МС в 1,5 раза.
Более выраженные провоспалительные и оксидативные процессы в группе больных МС в 100 % случаев сопровождались наличием хронического генерализованного пародонтита (ХГП) различной степени тяжести, в контрольной группе аналогичная патология регистрировалась в 73,3 % наблюдений – по количественному составу с более легкой степенью тяжести (табл. 2).
В контрольной группе бактериальная масса в полости рта (по данным ПЦР в реальном времени) в зависимости от тяжести пародонтита колебалась от 103 до 105, у больных МС – от 104 до 108, что указывает на более выраженное изменение биоценоза полости рта.

После проведенного лечения с добавлением симбиотиков и антиоксидантов (24 недели – контрольная точка) у пациентов с МС на фоне статистически достоверного снижения ИМТ от 32,7 ± 0,8 до 29,9 ± 0,6 кг/м2 отмечены статистически достоверные изменения со стороны показателей системного воспаления и оксидативного стресса. Концентрация СРБ снизилась с 3,7 ± 0,3 до 2,8 ± 0,1 нг/мл, МДА уменьшилась с 6,41 ± 0,74 до 3,7 ± 0,4 мкмоль/л (p < 0,01).
Статистически достоверная положительная динамика со стороны системного воспаления (снижение концентрации СРБ на 18,7 %), активности оксидативного статуса (уменьшение МДА на 42,3%) сопровождалась статистически достоверной положительной динамикой показателей углеводно-липидного обмена (HOMA-IR, HbA1c, %, ИА). В группе пациентов с МС HOMA-IR (показатель ИР) снизился от 3,0 ± 0,2 до 2,5 ± 0,1 с одновременным уменьшением концентрации тощакового ИРИ с 13,1 ± 1,1 до 11,4 ± 0,9 мкМЕ/мл (р < 0,01), что свидетельствует о восстановлении чувствительности инсулиновых рецепторов. Стабилизация гликемического профиля у больных МС на фоне проведенного лечения с включением симбиотиков и антиоксидантов документируется статистически достоверным снижением HbA1c % на 9,8 % (p < 0,05).
На фоне гиполипидемической терапии (фенофибрата) добавление симбиотиков и антиоксидантов способствовало более выраженной антиатерогенной нормализации липидного спектра крови: уровни общего холестерина, ТГ, ЛПНП, снизились соответственно на 18,4 %, 35, 13,2 % с одновременным ростом концентрации ЛПВП на 9,1 % (разница статистически достоверна, p < 0,05–0,01). Подобная положительная динамика со стороны липидного спектра крови суммарно способствовала уменьшению ИА – интегрального показателя атерогенности плазмы крови на 24,8 % (р < 0,05).
В целом по группе больных МС снижение ИМТ на 8,6 %, HOMA-IR (показатель ИР) – на 18 %, компенсаторной гиперинсулинемии (тощаковый ИРИ) – на 13 % суммарно через уменьшение активности симпатической нервной системы способствовало восстановлению АД до целевого уровня: до лечения САД/ДАД = 155,3 ± 7,2/92,1 ± 4,3, после лечения – 137 ± 6,8/80,7 ± 3,2 мм рт. ст. (разница статистически достоверна, р < 0,001).
В конце лечения при контрольном исследовании микрофлоры полости рта у пациентов с МС отмечено практически в 1,5 раза статистически достоверное уменьшение диапазона микробной массы: от 104–108 до 103–105, что клинически документировалось уменьшением тяжести пародонтита в целом по группе (табл. 2).
По данным различных авторов, состояние микробиоценоза пищеварительного тракта на различных его уровнях (полость рта, кишечник) оказывают реверсивное взаимовлияние. Высокая степень положительной корреляции, выявляемая между патогенной и условно-патогенной микрофлорой полости рта и кишечника, свидетельствует о том, что эти представители микрофлоры могут перемещаться из верхних отделов (полости рта) и, наоборот (рефлюксогенно), из кишечника в пищевод и в полость рта. Подобные транслокации микроорганизмов оказывают взаимовлияние на локальный биоценоз, системное и региональное воспаление, на локальный и общий иммунитет [2, 4, 9, 11, 15, 18].
Выводы
Таким образом, у пациентов с абдоминальным типом ожирения (ИМТ ≥ 25 кг/м2 – МС) в подавляющем большинстве (от 80 до 90 % ) случаев имеет место нарушение микробиоза кишечника – дисбиоз, которое сопровождается развитием системного воспаления, активацией свободнорадикальных процессов (оксидативный стресс), снижением регионального и общего иммунитета. Суммарно: дисбиоз кишечника, активация провоспалительных цитокинов, перекисного окисления липидов как факторы риска на начальном этапе сердечно-сосудистого континуума способствуют формированию ИР и нарушению углеводно-липидного обмена с развитием НТГ или СД2, атерогенной дислипидемии.
Контаминация патогенной или условно-патогенной микрофлоры кишечника облигатно ведет к изменению аутохтонной микрофлоры ротовой полости с поражением пародонта различной степени тяжести, что реверсивно способствует прогрессированию патологии пищеварительного тракта: хроническому генерализованному пародонтиту, эзофагиту, гастродуодениту, энтероколиту, стеатозу, стеатогепатиту, НЖБП.
Включение в комплексную программу лечения на ранних этапах развития МС симбиотиков (корректоров микрофлоры ЖКТ), антиоксидантов способствует восстановлению микрофлоры пищеварительного тракта, общего и регионального иммунного статуса, улучшению репаративных процессов пародонта, купированию оксидативных процессов, восстановлению чувствительности инсулиновых рецепторов, нормализации липидно-углеводного спектра крови, что документируется данными нашего исследования и научного обзора.



