Уровень артериального давления (АД) является важнейшим, но далеко не единственным фактором, определяющим тяжесть артериальной гипертонии (АГ), ее прогноз и тактику лечения [1]. Большое значение имеет оценка общего сердечно-сосудистого риска, степень которого зависит от величины АД, а также наличия или отсутствия сопутствующих факторов риска, поражения органов-мишеней и ассоциированных клинических состояний. Обследование больного с целью выявления поражения органов-мишеней чрезвычайно важно, т. к. оно позволяет не только определять риск развития сердечно-сосудистых осложнений, но и следить за состоянием больных в динамике, оценивать эффективность и безопасность антигипертензивной терапии. Для выявления поражения органов-мишеней используют дополнительные методы исследования сердца, магистральных артерий, почек, головного мозга. Выполнение этих исследований показано в тех случаях, когда они могут влиять на оценку уровня риска и тактику ведения пациента [1].
Одним из органов-мишеней АГ является головной мозг. Проведение магнитно-резонансной томографии способствует уточнению наличия, характера и локализации патологических изменений, выявлять зоны лейкоареоза и «немые» лакуны [1]. Эти методы относятся к дорогостоящим и не доступны повсеместно, но их высокая информативность служит основанием для широкого использования в клинической практике. Пожилым пациентам с АГ часто необходимо проведение специальных тестов с использованием опросников для раннего выявления нарушения когнитивных функций как маркера субклинического поражения головного мозга в качестве органа-мишени АГ [1].
К основным пяти когнитивным функциям относят гнозис (восприятие информации), праксис (произвольное, целенаправленное двигательное действие), речь, память и интеллект [2]. Пациент с тяжелыми нарушениями гнозиса (агнозия) видит предмет, может его описать, но не узнает его. Память – способность запечатлевать, сохранять и многократно воспроизводить полученную информацию.
Интеллект – способность к анализу информации, выявлению сходств и различий, общего и частного, главного и второстепенного, способность к абстрагированию, решению задач, построению логических умозаключений. Подчеркнем, что субъективные жалобы больных на память не соответствуют истинным ее нарушениям, выявляемым с помощью специальных методов исследования.
Речь – способность выражать свои мысли вербальным способом (словами). Праксис – способность усваивать и удерживать разнообразные двигательные навыки, в основе которых лежат автоматические серии движений. Больные с тяжелыми нарушениями праксиса (апраксия) не могут выполнять то или иное действие вследствие утраты навыка («разучился» – например, больные разучиваются ходить), несмотря на отсутствие пареза [2].
Существуют убедительные доказательства того, что АГ, которая приводит к появлению лакунарных инфарктов и лейкоареоза в головном мозге, является фактором риска когнитивных нарушений и сосудистой деменции [3]. В связи с этим клинически значимым остается вопрос: можно ли рассматривать АГ в качестве модифицируемого фактора риска деменции и когнитивных нарушений? Результаты некоторых крупных плацебо-контролируемых исследований [4, 5] свидетельствуют о том, что антигипертензивная терапия положительно влияет на когнитивные функции, однако другие исследования не смогли подтвердить эти данные [6–9]. Выявленные расхождения в полученных результатах могут частично объясняться тем, что в разных исследованиях использовались различные классы антигипертензивных препаратов. Кроме того, большинство этих крупных исследований не были специально спланированы для изучения влияния антигипертензивной терапии на когнитивные функции, а использованные в них методики нейропсихологической оценки были недостаточно чувствительны, чтобы обнаружить изменения разных аспектов познания. Возможно, антигипертензивная терапия может улучшать только определенные когнитивные функции [10]. Несмотря на важность данной проблемы, влияние антигипертензивных препаратов на когнитивные функции изучено мало.
 В 2013 г. опубликован мета-анализ, посвященный оценке влияния антигипертензивных препаратов на когнитивные функции [11]. Всего в этот анализ включено 19 рандомизированных двойных слепых (кроме одного single-blined) исследований, в которых в общей сложности приняли участие 18 515 больных АГ, средний возраст которых составил 64 ± 13 лет. Период наблюдения в этих исследованиях колебался от 1 до 54 месяцев (медиана – 6 месяцев). Все режимы лечения были строго монотерапией. Согласно результатам данного мета-анализа, антигипертензивная терапия (без подразделения на классы антигипертензивных медикаментов) достоверно улучшала когнитивные функции по сравнению с исходными результатами [11]. Представляет интерес тот факт, что при анализе влияния антигипертензивной терапии на когнитивные функции в зависимости от ее длительности (длительности периода наблюдения) достоверное улучшение выявлено только для коротких (6 и менее месяцев) периодов наблюдения [11]. Улучшились все оцениваемые в этих 19 исследованиях когнитивные функции (исполнительные функции, кратковременная память, эпизодическая память, скорость когнитивных процессов, внимание), кроме речи [11]. В этом мета-анализе был выявлен еще один крайне интересный и очень важный в практическом плане факт: в мета-регрессионной модели взаимосвязи между антигипертензивным эффектом препарата и степенью улучшения когнитивных функций не обнаружено [11]. Это означает, что антигипертензивные препараты имеют иные дополнительные механизмы, которые позволяют им улучшать ряд когнитивных функций.
В 2013 г. опубликован мета-анализ, посвященный оценке влияния антигипертензивных препаратов на когнитивные функции [11]. Всего в этот анализ включено 19 рандомизированных двойных слепых (кроме одного single-blined) исследований, в которых в общей сложности приняли участие 18 515 больных АГ, средний возраст которых составил 64 ± 13 лет. Период наблюдения в этих исследованиях колебался от 1 до 54 месяцев (медиана – 6 месяцев). Все режимы лечения были строго монотерапией. Согласно результатам данного мета-анализа, антигипертензивная терапия (без подразделения на классы антигипертензивных медикаментов) достоверно улучшала когнитивные функции по сравнению с исходными результатами [11]. Представляет интерес тот факт, что при анализе влияния антигипертензивной терапии на когнитивные функции в зависимости от ее длительности (длительности периода наблюдения) достоверное улучшение выявлено только для коротких (6 и менее месяцев) периодов наблюдения [11]. Улучшились все оцениваемые в этих 19 исследованиях когнитивные функции (исполнительные функции, кратковременная память, эпизодическая память, скорость когнитивных процессов, внимание), кроме речи [11]. В этом мета-анализе был выявлен еще один крайне интересный и очень важный в практическом плане факт: в мета-регрессионной модели взаимосвязи между антигипертензивным эффектом препарата и степенью улучшения когнитивных функций не обнаружено [11]. Это означает, что антигипертензивные препараты имеют иные дополнительные механизмы, которые позволяют им улучшать ряд когнитивных функций.
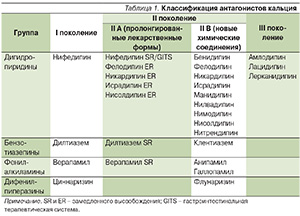
В цитируемом мета-анализе оценивали и влияние различных классов антигипертензивных препаратов на когнитивные функции. В частности, было отмечено, что антагонисты кальция (АК) достоверных изменений по сравнению с плацебо на когнитивные функции не оказывают [11]. Однако следует вспомнить, что АК – крайне разнородный класс препаратов. По своей химической структуре класс подразделяется на следующие группы (табл. 1) [12]:
- фенилалкиламины, или группа верапамила;
- бензотиазепины, или группа дилтиазема;
- дигидропиридины, или группа нифедипина, и др.
В свою очередь каждая из этих групп представлена препаратами трех поколений – I, II и III (табл. 1) [12].
В основу вышеизложенной классификации АК положена химическая структура, однако от нее очень сильно зависят клинические эффекты АК. Дигидропиридины оказывают большее влияние на гладкую мускулатуру сосудов и практически не влияют на миокард и проводящую систему сердца; фенилалкиламины, напротив, оказывают большее влияние на миокард, функции синусового и атриовентрикулярного узлов, чем на гладкую мускулатуру сосудов. Бензотиазепины занимают промежуточное положение между дигидропиридинами и фенилалкиламинами [12].
АК I поколения имеют серьезные побочные эффекты, которые делают их неприемлемыми для применения с позиций современных требований к медикаментам. Прежде всего они вызывают тахикардию (из-за рефлекторной активации симпатического отдела вегетативной нервной системы) [12]. Это привело к парадоксальной ситуации, когда на фоне их применения увеличилась масса миокарда левого желудочка и даже увеличился риск развития инфаркта миокарда, особенно для больных с сочетанием гипертонической и ишемической болезней сердца. Кроме того, эти препараты слишком резко и сильно снижают АД, что приводит к увеличению эпизодов ишемии головного мозга [12].
АК II поколения разделяют на две подгруппы — IIа и IIb. К первой подгруппе принадлежат особые пролонгированные формы лекарственных средств, ко второй — препараты с новой химической структурой. АК II поколения отличаются от препаратов I поколения большей продолжительностью действия. В связи с этим АК II поколения лишены многих побочных эффектов препаратов I поколения, прежде всего связанных с рефлекторной активацией симпатоадреналовой системы (особенно для производных дигидропиридинов); кроме того, препараты II поколения применяются 1–2 раза в сутки [12].
Однако эталонными (лучшими) АК принято считать представителей III поколения, прежде всего препарат амлодипин, который отличается такими важными особенностями, как более предсказуемая эффективность и сверхдлительное действие препарата – на протяжении более 24 часов [12].
 Амлодипину присущи уникальные особенности, позволяющие оказывать уникальные эффекты при АГ и ишемической болезни сердца [12]. Амлодипин можно безопасно сочетать с самыми различными препаратами. Нарастание концентрации амлодипина в крови происходит медленно, это позволяет препарату действовать мягко и в то же время надежно — через 6–12 часов после приема, что минимизирует риск возникновения побочных эффектов [12].
Амлодипину присущи уникальные особенности, позволяющие оказывать уникальные эффекты при АГ и ишемической болезни сердца [12]. Амлодипин можно безопасно сочетать с самыми различными препаратами. Нарастание концентрации амлодипина в крови происходит медленно, это позволяет препарату действовать мягко и в то же время надежно — через 6–12 часов после приема, что минимизирует риск возникновения побочных эффектов [12].
Срок действия препарата составляет более суток (около 30 часов), что позволяет, в частности, надежно контролировать подъемы АД в ранние утренние часы (с 6.00 до 10.00) [12]. Другим важным показателем действия медикаментов является время до достижения максимальной концентрации в плазме крови. Именно этот показатель определяет возможность возникновения побочных эффектов. Амлодипин начинает действовать постепенно.
Амлодипин отличается от верапамила и дилтиазема большим влиянием на гладкую мускулатуру сосудов (вазоселективность) и отсутствием клинически значимого действия на функцию синусового узла и атриовентрикулярное проведение. При лечении амлодипином не меняется ЧСС, кроме того, он оказывает положительное влияние на коронарный кровоток [12]. В отличие от нифедипина короткого действия амлодипин уменьшает гипертрофию миокарда левого желудочка, т. е. обладает кардиопротективным эффектом [12]. Имеются данные о способности амлодипина тормозить прогрессирование атеросклероза. Механизмы антиатеросклеротического эффекта сложны и многообразны: замедление пролиферации гладкомышечных клеток, ингибирование гиперплазии интимы сосудов, уменьшение способности макрофагов к захвату эфиров холестерина, антиоксидантное действие, благоприятный эффект на липидный профиль и др. [12].
Амлодипин в отличие от АК – производных дигидропиридина предыдущих поколений, не оказывает негативного влияния на углеводный обмен у больных СД (известно, что дигидропиридины первых поколений могут вызывать гипергликемию) [12]. У амлодипина обнаружено положительное влияние на липидный обмен. Отмечено, что применение амлодипина в течение 9 месяцев привело к снижению общего холестерина, холестерина липопротеинов низкой плотности, коэффициента атерогенности; увеличению липопротеинов высокой плотности [12]. Именно поэтому амлодипин считается препаратом первого ряда в лечении АГ.
Исходя из вышеизложенного, целью настоящего исследования было изучение влияния дигидропиридинового АК III поколения амлодипина (Нормодипин, компания «Гедеон Рихтер») на состояние когнитивных функций пожилых больных АГ.
В исследование были включены 25 больных в возрасте 60 лет и старше, средний возраст – 66,5 ± 5,6 года, из них 5 мужчин (20 %) и 20 женщин (80 %) с гипертонической болезнью II стадии 1–2-й степеней, не получавших антигипертензивной терапии не менее 2 недель до включения в исследование. Средняя длительность заболевания составила 17,3 ± 5,6 года. Начало заболевания в возрасте до 40 лет зафиксировано у 2 (18 %) больных в возрасте 40–59 лет, у 22 (88 %) пациентов в возрасте 60 лет и старше – у 1 (4 %) человека. Из 25 больных 20 (80 %) имели АГ 1-й степени, 5 (20 %) – АГ 2-й степени, систоло-диастолическая АГ была выявлена у 11 (44 %) человек, изолированная систолическая АГ – у 14 (56 %).
Среди пациентов 13 (52 %) человек имели высшее образование, а 6 (24 %) продолжали работать.
До включения в исследование все больные получали ранее назначенную антигипертензивную терапию: ингибиторы ангиотензинпревращающего фермента – 8 (32 %) пациентов, антагонисты кальция, кроме амлодипина, – 4 (16 %), диуретики – 6 (24 %), бета-блокаторы – 3 (12 %), препарат центрального действия (клонидин) – 2 (8 %), прочие препараты (адельфан, папазол) – 2 (8 %) человека.
Из сопутствующих заболеваний ожирение 1-й ст. имело место у 5 (20 %) больных, хроническая обструктивная болезнь легких – у 2 (8 %), хронические заболевания желудочно-кишечного тракта (гастрит, холецистит, панкреатит – все в стадии ремиссии) – у 6 (24 %), заболевания опорно-двигательного аппарата – у 6 (24 %), варикозное расширение вен нижних конечностей – у 2 (8 %) и узловой зоб (гормоны щитовидной железы в норме) – у 1 больного. Пациенты не принимали никаких сопутствующих препаратов, которые могли бы повлиять на анализируемые в данном исследовании параметры.
Критерии исключения:
- зависимость от алкоголя, лекарственных препаратов;
- психические заболевания или недееспособность;
- наличие деменции;
- уровень образования меньше среднего или среднего специального;
- отсутствие достаточной готовности к сотрудничеству;
- прогрессирование гипертонической болезни в течение последнего месяца;
- наличие в анамнезе инсульта, преходящего нарушения мозгового кровообращения, инфаркта миокарда;
- нестабильная стенокардия или стенокардия напряжения I–IV ФК;
- сердечная недостаточность I–IV класса по NYHA;
- нарушения ритма и проводимости сердца;
- сахарный диабет;
- клинически значимое заболевание дыхательных органов, желудочно-кишечного тракта, нервной системы, почек; гематологическое заболевание, тяжелые эндокринные нарушения;
- паркинсонизм или другие заболевания, сопровождающиеся дрожанием мышц;
- беременность, лактация;
- индекс массы тела > 35 кг/м2;
- гиперлипидемия (общий холестерин > 6,0 ммоль/л, триглицериды > 2,8 ммоль/л).
При исходном обследовании проводили сбор анамнеза, полное клиническое обследование, включившее рутинное измерение АД, суточное мониторирование АД, оценку соответствия пациента критериям включения/исключения; исследование когнитивных функций по схеме А.Р. Луриа, включившее, в частности, субтесты по произвольному запоминанию и мышлению [13, 14]. Исследовали слухо-речевую и зрительную память. Тест на слухо-речевую память состоял из 3 проб: а) проба «10 слов» – запоминание в любом порядке предлагаемых 10 слов (до пяти попыток); б) проба «5 слов» – запоминание 5 слов в определенном порядке (до трех попыток); в) проба «2 группы по 3 слова» – запоминание двух групп слов по 3 слова в каждой в определенном порядке (до трех попыток).
В данной пробе оценивали воздействие на память гомогенной (однородной по виду деятельности) интерференции, поскольку запоминание одной группы слов оказывает тормозящее влияние на запоминание и припоминание другой.
 Тест на зрительную память заключался в срисовывании пяти контурных изображений невербализуемых (которым невозможно дать четкое определение) фигур для запоминания и последующего воспроизведения (проба «5 фигур»). Больные воспроизводили слова и фигуры как сразу после запоминания, так и после выполнения задания на другой вид деятельности (гетерогенная интерференция). Оценивали следующие показатели: а) объем непосредственной слухо-речевой памяти (число слов, воспроизведенных после первой попытки в пробе «10 слов»), норма – 5 и более слов; б) эффективность заучивания (число повторений, необходимых для запоминания всех слов в пробе «10 слов»), норма – не более 5 попыток для воспроизведения всех 10 слов; в) точность запоминания в условиях гетерогенной интерференции (все пробы на слухо-речевую память). Запоминание расценивали как точное в отсутствие парафазий.
Тест на зрительную память заключался в срисовывании пяти контурных изображений невербализуемых (которым невозможно дать четкое определение) фигур для запоминания и последующего воспроизведения (проба «5 фигур»). Больные воспроизводили слова и фигуры как сразу после запоминания, так и после выполнения задания на другой вид деятельности (гетерогенная интерференция). Оценивали следующие показатели: а) объем непосредственной слухо-речевой памяти (число слов, воспроизведенных после первой попытки в пробе «10 слов»), норма – 5 и более слов; б) эффективность заучивания (число повторений, необходимых для запоминания всех слов в пробе «10 слов»), норма – не более 5 попыток для воспроизведения всех 10 слов; в) точность запоминания в условиях гетерогенной интерференции (все пробы на слухо-речевую память). Запоминание расценивали как точное в отсутствие парафазий.
Под парафазиями (один из видов ошибочных актуализаций) понимают феномен, когда обследуемый называет слова, отсутствовавшие в данной группе, заменяя их на другие, близкие по смыслу или звучанию; г) объем отсроченной слухо-речевой памяти (проба «2 группы по 3 слова») – число слов, правильно воспроизведенных (в любом порядке независимо от их первоначальной групповой принадлежности) после гетерогенной интерференции (норма – потеря не больше 2 слов от первоначально воспроизведенных); д) продуктивность запоминания в условиях гомогенной интерференции (проба «2 группы по 3 слова»). Учитывали количество попыток, необходимых для полного запоминания данного стимульного ряда, норма – 1–2 попытки; е) отсутствие контаминаций при гомогенной интерференции, т. е. смешений слов из первой группы со словами из второй (проба «2 группы по 3 слова»); ж) объем непосредственной зрительной памяти (проба «5 фигур») – число фигур, правильно воспроизведенных сразу после запоминания (норма – 5 фигур); з) объем отсроченной зрительной памяти (проба «5 фигур») – число фигур, правильно воспроизведенных после гетерогенной интерференции (норма оценивалась относительно объема непосредственной памяти, т. е. могло быть утеряно не более 2 фигур от первоначально воспроизведенных пациентом).
При изучении мыслительной деятельности особое внимание было уделено исследованию уровня обобщения в вербально-логической, зрительно-логической и наглядно-образной сферах. В соответствии с этим тесты на мышление включали следующие задания: а) для вербально-логической задание «трактовка смысла пословиц». Больному предлагалось своими словами передать переносное значение трех хорошо известных русских народных пословиц (норма – правильная трактовка всех трех пословиц); б) для зрительно-логической задание «исключение предметов». Больному последовательно предъявляли 6 карточек с изображением четырех предметов на каждой и просили исключить один предмет, не подходящий по смыслу к трем другим, составляющим единую логическую группу (норма – правильное выполнение задания по всем карточкам); в) для наглядно-образной задание «понимание сюжетных картин». Больному предъявляли последовательность из трех картинок, где разворачивается цепочка событий, и просили составить по ним устный рассказ (норма – правильно установленный смысл сюжета).
Внимание оценивали по таблицам Шульте. Это таблицы с расположенными в произвольном порядке цифрами от 1 до 25. За одно обследование последовательно предъявлялось 5 таблиц. Пациенту предлагалось назвать цифры в порядке возрастания от 1 до 25. В норме время прохождения каждой таблицы должно быть менее 60 секунд. Если хотя бы одна таблица занимала более 60 секунд, говорили о снижении внимания или его колебаниях [14].
После исходного обследования пациентам был назначен препарат амлодипин (Нормодипин, «Гедеон Рихтер», Венгрия) в стартовой дозе 2,5–5,0 мг один раз в сутки утром. Через 4 недели при недостижении целевого АД (менее 140/90 мм рт. ст.) по данным рутинного измерения дозу корректировали. Длительность наблюдения составила 24 недели. В итоге доза амлодипина составила 2,5–10,0 мг: 2,5 мг – 1 человек, 5,0 мг – 4; 7,5 мг – 2, 10,0 мг – 18 человек. В конце периода наблюдения повторяли все обследования.
Статистическую обработку данных проводили с помощью пакета программ Excel 97, Statistica 6.0 и SPSS 13.0 на компьютере IBM PC/AT-586. Рассчитывали средние величины, их средние стандартные ошибки и 95 % доверительный интервал. Гипотезу о равенстве средних оценивали по F-критерию (дисперсионный анализ). Попарную взаимосвязь между двумя и более непрерывными признаками определяли методом корреляционного анализа. Корреляционную связь между выборками данных оценивали с уровнем значимости 95 %. Для изучения распределения дискретных признаков в различных группах применяли стандартный метод анализа таблиц сопряженности χ-квадрат по Пирсону и метод ранговых корреляций по Спирману. Для анализа малых выборок (до 30 наблюдений) применяли непараметрические методы статистической обработки данных. Вероятность того, что статистические выборки отличались друг от друга, существовала при р < 0,05.
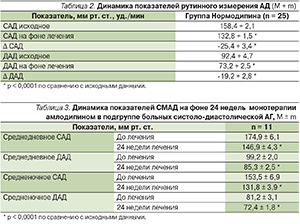
На фоне антигипертензивной монотерапии амлодипином в дозе 2,5–10,0 мг один раз в сутки в течение 24 недель отмечено достоверное снижение показателей рутинного измерения АД (табл. 2). Среди пациентов, получавших амлодипин (Нормодипин), целевые значения АД были получены во всех 25 (100 %) случаях. По данным суточного мониторирования АД выявлено достоверное снижение систолического и диастолического АД как в дневные, так и в ночные часы в обеих подгруппах, т. е. у пациентов с систоло-диастолической изолированной систолической АГ (табл. 3, 4).
Через 24 недели лечения нормализация АД по данным суточного мониторирования АД (дневное АД < 140/90 мм рт. ст. и ночное АД < 125/80 мм рт. ст.) выявлена у 9 (36 %) больных При исследовании мышления исходно нарушения в наглядно-образной сфере (число больных в %, неправильно выполнивших тест) выявлены у 32 % больных, в зрительно-логической – у 52 %, а в вербально-логической – у 16 % пациентов. Исходя из полученных данных, у обследованных нами пожилых больных АГ чаще всего имели место нарушения в зрительно-логической сфере. Через 24 недели лечения число больных с нарушениями в наглядно-образной сфере уменьшилось до 24 %, в зрительно-логической – до 32 %, в вербально-логической – до 0 %. При этом выявленные изменения в вербально-логической сфере достоверны (p < 0,05). Следовательно, на фоне проведенного лечения в группе амлодипина имело место достоверное улучшение вербально-логического мышления, кроме того, уменьшилось число пациентов, обнаруживших видимые затруднения и в других сферах мышления.
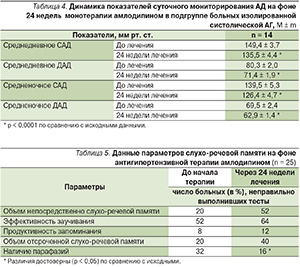
Терапия амлодипином не вызвала усугубления нарушений внимания, напротив, наблюдалось даже уменьшение числа больных с нарушением внимания: исходно они обнаружены у 68 % пациентов, через 24 недели лечения данной фиксированной комбинацией – 52 %. Наиболее сложной для оценки высшей психической функции является память, т. к. она состоит из множества параметров. Объем слухо-речевой памяти, как непосредственной, так и отсроченной, достоверно не изменился (табл. 5), так же как и продуктивность запоминания, эффективность заучивания. Выявлено достоверное уменьшение количества парафазий. Параметры, характеризующие зрительную память, достоверно не изменились на фоне лечения амлодипином.
Особо необходимо обратить внимание на выявленное нами на фоне лечения амлодипином уменьшение выявляемости парафазий, что можно трактовать как следствие положительного влияния терапии на медиобазальные отделы лобных долей [14, 15]. Отмеченная динамика была связана с оптимизацией мнестического процесса преимущественно за счет улучшения работы отделов мозга, отвечающих за программирование, регуляцию и контроль над протеканием деятельности запоминания и припоминания. Этими отделами являются лобные доли (префронтальные и заднелобные структуры, связанные с эстрапирамидной системой) [14, 15].
Таким образом, в отношении пожилых больных АГ амлодипин обладает высокой антигипертензивной эффетивностью и улучшает ряд когнитивных функций.


