Введение
Нарушение кровоснабжения головного мозга инициирует каскад биохимических реакций, среди которых ключевое место занимают процессы свободнорадикального окисления белков, нуклеиновых кислот и липидов активными формами кислорода (АФК). Дисбаланс между продукцией АКФ и регуляторными механизмами антиоксидантного контроля их образования, представленными ферментами антирадикальной защиты и клеточными антиоксидантами, приводит к развитию окислительного стресса. Избыточная генерация АФК и истощение эндогенного антиоксидантного потенциала в условиях окислительного стресса вызывают резкую интенсификацию процессов перекисного окисления липидов (ПОЛ). Накопление высокотоксичных продуктов окисления оказывает системное воздействие не только на мембраны нейронов, но и на клетки в целом [2].
Деструкция нейрональных мембран в результате окислительной атаки на ключевые рецепторы нервной ткани ведет к повышенному высвобождению эксайтотоксических медиаторов: глутамата, серотонина, катехоламинов, открытию ионных каналов и быстрому накоплению Са2+ в нейронах. В результате наблюдается активация ряда ферментных систем – фосфолипаз и протеиназ, а также специфическая активация NO-синтазы и кальпаина. Все эти процессы приводят к существенному изменению метаболизма и деструкции нейронов [2, 3]. В случае невозможности нейтрализовать избыток АФК происходит активация каскада реакций, вызывающих или хаотичную (по типу некроза), или программируемую (апоптоз) смерть клетки. При этом дезорганизация энергетического метаболизма и истощение клеточного запаса АТФ в процессе реализации программы апоптоза могут приводить к изменению этой программы и замещению апоптоза некрозом [8, 12, 14]. Характер гибели нейронов определяется рядом факторов, включающих тяжесть ишемии мозга, уровень внутриклеточного Са2+, содержание трофических факторов. По современным представлениям, в активации генетически детерминированного апоптозного каскада, включающего экспрессию проапоптозных генов, апоптоз-генерирующих белков и активацию каспаз, участвуют эксайтотоксичность, цепные реакции ПОЛ, постишемическое воспаление, деструкция митохондрий [1].
По ряду причин мозг является органом, чрезвычайно чувствительным к недостатку кислорода и глюкозы. К особенностям его метаболизма относится интенсивный окислительный обмен: составляя всего 2 % от общей массы тела, мозг утилизирует 20–25 % получаемого организмом кислорода. Этот
уровень так велик, что превращение только 0,1 % метаболизируемого нейронами кислорода в активный радикал оказывается токсичным для нервной ткани. Во многом эта чувствительность также определяется высоким содержанием в мембранах нейронов легкоокисляемых липидов с полиненасыщенными жирными кислотами (особенно типа арахидоновой и докозогексаеновой кислот), катализаторов свободнорадикальных реакций – ионов металлов с переменной валентностью,
низкой активностью ферментных систем и низким содержанием эндогенных антиоксидантов [14].
Однако быстрое восстановление поступления кислорода в мозг может вызывать неуправляемый рост образования АФК, и в этих условиях его подстерегает реальная опасность окислительного стресса. В связи с этим чрезвычайно важным остается поиск путей избирательного воздействия на свободнорадикальные процессы [2].
Перспективным направлением лечения острых и хронических форм нарушений мозгового кровообращения (НМК) может считаться применение фармакологичских препаратов, способных включаться в систему защиты мозга от окислительного стресса, предотвращающих свободнорадикальные процессы и обладающих антиоксидантным действием [5–7, 9, 10]. Однако, несмотря на очевидную целесообразность антиоксидантной терапии при ишемии мозга и экспериментальные доказательства ее эффективности, до сих пор сохраняется дефицит доступных для широкой клинической практики антиоксидантных средств [8].
С этой точки зрения безусловный интерес представляет Милдронат – структурный аналог γ-бутиробетаина (предшественника карнитина), синтезированный в 1972 г. выпускаемый фирмой Гриндекс (Латвия) и Фармстандарт (Россия) [4]. В России Милдронат зарегистрирован и разрешен к медицинскому применению в 1997 г.
Милдронат (мельдоний) является конкурентным ингибиторомγ-бутиробетаингидроксилазы. В основе фармакологического действия препарата лежит уменьшение содержаниясвободного карнитина и снижение карнитинзависимого окисления жирных кислот. Наряду с этим, с одной стороны, ограничивается транспорт в клетки активированных форм жирных кислот, с другой – задерживается их внутриклеточное накопление. В ответ на подобное изменение метаболических процессов предотвращается повреждение клеток, сохраняется возможность транспорта АТФ из митохондрий в места потребления и активизируется гликолиз, при котором для производства энергии используется химически связанный кислород. Тем самым под действием Милдроната обеспечивается защита клеток в условиях ишемии [4].
С учетом перспективности нейропротекции с помощью антиоксидантов в терапии НМК в Научном центре неврологии РАМН были проведены исследования клинической эффективности препарата Милдронат при острых и хронических НМК с оценкой его влияния на динамику неврологических нарушений, состояние процессов ПОЛ и мозговой кровоток.
Применение Милдроната при ишемическом инсульте
Целью исследования явилось изучение клинической эффективности Милдроната у больных ишемическим инсультом (ИИ), а также его влияния на динамику показателей ПОЛ, когнитивные функции, мозговой кровоток.
Клиническая характеристика больных и методы исследования
В исследование были включены 60 больных в возрасте от 42 до 75 лет с ИИ в каротидной системе в течение первых 48 часов от момента появления неврологических симптомов. Основным сосудистым заболеванием у обследованных больных являлось сочетание атеросклероза и артериальной гипертензии (АГ).
Диагностика ИИ и основного сосудистого заболевания проведена с использованием общеклинических
методов, неврологического осмотра, а также магнитно-резонансной томографии (МРТ) головы, дуплексного сканирования (ДС) магистральных артерий головы (МАГ), суточного мониторирования артериального давления (АД), офтальмологического исследования, ЭКГ, Эхо-КГ, клинического и биохимического анализов крови (сахар, мочевина, липиды, билирубин) и исследования гемореологических показателей.
Диагноз АГ установлен на основе анамнестических данных, регистрации повышенных цифр АД (как при каузальных измерениях, так и при суточном мониторировании), результатов нейроофтальмологического обследования, Эхо-КГ (гипертрофия левого желудочка). Основанием диагностики атеросклероза служили данные ДС МАГ (атеросклеростеноз, уплотнение и утолщение интимы сонных и позвоночных артерий), Эхо-КГ (фиброз аорты, аортального кольца и аортальных клапанов), компьютерной томографии (КТ) мозга в ангиографическом режиме, нейроофтальмологического обследования.
Основными сосудистыми заболеваниями, обусловившими развитие неврологических нарушений у большинства больных, были: АГ – у 28 (46,7 %) пациентов, атеросклероз в сочетании с АГ – у 23 (38,3 %), атеросклероз – у 9 (15 %).
Во всех наблюдениях в остром периоде ИИ выявлены инфаркты головного мозга супратенториальной локализации в бассейне артерий каротидной системы, соответствующие клинической симптоматике.
По патогенетическому подтипу больные с ИИ распределились следующим образом: лакунарный инсульт – 28, кардиоэмболический инсульт – 12, атеротромботический инсульт – 12, гемодинамический инсульт – 8.
Определение степени выраженности неврологических нарушений проведено по шкале Национального института здоровья (NIHSS): в отсутствие неврологических нарушений общая оценка по данной шкале составляет 0 баллов; максимальная выраженность неврологических нарушений соответствует 36 баллам. На основании анализа неврологического статуса все больные, включенные в исследование, соответствовали группе средней степени тяжести.
Исследование клинической эффективности препарата Милдронат проведено сравнительным методом. Группа активного лечения (Милдроната) включила 30 больных, контрольная группа (ХАЕС) – 30. Все пациенты получали базисную антиагрегантную, антигипертензивную, кардиальную терапию и терапию, направленную на коррекцию гипергликемии у пациентов с СД. Схема лечения была стандартизована. В течение первых 20 дней ИИ назначались ежедневные внутривенные инфу-
зии Милдроната в дозе 1000 мг (10 мл 10 %-ного раствора на 250 мл физиологического раствора) или реополиглюкина по 400 мл. Затем Милдронат назначался в суточной дозе 1000 мг (по 500 мг дважды в день) в течение 8 недель. В период курса лечения исключалась терапия вазоактивными, ноо- и
психотропными препаратами.
Эффективность лечения определена по результатам следующих исследований:
1. Клиническая эффективность лечения основывалась на оценке неврологического статуса при поступлении, на 21-е сутки и спустя 11 недель от начала лечения (по шкале NIHSS, норма – 0 баллов; модифицированной шкале Рэнкина, норма – 0 баллов; индексу Бартела, норма – 100 баллов) и оценке
эффекта лечения исследователем по 5-ступенчатой шкале спустя 14 дней и 3 месяца от начала лечения: 0 – ухудшение, 1 – без динамики, 2 – удовлетворительно (небольшое улучшение), 3 – хорошо (заметное улучшение), 4 – отлично (исчезновение симптомов).
2. Состояние процессов ПОЛ оценено по ряду информативных кинетических параметров Fe2+-индуцированной хемилюминесценции (ХЛ) суммарной фракции липопротеидов (ЛП) низкой
и очень низкой плотности сыворотки крови [11]. Кровь у пациентов брали из локтевой вены утром натощак. К полученной сыворотке добавляли 2 мл 0,28 %-ного раствора СаСl2 и 40 мкл 1 %-ного раствора гепарина. Выделяли суммарную фракцию ЛП низкой и очень низкой плотности. Для инициации ХЛ в пробу вводили FeSO4 (в конечной концентрации 2,5 мМ) и регистрировали следующие
кинетические параметры: амплитуду быстрой кратковременной вспышки ХЛ (h, мВ), которая выявляется после добавления в пробу FeSO4 и длится несколько секунд (пропорциональна исходному содержанию преобразованных продуктов ПОЛ); максимальную интенсивность ХЛ (Н, мВ), которая нарастает постепенно, затем выходит на максимум и через некоторое время начинает снижаться (ее величина отражает максимально возможную интенсивность ПОЛ); период времени (τ, с) между быстрой вспышкой и началом максимального развития ХЛ, длительность которого зависит от соотношения про антиоксидантов в анализируемом образце. Измерения Fe2+-индуцированной ХЛ проводили на приборе Luminometer-1251 (LKB, Швеция).
3. Нейропсихологическое исследование в отсутствие речевых нарушений (n = 38) включало:
1. Общую оценку динамики психической деятельности с регистрацией:
• времени запоминания 10 слов;
• времени выполнения серийного счета “100-7”.
2. Исследование слухо-речевой памяти:
• запоминание 10 слов после 5-кратного повторения с последующими двумя отсроченными воспроизведениями;
• воспроизведение числовых рядов в прямом (кратковременная память) и обратном (оперативная память) порядках.
3. Исследование интеллектуальной деятельности: выполнение серийных счетных операций “100-7” с оценкой времени выполнения теста и количества ошибок.
4. Исследование внимания: поиск чисел по таблицам Шульте с оценкой времени выполнения задания.
4. Исследование церебральной перфузии проведено методом однофотонной эмиссионной КТ (ОФЭКТ) на аппарате Starcam 3200i (GE Medical Systems, США). В качестве радиофармпре-
парата внутривенно введен церетек (Ceretec, Nycomed Amersham, UK), меченный in vitro Tc99m-пертехнетатом в дозе 740 МБк.
Помимо визуального изучения полученные результаты были обработаны с помощью программы CORTIQAL, которая предоставляет возможность полуколичественной оценки церебральной перфузии корковых и подлежащих субкортикальных отделов в 8 различных сегментах головного мозга, раздельно в правом и левом полушариях: передне-лобном, средне-лобном, задне-лобном, теменном, височно-теменном, височно-затылочном, височном, а также в проекции сильвиевой щели (перисильвиарном). В качестве референтной области был определен мозжечок в связи с относительной
стабильностью его гемодинамики. Для статистической обработки использован показатель относительной корковой перфузии (ОКП), отражающий отношение показателя перфузии в заданном сегменте полушария большого мозга к показателю перфузии в мозжечке, принимаемой за 100 %.
Статистический анализ данных выполнен с использованием пакета прикладных программ Statistica 6.1
(StatSoft, Inc., США).
Результаты и их обсуждение
1. Анализ исходной сопоставимости групп до начала лечения В исследование были включены 60
больных (29 мужчин и 31 женщина), соответствующих критериям включения в исследование, из них в группу Милдроната вошли 30 пациентов, в группу ХАЕС – 30.
Сформированные группы были исходно сопоставимыми по всем основным клиническим и томографическим признакам (табл. 1), способным влиять на эффективность лечения.
Таблица 1. Сравнительная характеристика групп больных по основным клиническим
и томографическим признакам до начала лечения.
2. Переносимость лечения.
У 8 больных на фоне лечения Милдронатом были зафиксированы побочные явления в виде незначительного повышения АД. Прерывания лечения и уменьшения дозы препарата не потребовалось. Повторных НМК на фоне лечения Милдронатом не наблюдалось, ухудшения коронарного кровообращения также не было отмечено.
Контроль за АД показал, что на фоне лечения ХАЕС его уровень оставался стабильным, однако у 10 больных отмечена тенденция к повышению систолического АД на 15 % по сравнению с исходным. Спустя 1–3 суток на фоне лечения антигипертензивными препаратами АД возвращалось к исходным цифрам.
3. Эффективность лечения.
В группе больных, получавших Милдронат, спустя 20 дней от начала лечения улучшение общего состояния наступило у 87 % больных. При оценке эффекта лечения исследователем у 24 из 30 пациентов также отмечен положительный эффект: у 11 – хороший и у 13 – удовлетворительный. Для 24 больных улучшение касалось главным образом двигательных расстройств и выражалось в уменьшении степени пареза, увеличении объема движений, причем для пациентов с умеренными
гемипарезами это касалось движений в ноге, что позволяло им начинать ходить; в руке также увеличивались движения в крупных суставах. У больных с изначально легкими двигательными нарушениями на фоне лечения наблюдался регресс пареза, прежде всего в руке.
Таблица 2. Сравнительная характеристика групп больных по клиническим шкалам до (1–2-е сутки)
и после (14-е сутки) курса внутривенных инфузий.
Исследуемые группы пациентов спустя 20 дней после начала инфузий оказались статистически значимо (по критерию Манна–Уитни) различными при суммарной балльной оценке по шкале NIHSS (р = 0,004), по индексу Бартела (р = 0,001) и модифицированной шкале Рэнкина (р = 0,002; табл. 2). Результаты свидетельствуют о меньшей степени неврологических нарушений и инвалидизации в группе Милдроната к концу курса его внутривенного капельного введения.
При анализе динамики в группах установлено статистически значимое (по критерию Вилкоксона) изменение суммы баллов NIHSS и индекса Бартела в обеих группах больных. Балл модифицированной шкалы Рэнкина статистически значимо уменьшился только в группе Милдроната.
Оценка степени уменьшения выраженности неврологических нарушений по шкале NIHSS спустя 11 недель терапии Милдронатом выявила:
• полное восстановление неврологических функций у 6 больных (20 %);
• значительное улучшение (неврологические нарушения уменьшились на 6 баллов по сравнению с таковым до начала терапии) у 11 больных (36,7 %);
• незначительное улучшение (неврологические нарушения уменьшились на 3 балла по сравнению
с исходными до начала лечения) у 7 больных (23,3 %).
Как следует из полученных результатов, улучшение двигательных функций отмечено у большинства
пациентов.
У больных без корковых нарушений повышалась общая активность, уменьшалась замедленность реакций, увеличивались темп выполнения заданий и переключаемость, улучшалась память, уменьшалась лабильность эмоционально-волевой сферы.
Влияние Милдроната на восстановление корковых функций не было столь велико. Пациенты с речевыми нарушениями в результате проведенного курса лечения становились более собранными; у них улучшалаись память, концентрация внимания, ускорялся подбор слов, понимание чужой речи при сенсорной афазии. Повышение активности больных на логопедических занятиях увеличивало
эффективность этих занятий. Что же касается формы речевых нарушений, то на фоне лечения Милдронатом лучшие результаты отмечены при дизатрии, моторной и амнестической афазии. Наименьший эффект наблюдался при сенсорной и смешанной афазии.
В группе больных, получавших ХАЕС, положительный клинический эффект был получен 10 больными, т. е. в 30 % случаев, но только у 5 пациентами он был оценен как хороший (неврологические нарушения уменьшились на 5 баллов по сравнению с числом до начала терапии), а у 3 больными – как удовлетворительный (неврологические нарушения уменьшились на 3 балла по сравнению с числом до начала лечения). Заметного влияния ХАЕС на восстановление нарушений двигательных и речевых функций отмечено не было.
Результаты исследования ПОЛ показали, что у обследованных больных обеих групп до начала лечения средние величины показателей, отражающих уровень гидроперекисей липидов (h) и максимальную способность липидов к перекисному окислению (Н), статистически значимо отличались от нормальных значений. Этот процесс сопровождался значительным снижением устойчивости липопротеиновых
структур к окислению (τ), что свидетельствует о недостаточной эффективности антиоксидантной защиты вследствие истощения эндогенных антиоксидантов (табл. 3).
Таблица 3. Динамика параметров ПОЛ у больных ИИ (параметры Fe2+-индуцированной ХЛ ЛП сыворотки крови, M ± SD).
Полученные данные стали теоретическим обоснованием целесообразности назначения Милдроната, действие которого направлено на коррекцию выявленных изменений.
Спустя 20 дней после начала внутривенных капельных введений Милдроната произошло статистически значимое снижение уровня гидроперекисей, что свидетельствует о снижении способности липопротеиновых структур к окислению (табл. 3) с одновременным увеличением длительности латентного периода ХЛ (τ), отражающим окислительную резистентность ЛП. На основании этих данных можно заключить, что для больных ИИ антиоксидантная активность Милдроната заключается
в основном в повышении активности эндогенных антиоксидантов и снижении способности липопротеиновых структур к окислению, что связано с его ингибирующим действием на свободнорадикальное окисление липидов. В группе пациентов, получавших ХАЕС, статистически значимых изменений показателей ПОЛ отмечено не было.
Исследование церебральной перфузии методом ОФЭКТ до и после проведения курса внутривенных инфузий было проведено 47 больным. Из них 24 пациента получали Милдронат и 23 – ХАЕС. Анализ показателей мозговой перфузии проведен с учетом данных МРТ головного мозга. Состояние отчетливого относительного снижения перфузии регистрировали, если относительный коэффициент
перфузии был ниже 85 %, а коэффициент абсолютной гипоперфузии – ниже 80 %.
Исходные данные ОФЭКТ характеризовались выраженной локальной гипоперфузией, соответствующей
инфарктам мозга по данным МРТ, со снижением ОКП в области инфарктов на 20 % и более, в то время как в контралатеральном полушарии большого мозга отмечены достаточно высокие показатели мозгового кровотока. У больных с малыми глубинными (лакунарными) инфарктами выявлены области умеренной гипоперфузии. После курса лечения существенных изменений усредненных показателей
ОКП не было зарегистрировано ни в одной из групп лечения. У больных с малыми глубинными (лакунарными) инфарктами при обеих схемах лечения наблюдались как положительные, так и отрицательные гемоперфузионные эффекты, хотя визуально при лечении Милдронатом для большинства пациентов имело место диффузное усиление перфузии в регионах гипоперфузии. Изменение перфузионных показателей чаще всего наблюдалось в лобных и височных сегментах, что
позволяет говорить об относительной нестабильности и динамичности кровотока в этих отделах мозга. Данную закономерность можно объяснить следующим: территория лобных сегментов соответствует области белого вещества, которая является зоной смежного кровоснабжения между ветвями преимущественно поражаемых при АГ корково-медуллярных артерий, отходящих от артерий поверхности мозга и хореоидальных артерий, и поэтому наиболее чувствительна к изменениям мозгового кровотока.

При анализе данных ОФЭКТ у больных с инфарктами мозга средних и больших размеров отмечены более четкие изменения: после курса лечения Милдронатом увеличилась среднеполушарная относительная корковая перфузия в пораженном полушарии (рис. 1). Статистически значимое повышение средних показателей ОКП на 7 % произошло в средне-лобном сегменте измененного полушария большого мозга (рис. 2).
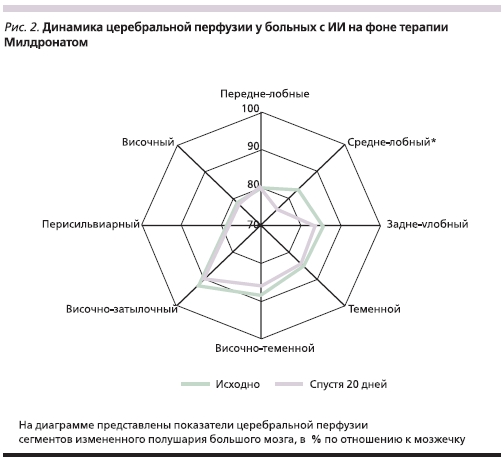
Следует подчеркнуть, что наиболее заметное улучшение мозгового кровотока наблюдалось у пациентов с ИИ по типу кардиогенной эмболии, т. е. в отсутствие изменений интрацеребральных или магистральных артерий головы.
Таким образом, на фоне лечения Милдронатом у пациентов с инфарктами мозга супратенториальной локализации вследствие кардиогенной эмболии происходит улучшение гемоперфузионных показателей. Данный факт может свидетельствовать о возможной зависимости церебральной гемоперфузии от состояния метаболизма нервной ткани в отсутствие изменений мелких интрацеребральных и магистральных артерий мозга и системной гемодинамики. У больных без речевых
нарушений до начала лечения выявлены те или иные расстройства когнитивных функций, из которых ведущими были нарушения зрительной памяти, интеллектуальной деятельности и внимания.
Спустя 11 недель от начала терапии Милдронатом улучшилась общая динамика психической деятельности,что выражалось в виде укорочения времени запоминания 10 слов (табл. 4). Исследование интеллектуальной деятельности выявило у больных, получавших лечение Милдронатом, статистически значимое укорочение времени выполнения серийного счета “100-7”. Кроме того, отмечена тенден-
ция к уменьшению числа допускаемых ошибок.
Таблица 4. Динамика темпа психических процессов.
Таблица 5. Динамика кратковременной и оперативной памяти.
Улучшение кратковременной памяти (воспроизведение числовых рядов в прямом порядке) после лечения Милдронатом не было достоверным (табл. 5). Улучшение же оперативной памяти (воспроизведение числовых рядов в обратном порядке), где значительно возрастает роль процессов
внимания, после курса лечения было статистически значимым.
При исследовании слухо-речевой памяти путем запоминания 10 слов после 5 повторов и внимания при
помощи поиска чисел по таблицам Шульте существенной динамики показателей не отмечено. В результате лечения ХАЕС темп психической деятельности, кратковременная и оперативная память не изменились.
Таким образом, результаты нейропсихологического исследования дают основание предполагать, что терапия Милдронатом положительно влияет на течение психических процессов у больных ИИ. При этом следует отметить, что Милдронат оказывал влияние на темп, или “скоростные характеристики”, психической деятельности в виде укорочения времени серийного счета, а также на процессы, связанные с интеллектуальной деятельностью (проба с вычитанием “100-7”), вниманием (запоминание ряда цифр в обратном порядке).
Применение Милдроната при хронических нарушениях мозгового кровообращения
Целью исследования cтало изучение клинической эффективности Милдроната у больных дисциркуляторной энцефалопатией II стадии (ДЭ II), а также его влияния на динамику показателей ПОЛ и когнитивные функции.
Клиническая характеристика больных и методы исследования
Под наблюдением находились 67 больных в возрасте от 45 до 76 лет, страдавшие АГ в сочетании с атеросклерозом. Длительность повышения АД составила 10 лет и более.
Диагностика формы и стадии цереброваскулярного заболевания, а т акже основного сосудистого процесса проведена с использованием общеклинических методов, неврологического осмотра, МРТ головы, ДС МАГ, суточного мониторирования АД, офтальмологического обследования, ЭКГ, Эхо-
КГ, исследования гемореологических показателей. У всех пациентов была диагностирована ДЭ II без предшествующих НМК (45 больных) или с эпизодами повторных НМК – ишемических инсультов в анамнезе (22 больных).
Множественные очаговые и диффузные изменения головного мозга у больных ДЭ II были подтверждены при МРТ головного мозга. Локализация инфаркта у 18 пациентов соответствовала бассейну кровоснабжения средней мозговой артерии и 4 – бассейну артерий вертебрально-базилярной системы. По патогенетическому подтипу больные, перенесшие ИИ, распределились следующим образом: лакунарный инсульт – 9, кардиоэмболический инсульт – 6, атеротромботический инсульт – 5, гемодинамический инсульт – 2.
При ДЭ II без предшествующих НМК отмечена большая выраженность как субъективных, так и объективных симптомов заболевания. Признаки декомпенсации хронических цереброваскулярных нарушений включали снижение психической и физической активности, апатию, учащение приступов головных болей и головокружений несистемного характера, жалобы на нарастающую общую слабость, быструю утомляемость и истощаемость при выполнении привычной работы, трудности концентрации, своевременного переключения внимания и организации своей деятельности, снижение памяти и работоспособности, ощущение шума и “пустоты” в голове, раздражительность и эмоциональную лабильность.
При неврологическом осмотре выявлена асимметрия носогубных складок, девиация языка, анизорефлексия, вестибуло-мозжечковые (головокружение, пошатывание, неустойчивость при ходьбе), негрубые псевдобульбарные (нечеткость речи, “насильственный” смех и плач) и экстрапирамидные нарушения (тремор головы, пальцев рук, гипомимия, ригидность мышц, замедленность движений), снижение интеллектуально-мнестических функций.
У больных с последствиями ИИ в клинической картине превалировали симптомы очагового поражения нервной системы: двигательные нарушения от легкого монопареза руки до выраженного гемипареза (у 17 больных), расстройства статики и координации (у 5 больных) и легкие нарушения корковых функций (у 11 больных). Астенический и астено-депрессивный синдромы имели место у 9 больных.
Распределение пациентов последствиями НМК по клиническим синдромам представлено в табл. 6.
Таблица 6. Основные неврологические синдромы у больных с последствиями НМК.
Милдронат вводили ежедневно в течение 20 дней внутривенно капельно в дозе 5- мл 10 %-ного раствора (т. е. 500 мг) в 200 мл 0,85 %-ного раствора хлорида натрия. При необходимости назначали антигипертензивные и кардиальные препараты. Все больные с последствиями НМК получали Милдронат в сроки до года после НМК.
Определение клинической эффективности лечения основывалось на субъективной оценке основных симптомов заболевания (головная боль, головокружение, шум в голове, нарушение сна, утомляемость, снижение памяти, депрессия и тревожность, эмоциональная лабильность) с использованием 5-балльной рейтинговой шкалы со стандартизированными критериями выраженности каждого симптома (от “0” – нет нарушений до “4” – грубые проявления); исследовании неврологического статуса с оценкой двигательных, вестибуломозжечковых, экстрапирамидных, чувствительных, псевдобульбарных и речевых нарушений. Эффект лечения исследователь и больной оценивали
по 5-ступенчатой шкале: “отлично”, “хорошо”, “удовлетворительно”, “неудовлетворительно”, “отсутствие эффекта”.
Влияние Милдроната на когнитивные нарушения у больных ДЭ II без нарушений высших корковых функций изучено при помощи нейропсихологического исследования, включившего:
1. Общую оценку динамики психической деятельности с регистрацией:
• общего времени выполнения задания;
• времени запоминания 10 слов;
• времени выполнения серийного счета “100-7”.
2. Исследование слухо-речевой памяти:
• запоминание 10 слов после 5-кратного повторения с последующими двумя отсроченными воспроизведениями;
• воспроизведение числовых рядов в прямом (кратковременная память) и обратном (оперативная память) порядках.
3. Исследование зрительной памяти: тест Бентона – запоминание и графическое воспроизведение 10 последовательно предъявленных картинокс учетом количества правильных ответов и количества ошибок,
4. Исследование интеллектуальной деятельности: выполнение серийных счетных операций “100-7” с оценкой времени выполнения теста и количества ошибок.
5. Исследование внимания: поиск чисел по таблицам Шульте с оценкой времени выполнения задания.
При возникновении у больных афазии и других нарушений высших корковых функций очагового типа проводилось нейропсихологическое исследование речевых функций, письма, чтения, счета, гнозиса и праксиса с использованием набора стандартизованных нейропсихологических проб.
У всех пациентов оценивалось состояние эмоционально-волевой сферы, общей двигательной и психической активности.
Состояние процессов ПОЛ оценивали по ряду информативных кинетических параметров Fe2+-индуцированной ХЛ суммарной фракции ЛП низкой и очень низкой плотности сыворотки крови, выделяемых в системе хлористого кальция с гепарином и используемых в качестве липидного субстрата окисления [11]. Измерения Fe2+-индуцированной ХЛ проведено на приборе Luminometer-1251 (LKB, Швеция). В работе анализировали следующие параметры ХЛ: амплитуду быстрой вспышки h (мВ), отражающую уровень предобразованных продуктов ПОЛ (преимущественно гидроперекисей липидов); устойчивость липопротеиновых структур к окислению τ (с), отражающую эффективность антиоксидантной защиты, и интенсивность медленной фазы Н (мВ), характеризующую максимальную способность липидов к перекисному окислению.
Статистический анализ данных выполнен с использованием пакета прикладных программ Statistica 6.1
(StatSoft, Inc., США).
Результаты исследования и их обсуждение
1. Переносимость лечения Побочные явления на фоне курса лечения были зафиксированы у 7 боль-
ных и выражались преимущественно в усилении колебаний АД (n = 6) и болях в области сердца (n = 1). При этом связь возникших побочных явлений с проводимой терапией была оценена лечащим врачом как “неизвестная”.
2. Клиническая эффективность лечения
Улучшение общего состояния наступило у 50 (74,6 %) пациентов. Уже на второй неделе лечения увеличился интерес больных к окружающему, уменьшились признаки психической истощаемости, исчезла сонливость в дневные часы, упорядочились поведение и психоэмоциональные реакции.
Уменьшились неприятные субъективные ощущения в области головы.
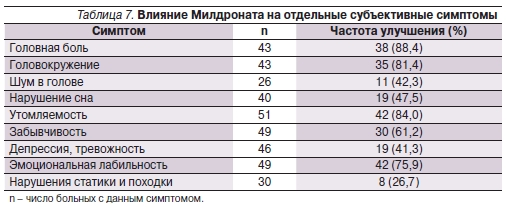
Сопоставление балльной оценки тяжести клинического синдрома до начала исследования и по его завершении (спустя 20 дней) выявило статистически значимое улучшение состояния больных по таким клиническим симптомам, как головная боль, головокружение, утомляемость, забывчивость, эмоциональная лабильность (табл. 7, 8).

Для выявления влияния терапии Милдронатом на психические процессы 56 больным было проведено
психологическое исследование. У всех больных до начала лечения выявлены те или иные нарушения когнитивных функций, из которых ведущими были нарушения зрительной памяти, интеллектуальной деятельности и внимания.
В результате терапии Милдронатом улучшилась общая динамика психической деятельности, что выражалось в виде уменьшения времени выполнения задания и укорочении времени запоминания 10 слов.


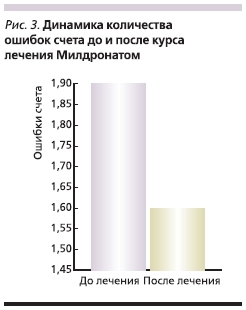
Исследование интеллектуальной деятельности выявило статистически значимое укорочение времени выполнения задания (табл. 9) и уменьшение числа допускаемых ошибок (рис. 3). Изменений кратковременной памяти (воспроизведение числовых рядов в прямом порядке) после курса лечения Милдронатом зарегистрировано не было. Улучшение же оперативной памяти (воспроизведение числовых рядов в обратном порядке), для которой значительно возрастает роль процессов внимания, было статистически значимым (табл. 10).
Исследование зрительной памяти при помощи теста Бентона после проведенного курса лечения показало достоверное уменьшение количества ошибок и увеличение числа правильных ответов.
При исследовании слухо-речевой памяти путем запоминания 10 слов после 5 повторов и внимания при
помощи поиска чисел по таблицам Шульте существенной динамики показателей не отмечено.
Таким образом, результаты нейропсихологического исследования дают основание предполагать, что терапия Милдронатом оказывает определенное положительное влияние на протекание психических процессов у больных ДЭ II. При этом следует отметить, что Милдронат оказывал влияние на темп,
или “скоростные характеристики”, психической деятельности в виде укорочения времени выполнения всего задания и серийного счета, а также на процессы, связанные с интеллектуальной деятельностью (проба с вычитанием “100-7”), вниманием (запоминание ряда цифр в обратном порядке) и зрительной памятью.
После курса лечения врач и больной выносили субъективную заключительную оценку эффективности лечения в соответствии с представленной в протоколе исследования 5-ступенчатой шкалой. Больных, оценивших результаты терапии как “отлично”, было 7 %. Доля оценок “хорошо” и “удовлетворительно” составила 17, 9 и 44,8 %.
Результаты исследования показали, что у больных ДЭ II изменения параметров ПОЛ до начала лечения
Милдронатом касались увеличения способности липопротеиновых структур к окислению, повышения
радикалообразования и снижения резистентности ЛП к окислению. Лечение Милдронатом в течение 20 дней приводило к увеличению длительности латентного периода ХЛ (τ), отражающего резистентность ЛП к ПОЛ. После курса лечения у больных, получавших Милдронат, также произошло статистически значимое снижение уровня гидроперекисей липидов
(табл. 11).
Таблица 11. Влияние Милдроната на параметры Fe2+-индуцированной ХЛ ЛП сыворотки у больных ДЭ II.
Исходя из результатов настоящего исследования, стабилизация липопротеиновых компонентов крови к ПОЛ, проявившаяся увеличением их антиоксидантного статуса под влиянием Милдроната, может быть объяснена антиоксидантными свойствами этого препарата. Возможно, для достижения большего терапевтического эффекта следует в дальнейших исследованиях увеличивать суточную дозу Милдроната.
Таким образом, лечение Милдронатом (500 мг ежедневно) повышало резистентность ЛП сыворотки крови пациентов к ПОЛ, что свидетельствует о способности препарата обеспечивать антиоксидантную
защиту ЛП.
Анализируя результаты лечения больных, можно констатировать, что отличные, хорошие и удовлетворительные результаты лечения наблюдались у 69,7 % случаев у больных ДЭ II. Наиболее благоприятный эффект отмечен у пациентов с неустойчивостью настроения, нарушениями эмоционально-волевой сферы, памяти и концентрации внимания, т. е. в тех случаях, когда имело место диффузное снижение корковой активности. У этих больных под влиянием лечения уменьшалась лабильность эмоционально-волевой сферы, исчезала тревожность, заметно преобладала положительная окраска эмоциональных переживаний, улучшались способность концентрации внимания и память, пациенты становились активнее. Довольно хороший эффект наблюдался и у больных с головной болью, которая к концу лечения резко уменьшалась по интенсивности и частоте возникновения.
В ходе исследования было установлено, что у больных с последствиями НМК Милдронат оказывает положительное влияние в основном на общее состояние больных и значительно меньшее – на очаговые неврологические симптомы. У пациентов с нарушениями корковых функций за счет очаговых выпадений (афазия, алексия, аграфия, акалькулия, агнозия) эффективность Милдроната была ниже, чем при симптомах диффузного коркового поражения. У них улучшался прежде всего нейродинамический фон: повышалась концентрация внимания, его устойчивость, способность к переключениям, уменьшалась истощаемость. Степень восстановления нарушенных очаговых корковых функций в значительной мере определялась тяжестью поражения. Существенно меньший эффект наблюдался при лечении Милдронатом больных с выраженными двигательными нарушениями.
В этих случаях значительного улучшения двигательных функций не наблюдалось. Однако можно было
отметить ускорение восстановления нарушенных двигательных функций. Умеренное или небольшое улучшение двигательных функций наблюдалось у 9 больных с постинсультными гемипарезами и выражалось в основном в улучшении функции ходьбы, навыков самообслуживания и увеличении общей двигательной активности. Применение Милдроната привело их, по-видимому, к мобилизации скрытых
ранее возможностей. В 5 наблюдениях на фоне лечения Милдронатом отмечено уменьшение степени выраженности тремора статического напряжения, а у 2 пациентов в период лечения уменьшилась ригидность мышц и замедленность движений.
При объяснении результатов лечения больных с органическими симптомами поражения мозга мы принимали во внимание тот факт, что степень восстановления нарушенных функций
зависит не только от давности НМК и величины очаговых изменений, но и от их локализации. Так, концентрация двигательных путей в колене внутренней капсулы определяет плохой прогноз для обратного развития симптомов при локализации очага в этой области. Напротив, сложность организации мнестических функций, складывающихся из координированной работы многих участков мозга, дает надежду на успех при нарушении какого-то одного звена в сложной цепи связей за счет мобилизации и компенсаторной деятельности других звеньев системы под влиянием проводимого
лечения.
Известно, что для осуществления любого вида психической деятельности необходим ряд факторов: определенный оптимальный тонус коры, сила корковых процессов (т. е. их концентрированность, уравновешенность, подвижность); сохранность первичных и ассоциативных корковых зон; регуляция и контроль сознательной деятельности.
Следует отметить, что положительные результаты лечения Милдронатом больных с хроническими НМК в определенной степени следует объяснять повышением целеустремленности, собранности пациентов, уменьшением их истощаемости, улучшением внимания и памяти.
У 9 больных с последствиями НМК наблюдались двигательные нарушения в сочетании с астено-депрессивным или астеническим синдромом. Для этой группы пациентов было характерно сочетание пониженного фона настроения со снижением уровня активности, развивающегося на фоне повышенной утомляемости, истощаемости, неспособности к длительному психическому и физическому напряжению. У многих больных наряду с астенией и депрессией отмечено наличие ипохондрических
реакций. Улучшение общего состояния на фоне лечения Милдронатом отмечено у всех больных: у 8 пациентов улучшение было значительным. Оно выражалось в том, что больные в процессе лечения Милдронатом становились активнее, более собранными, у них исчезала тревожность, подавленность настроения, повышался общий фон настроения, нарастала скорость реакций, улучшалось внимание, его устойчивость и переключаемость, уменьшалась аспонтанность.
Результаты клинико-биохимического исследования, представленные в данной работе, указывают на значимость свободнорадикальных процессов липидного окисления в патогенезе НМК. В условиях окислительного стресса, когда антиоксидантная система мозга не способна осуществлять полноценную защиту от свободнорадикальной атаки, становится очевидной необходимость усиления антиоксидантной защиты, которая может быть опосредована природными или нетоксичными синтетическими антиоксидантами.
Таким образом, применение Милдроната способствует компенсации имеющихся у больных ДЭ проявлений дисфункции мозга, восстановлению физической и психической активности. На более поздних этапах заболевания при наличии очаговых изменений мозга антиоксидантный эффект Милдроната оказывает положительное влияние на степень и темп восстановления нарушенных функций и особенно бытовых навыков.
Заключение
Милдронат в дозе 1000 мг (10 мл 10 %-ного раствора), вводимый внутривеннов капельно в течение 20 дней, оказывает статистически значимое влияние на тяжесть неврологических нарушений у больных ИИ в остром периоде его развития, уменьшая ее.
Биохимической основой терапевтического действия Милдроната является его антиоксидантная активность: Милдронат существенно уменьшает окислительное повреждение липопротеиновых структур, восстанавливает активность эндогенной антиоксидантной системы.
Методом ОФЭКТ для больных ИИ в остром периоде его развития на фоне лечения Милдронатом установлено повышение церебральной перфузии в областях ее снижения, соответствующих инфарктам мозга, по данным МРТ.
Парентеральный прием Милдроната в суточной дозе 1000 мг в раннем восстановительном периоде ИИ способствует повышению общей активности, внимания; у больных увеличивается темп выполнения заданий, переключаемость, улучшается память. Эти функции восстанавливаются, очевидно, в связи с общим улучшением нейродинамического фона. Меньшей динамике в этот период подвергаются очаговые неврологические нарушения, обусловленные ишемией мозга, хотя в ряде случаев восстановление утраченных функций было достаточно заметным и значительным. В первую очередь это касается двигательных нарушений, дизартрии и моторной афазии. Данные нейропсихологического
исследования также свидетельствуют об улучшении когнитивных функций, а именно оперативной памяти и внимания.
Для большинства больных ДЭ II произошло улучшение со стороны как субъективной, так и объективной
неврологической симптоматики, причем наиболее четкую динамику претерпели такие синдромы заболевания, как кохлео-вестибулярный, астеноневротический и цефалгический.
Выявлено положительное влияние Милдроната на когнитивные функции больных ДЭ II по данным нейропсихо-логического исследования, что позволяет говорить о нейротрофическом действии препарата.
Препарат Милдронат может быть рекомендован к применению в комплексной терапии больных острыми и хроническими НМК.


