Когда мы говорим об эффективности таргетной адъювантной терапии (АТ) рака молочной железы (РМЖ), речь может пока идти только о трастузумабе (Герцептине) как о единственном препарате, применение которого оценено в долгосрочной перспективе (в среднем через 8 лет от начала первичного лечения).
Трастузумаб представляет собой моноклональное антитело против рецептора человеческого эпидермального фактора роста-2 (HER2), амплифицированного или сверхэкспрессированного среди 15–20 % больных РМЖ [1–5]. HER2-позитивные опухоли более агрессивны и склонны к рецидивированию по сравнению с HER2-негативными [5, 6].
При метастатических опухолях трастузумаб оказался полезным как в монотерапии, так и особенно в комбинации с химиотерапией (ХТ) как в первой, так и во второй линии терапии [7–12]. Достоверная клиническая польза трастузумаба также наблюдается при лечении ранних (операбельных) стадий РМЖ.
В четырех крупных клинических исследованиях адъювантного применения трастузумаба продемонстрировано достоверное повышение трехлетней безрецидивной выживаемости (БРВ;
за счет сокращения частоты рецидивов заболевания на 36–52 %) и улучшение показателей общей выживаемости (за счет сокращения числа смертельных исходов на 35–41 %), безотносительно размера опухоли, состояния регионарных лимфатических узлов, гормонально-рецепторного статуса и возраста больных [13–17]. На основании этих данных АТ трастузумабом стало фундаментом в системном лечении раннего РМЖ.
Сегодня, когда мы располагаем многолетними результатами терапии трастузумабом уже в 6 клинических испытаниях (HERA, NCCTG N9831, NSABP B-31, BCIRG-006, Fin HER, PHARE), уместно рассмотреть 4 аспекта адъювантной антиHER2-терапии:
• достижимо ли увеличение безрецидивной и общей выживаемости при добавлении анти-HER2-терапии к адъювантной ХТ;
• какова оптимальная продолжительность терапии трастузумабом;
• предпочтительная комбинация анти-HER2-терапии: одновременно с ХТ или последовательно (после
завершения адъювантной или неоадъювантной терапии);
• допустим ли во всех случаях отказ от включения в схему ХТ антрациклинов из-за потенциального токсического эффекта обоих препаратов накардиомиоциты?
Сводные данные крупных клинических исследований адъювантного одногодичного применения трастузумаба представлены в табл. 1.
Таблица 1. Исследования АТ трастузумабом в течение одного года.
Объединенный анализ данных исследований N9831 и В-31 показал, что уже по итогам 4-летнего наблюдения добавление трастузумаба к адъювантной ХТ улучшает как БРВ, так и общую выживаемость (ОВ) по сравнению с одной ХТ. Ко времени первого анализа (период наблюдения – 2,0–2,9 года) сокращение частоты рецидивирования достигало 52 % (отношение шансов [ОШ] –0,48; р < 0,001), уменьшение смертности – 35 % (ОШ – 0,65; р < 0,001). При увеличении периода наблюдения относительное сокращение частоты рецидивирования по-прежнему было высоким (48 %; р < 0,001), а относительное сокращение смертности достигало 39 % (р < 0,001). Таким образом, эти данные демонстрируют продолжающуюся долгосрочную пользу от применения трастузумаба совместно с ХТ (АС × 4, паклитаксел × 12 + трастузумаб × 52 недели). Абсолютное отличие показателей БРВ увеличивалось при нарастании числа пораженных лимфоузлов;оно оказалось особенно выраженным
среди больных с метастатическим поражением ≥ 10 лимфоузлов, достигнув беспрецедентного абсолютного улучшения на 45 %.
Как следует из табл. 1, и в остальных крупных исследованиях (HERA, BCIRG-006), включивших 8324 пациента, применение трастузумаба в течение года после завершения ХТ или одновременно с адъювантной ХТ значительно улучшало отдаленные результаты лечения больных ранними стадиями HER2-позитивного РМЖ (pN+, pN0, размер > 1 см), сокращая частоту рецидивирования на 24–39 % и
риск смерти от РМЖ на 24–41 %. Вопрос о продолжительности адъювантной анти-HER2-терапии – едва ли не главный при принятии стандартов лечения раннего (операбельного) HER2-позитивного РМЖ. В 2012 г. на конгрессе ESMO в Вене (октябрь) и Международной конференции по РМЖ в Сан-Антонио (декабрь) представлены давно ожидаемые результаты исследований HERA и PHARE
(Франция).
Исследование HERА, в котором принимали активное участие онкологические центры Москвы (М.Р. Личиницер), Казани (Р.Ш. Хасанов),
Санкт-Петербурга, является главным и единственным испытанием, сравнивавшим двухлетнее адъювантное лечение трастузумабом с однолетним. При среднем периоде наблюдения (8 лет) проект HERA подтвердил, как и прежде (через 2 и 4 года наблюдения), достоверное снижение риска рецидива заболевания и улучшение показателей ОВ на 24 % при одногодичном лечении трастузумабом, несмотря на значительный (52 %) переход (cross over) больных из группы наблюдения в группу трастузумаба в 2005 г. (после публикации первых результатов).
Анализ полученных данных не выявил дополнительной пользы при двухлетнем лечении трастузумабом
по сравнению с одногодичным, когда препарат назначался последовательно после ХТ. Отмечено лишь кратковременное (в первые 3–4 года) улучшение БРВ (абсолютное отличие – 2–4 %) в группе больных негативными по эстрогенному рецептору опухолями при двухлетнем лечении трастузумабом (что свидетельствует о необходимости дальнейшего детального анализа результатов в зависимости от рецепторного статуса).
Местно-регионарные рецидивы были выявлены среди 5 % больных, получавших трастузумаб в тече-
ние года, и среди 5,1 % пациентов, получавших препарат в течение 2 лет, отдаленные метастазы – среди 14,4 и 13,4 % больных соответственно (p > 0,5; табл. 2).
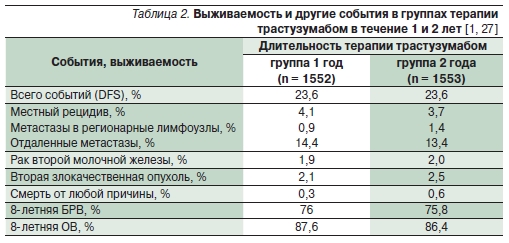
Частота кардиотоксичности и снижения фракции выброса левого желудочка была очевидно выше среди больных, получавших трастузумаб 2 года (8,2 против 4,9 %) [1, 27].
Провокационные результаты небольшого испытания FinHER (менее 300 больных), одной из главных целей которого было определение эффективности 9-недельного лечения трастузумабом (при этом непосредственного сравнения 9-недельного назначения трастузумаба и стандартной терапии в течение года не проводилось), подтолкнули французских исследователей на проведение испытания PHARE [26]. Французский Национальный институт рака инициировал в 2005 г. исследование, сравнивавшее 6-месячную АТ трастузумабом со стандартным 12-месячным АТ. В исследование вошли 3383 больных HER2-позитивным ранним РМЖ, завершивших адъювантную или неоадъювантную (по крайней мере 4 цикла) ХТ. Число событий, включая отдаленные метастазы, оказалось выше в группе больных, получавших короткую (6 месяцев) терапию трастузумабом (13,0 против 10,4 %).
Таким образом, даже при короткой (9 недель) или относительно короткой (26 недель) АТ трастузумабом отмечается повышение БРВ [26]. Однако наиболее существенное улучшение показателей БРВ и ОВ (на 24–52 %) и снижение риска смерти от РМЖ (на 35 %) отмечено во всех крупных рандомизированных исследованиях при адъювантном применении трастузумаба в течение 52 недель (одного года). Как показал проект HERA, продолжение АТ трастузумабом свыше 52 недель (до
2 лет) не добавляет пользы в отношении выживаемости, увеличивая риск кардиологических осложнений (снижение фракции выброса левого желудочка ≥ 10 % и т. д.) почти в 2 раза
(с 4,9 до 8,2 %). Поэтому стандартом АТ больных ранним (операбельным) HER2-позитивным РМЖ должно быть применение трастузумаба в течение года – одновременно или последовательно с ХТ.
В исследовании BCIRG 006 авторы также оценивали эффект вторичных генетических изменений в пределах HER2-ампликона на чувствительность к антрациклинам. В частности, анализ гена, кодирующего альфа-II топоизомеразу (ТОР2А), показал наличие его коамплификации среди 35 % больных HER2-позитивным РМЖ [25].
Оказалось, что при наличии коамплификации ТОР2А показатели 5-летней БРВ у больных, получавших
трастузумабсодержащие режимы ХТ, не отличались от таковых при применении стандартного антрациклин/таксансодержащего режима АС→Т (без трастузумаба) (82–85 %).
Почти во все рекомендации по АТ включаются антрациклины, что соответствует результатам Оксфордского мета-анализа группы EBCTCG, показавшего превосходство антракциклинсодержащих режимов над режимами без антрациклинов (типа СMF) в отношении эффективности. Однако после-
дующий анализ HER2-статуса 5200 больных, участвовавших в испытаниях антрациклинсодержащих режимов ХТ, показал, что только женщины с HER2-позитивным РМЖ получили пользу от антрациклинов (35–39 %). Не отмечено заметной пользы от применения антрациклинов для 75–80 % больных с HER2-негативным РМЖ [25]. Метаанализ этих и дополнительных данных уже опубликован.
Детальный анализ TOP2A гена в исследовании BCIRG 006 показал, чтоего коамплификация напрямую ассоциируется с превосходством антрациклинов над неатрациклиновыми режимами при HER2-позитивном РМЖ [25].
Время подключения трастузумаба одновременно с адъювантной ХТ или последовательно (после завершения ХТ) предполагалось оценить в проекте NCCTC N9831, в котором в группе В трастузумаб назначался после завершения адъювантной ХТ, а в группе С – одновременно с ней. Однако из-за
пересмотра проекта N9831 в 2002 г. и значительного перехода больных (330 человек) из контрольной группы в группу трастузумаба (2005) оценить значение времени подключения трастузумаба при прямом сравнении пока не удалось.
Зато имеется достаточный материал для непрямого сравнения. Известно, что в проекте HERA (n = 5102) 3404 пациента получали трастузумаб последовательно после завершения адъювантной или неоадъювантной ХТ. Сокращение риска рецидива заболевания при применении трастузумаба
после завершения ХТ равнялось 24 % (при среднем периоде наблюдения 4 года или 8 лет). В остальных крупных проектах с одновременным применением адъювантного трастузумаба и ХТ (BCIRG 006, NSABP B-31) сокращение риска рецидива достигало 36–52 % при среднем периоде наблюдения 4–5 лет.
При этом частота кардиологических осложнений III–IV степеней, особенно при режимах, включавших антрациклины, была выше при одновременной терапии (3,8 против 0,9 %).
Таким образом, одновременное начало адъювантной ХТ и применения трастузумаба улучшает БРВ и ОВ в большей степени, чем последовательное применение анти-HER2-таргетной терапии, увеличивая, однако, риск кардиологических осложнений.
Анализ общих данных показал благоприятное терапевтическое соотношение “польза–токсичность” конкурентной (одновременной) адъювантной схемы АС → паклитаксел + трастузумаб [13, 14, 18–22]. Даже после прекращения АТ трастузумабом в этой группе реже встречались местные и
отдаленные рецидивы заболевания.
В относительно небольшом неоадъювантном исследовании NOAH добавление трастузумаба к ХТ значительно увеличило частоту полного патоморфологического регресса опухоли (рСR) – с
22 до 43 %, улучшив показатели БРВ. Лишь у 2 % больных отмечены признаки сердечной недостаточности [23].
Несмотря на одновременное применение доксорубицина, паклитаксела и трастузумаба в исследовании
NOAH, клинически значимая кардиотоксичность развивалась реже (< 2 %), чем в адъювантных исследованиях (3,3–4,1%), когда трастузумаб назначался в комбинации с паклитакселом по завершении терапии доксорубицином [18, 19]. Эти находки подтверждают следующий вывод:
трастузумаб может использоваться в комбинации с антрациклинами с приемлемой кардиотоксичностью при условии низкой кумулятивной дозы, применения менее кардиотоксичных антрациклинов и тщательного наблюдения.
Лечение больных HER2-позитивным РМЖ тщательно обсуждалось на 13-й конференции по РМЖ в Сан-Галлене (13–16 марта 2013 г.) [28–30]. Среди экспертов 72,5 % поддержали минимальный размер HER2+ опухоли 5 мм для назначения трастузумаба. Все эксперты согласились с тем, что предпочтительная продолжительность адъювантной терапии – 12 месяцев. Подавляющее большинство (93,2 %) экспертов проголосовали за включение таксанов в комбинации с трастузумабом и 68 % – за включение также антрациклинов при лечении HER2-позитивного РМЖ. Дана положительная оценка трастузумаба для подкожного введения, значительно сокращающего время процедуры, хорошо воспринимаемого пациентами.
Заключение
Таргетная терапия с помощью гуманизированного моноклонального антитела стала основой лечения больных HER2-позитивным РМЖ. Механизмы действия трастузумаба при этом не вполне ясны. На доклиническом этапе определено минимум 5 внеклеточных и внутриклеточных механизмов противоопухолевой активности препарата:активация антителозависимой клеточной цитотоксичности, блокада участка внеклеточного домена, нарушение внутриклеточной передачи сигнала,
снижение активности ангиогенеза, замедление процессов восстановления поврежденной ДНК. Эти эффекты приводят к остановке клеточного цикла и/или гибели клетки. Преимущества терапии, содержащей трастузумаб, уже были продемонстрированы как при раннем (операбельном), так и при распространенном РМЖ. Различные подходы к таргетному воздействию как на HER2, так и на другие сигнальные пути могут усилить клинический эффект,наблюдаемый при применении трастузумаба, и преодолеть возможную резистентность. Новые комбинации включают пертузумаб (блокатор димеризации HER2), лапатиниб (ингибитор тирозинкиназы HER1/HER2), бева-цизумаб (антиангиогенный препарат), танеспимицин (ингибитор белка теплового шока), антиэстрогенную терапию, конъюгаты антител и химиотерапевтического средства (трастузумаб-DM1). Множество адъювантных комбинаций ХТ с трастузумабом в настоящее время уже оценено, что позволяет
врачу выбрать режим, наиболее подходящий пациентам с ранним инвазивным HER2-позитивным РМЖ.
Оценивая результаты важнейших клинических исследований АТ трастузумабом более 12 тыс. больных
ранним HER2-позитивным РМЖ, можно сделать 4 основных вывода: АТ трастузумабом в течение 52 недель (1 года) одновременно или последовательно с ХТ является наиболее обоснованным стандартом лечения больных ранним (операбельным) HER2-позитивным РМЖ:
1. Сокращение продолжительности лечения до 9 (FinHER) или 26 недель (PHARE) снижает эффект таргетного лечения. Но и увеличение длительности терапии трастузумабом свыше 52 недель (до 2 лет, как в проекте HERА) не увеличивает выживаемость, повышая риск кардиотоксичности в 2 раза.
2. Одновременное (конкурентное) начало адъювантной ХТ и антиHER2-терапии трастузумабом
улучшает безрецидивную и общую выживаемость в большей степени, чем последовательное применение трастузумаба после завершения ХТ, несколько увеличивая риск кардиологических осложнений.
3. Замена в режимах АТ HER2- позитивного РМЖ антрациклинов на карбоплатин (проект BCIRG 006)
снизило частоту кардиологических осложнений с 2 до 0,4 %. При этом, однако, в “безантрациклиновой” группе нарастали число больных с рецидивом заболевания и риск
смертельных исходов по сравнению с группой, получавшей антрациклины (АС→ТН). Мета-анализ всех
рандомизированных исследований трастузумаба показывает, что он может использоваться в комбинации с антрациклинами с приемлемой кардиотоксичностью при условии низкой кумулятивной дозы, применения менее кардиотоксичных антрациклинов, особенно больными HER2-позитивным РМЖ с коамплификацией гена ТОР2А.
4. После оценки большинства исследований создается впечатление, будто режим, содержащий антрациклины и таксаны с дополнением трастузумаба (АС→ТН), остается наиболее оптимальной схемой адъювантного (послеоперационного) лечения HER2-позитивного РМЖ.


