С тех пор как существует цивилизация, люди употребляют алкоголь. Молекулы этилового спирта, содержащие всего два атома углерода, имеют простое строение и легко проникают в ткани организма человека. Умеренное употребление алкоголя многим людям доставляет удовольствие, не вызывая при этом серьезных последствий. Однако длительное употребление его в больших количествах может приводить к поражению различных органов, в т. ч. поджелудочной железы (ПЖ), печени, головного мозга, сердца, почек.
В настоящее время в развитых странах большинство случаев заболеваемости и преждевременной смерти обусловлено семью основными факторами риска: артериальной гипертензией, гиперхолестеринемией, табакокурением, избыточной массой тела и ожирением, злоупотреблением алкоголем, недостаточным потреблением овощей и фруктов, низкой физической активностью.
Установлено также значительное повышение вероятности возникновения неинфекционных заболеваний при комбинированном воздействии факторов риска. Так, если курение повышает вероятность развития онкологического заболевания в 1,5 раза, а злоупотребление алкоголем – в 1,2, то сочетанное воздействие этих факторов –в 5,7 раза [1].
По данным Всемирной организации здравоохранения, в России в 2002 г. преобладали четыре основных фактора риска: высокое артериальное давление, высокий уровень холестерина, чрезмерное употребление алкоголя и табакокурение. В настоящее время подобная ситуация не изменилась. Указанные факторы обусловливают 87,5 % случаев смерти в стране.
На первом месте по влиянию на число лет жизни с утратой трудоспособности стоит злоупотребление алкоголем (16,5 %). Самый большой в мире разрыв ожидаемой продолжительности жизни между мужчинами и женщинами (13 лет) в России связан в первую очередь с более частым (в 6 раз) употреблением алкоголя мужчинами, нежели женщинами, и большей распространенностью (в 2 раза)
табакокурения среди мужского населения. По мнению экспертов, к 2020 г. эти показатели существенно вырастут [2].
Одним из заболеваний, вызываемых чрезмерным употреблением алкоголя, является хронический панкреатит (ХП). После того как более 100 лет назад Friederich описал “ПЖ пьяницы”, стало ясно, что злоупотребление алкоголем ведет к развитию этой патологии.
Хронический панкреатит отличается сложностью этиологии и патогенеза. Особенности клинического течения этого заболевания обусловлены большим разнообразием причин его возникновения.
К основным этиологическим факторам развития панкреатита различные авторы относят:
• употребление алкоголя (более 80 мл/сут в пересчете на чистый этанол), что чаще встречается среди мужчин;
• поражение различных органов, анатомически и физиологически связанных с ПЖ (билиарный тракт, желудок и двенадцатиперстная кишка, чревный ствол и его ветви, питающие ПЖ);
• нарушения питания, воздействие различных лекарственных препаратов и химических веществ, ведущих к повреждению ПЖ;
• генетическую предрасположенность к развитию панкреатита; аутоиммунные механизмы;
• травму ПЖ;
• аллергические и метаболические расстройства;
• семейную гиперлипидемию;
• белковую дистрофию;
• паратиреоидную аденому.
Ведущим этиологическим фактором развития ХП в 40–80 % случаев остается злоупотребление алкоголем. Один из первых случаев алкогольного пан-креатита был описан в 1788 г. Cawley, который наблюдал молодого, “беспечно живущего” мужчину, погибшего от сахарного диабета и истощения. На
вскрытии в ПЖ были выявлены многочисленные камни [3].
Имеются данные о том, что опасными дозами в отношении развития этого заболевания является употребление чистого этанола 80–160 мл/сут и очень опасными – свыше 160 мл/сут [4].
Для развития алкогольного панкреатита абсолютное количество принятого алкоголя не является решающим, как и вид напитка. Первая рюмка может оказаться вполне значимой. Однако необходимо учитывать и другой факт: не всегда присутствует абсолютная связь между приемом спиртного и развитием панкреатита. Так, только у 10 % лиц, злоупотребляющих алкоголем, отмечены выраженные клинические проявления хронического алкогольного панкреатита (ХАП), тогда как у трети пациентов
доминируют проявления алкогольного поражения печени [5]. При этом острый алкогольный панкреатит не всегда переходит в кальцифицирующий вариант ХАП. Следовательно, частота заболеваемости алкогольным панкреатитом в большинстве случаев может зависеть от генетической предрасположенности к развитию данного заболевания [3].
При аутопсии ПЖ выявляются характерные морфологические изменения, которые редко встречаются среди людей, не употребляющих алкоголь. Более чем у 50 % лиц, страдающих алкоголизмом, наблюдаются нарушения экзокринной функции ПЖ.
Этанол обладает рядом панкреотоксических эффектов. Прежде всего он вызывает спазм сфинктера Одди и тем самым приводит к повышению давления в протоковой системе ПЖ. Пероральный прием алкоголя усиливает стимулированную желудочную секрецию, тем самым увеличивая ацидификацию содержимого двенадцатиперстной кишки. В то же время под влиянием алкоголя изменяется качественный состав панкреатического сока, в котором содержится избыточное количество белка и имеется низкая концентрация бикарбонатов. В связи с этим создаются условия для выпадения белковых преципитатов в виде пробок, которые обтурируют панкреатические протоки, а в ряде случаев кальцифицируются, усугубляя имеющуюся гипертензию. Повышение давления в протоках может приводить к разрыву мелких протоков, выходу ферментов в паренхиму и аутолизу железы. В патогенезе ХАП особое место занимает включение механизма апоптоза, из-за чего замедляется ограничение очага аутолиза при панкреатических атаках. Кроме того, предполагается, что в панкреатическом секрете у людей, злоупотребляющих алкоголем, повышено соотношение трипсиногена к ингибитору трипсина, что предрасполагает к внутрипротоковой активации ферментов. Кроме этанола токсическим действием обладает и его метаболит – ацетальдегид (активация перекисного окисления липидов мембран, оксидативный стресс). Клинически значимым
представляется параллельно происходящее под влиянием этанола увеличение продукции гастрина и холецистокинина, фиброза мелких сосудов с нарушением микроциркуляции [2, 6].
Особенно пристальное внимание привлекает эта проблема ввиду того, что чрезмерное употребление алкоголя связано с повышением риска развития рака ПЖ, этот риск еще больше возрастает при увеличении массы тела пациента [3, 7].
Риск развития алкогольного панкреатита становится выше при наличии дополнительного фактора – курения. Важно отметить, что такая привычная интоксикация, как курение, в сочетании с приемом спиртных напитков обусловливает выраженное суммарное влияние на развитие и течение ХАП. В опытах на крысах, описанных C.S. Pitchumoni [8], показано, что при алкогольном панкреатите сигаретный дым усиливает нарушения капиллярной перфузии в ПЖ, вызванные этанолом. В этом случае панкреатит развивается в более раннем возрасте. По данным различных исследований, никотин активирует множество разных путей внутриклеточной передачи сигнала, приводя к повышению уровня кальция в цитоплазме, что может вызывать повреждение и гибель клеток. Wittel и соавт. [9] доказано, что табачный дым приводит к развитию хронического воспаления в ПЖ с последующим фиброзом и рубцовыми изменениями в ацинусах, повышению экспрессии генов панкреатитассоциированного белка 1 (который в норме не экспрессируется ацинозными клетками), трипсиногена и химотрипсиногена. В исследованиях на животных Chowdhury и Walker показали, что под действием никотина ацинозные клетки начинают вырабатывать активные формы кислорода,
вызывающие патологические изменения в ПЖ с повреждением ее тканей [10]. Исследование, проведенное группой Университета Питтсбурга, позволяет рассматривать курение как причину, повышающую риск развития ХП примерно на 25 % (атрибутивный риск). Эти данные очень важны, т. к. злоупотребление алкоголем и курение являются серьезными, но устранимыми факторами риска развития ХП [11].
Известно, что темпы прогрессирования ХАП пропорциональны употреблению алкоголя и ассоциированы с продолжением курения. В последние годы стало известно, что панкреатиты у курящих наблюдаются в два раза чаще по сравнению с некурящими субъектами и риск развития заболевания растет в зависимости от числа выкуренных сигарет. Курение сигарет приводит к истощению запасов витаминов С и А, а также снижает сывороточный уровень других антиоксидантов, что обусловливает повреждение ткани железы свободными радикалами [3, 6]. Существуют данные о снижении активности ингибитора трипсина у курильщиков, что повышает риск внутрипротоковой активации ферментов. Что особенно важно: компоненты табачного дыма увеличивают секрецию желудка и снижают панкреатическую секрецию бикарбонатов, это приводит к повышению вязкости
панкреатического сока и снижению pH в двенадцатиперстной кишке. В таких условиях также возможны преципитация белка с закупоркой просветов протоков ПЖ белковыми пробками с развитием локальной панкреатической гипертензии, увеличение стимулирующего влияния гастроинтестинальных пептидов на экзокринную панкреатическую секрецию [3, 11].
В связи со сложностью выявления ведущего этиологического фактора, определяющего особенности патогенеза выраженным полиморфизмом клинических проявлений ХП, его лечение представляется одним из важных аспектов современной гастроэнтерологии. Постепенное развитие необратимых фиброзных и атрофических изменений в ПЖ приводит к ее функциональной недостаточности или стойкому болевому синдрому, устранить которые проблематично даже при проведении оптимальной терапии. В основе успешного лечения ХАП лежат полное исключение ведущего этиологического фактора, а также терапия сопутствующих заболеваний органов пищеварения, усугубляющих тяжесть течения заболевания [11].
Основные принципы консервативного лечения ХП:
• Купирование болевого синдрома и предотвращение развития отечноинтерстициальной стадии заболевания во избежание хирургических осложнений.
• Коррекция экзо- и эндокринной недостаточности ПЖ.
• Создание функционального покоя органа.
• Предотвращение рецидивов заболевания при сохраняющемся этиологическом факторе [12].
В стандарты терапии ХП входят:
• исключение табакокурения и приема алкогольных напитков;
• соблюдение диеты с повышенным содержанием белка;
• заместительная терапия ферментными препаратами с высоким содержанием протеаз и липазы;
• назначение препаратов, блокирующих желудочную секрецию;
• применение при необходимости ненаркотических, а в ряде случаев наркотических анальгетиков;
• назначение спазмолитиков и нейролептиков;
• антибактериальные препараты для борьбы с избыточным бактериальным ростом в тонкой кишке, который является одной из причин относительной внешнесекреторной недостаточности ПЖ и ведет к прогрессированию мальдигестии и мальабсорбции. Лечение внешнесекреторной недостаточности ПЖ при ХП относится к первостепенным задачам. С этой целью успешно используют ферментные препараты панкреатина в виде микротаблеток или минимикросфер, имеющих энтеросолюбильную оболочку. Эти лекарственные формы панкреатина наиболее удачны для эффективной заместительной терапии, обеспечивают высокую активность липазы в дуоденальном содержимом и позволяют проводить контроль адекватности и эффективности лечения. В современной гастроэнтерологии существуют определенные требования к ферментным препаратам и их дозировкам при различных патологических состояниях.
Так, Американская Ассоциация гастроэнтерологов в качестве заместительной терапии при панкреатитах предлагает использовать следующие препараты:
• 500–2500 ЕД липазы /кг массы тела на один прием пищи;
• или не менее 10 тыс. ЕД липазы/кг массы тела в сутки;
• или 4000 ЕД липазы/г жира в рационе.
В отсутствие положительного эффекта лечения стратегия терапии может варьироваться: возможно увеличение дозы препарата (более 2500 ЕД липазы/кг массы тела на каждый прием пищи следует назначать с осторожностью), сокращение квоты жиров в рационе до 50–70 г, контроль приверженности, режима приема лекарства, назначения ингибиторов протонной помпы или Н2-блокаторов, исключение других заболеваний.
В нашей клинической практике с 2008 г. появился препарат Эрмиталь (панкреатин), полученный из ПЖ
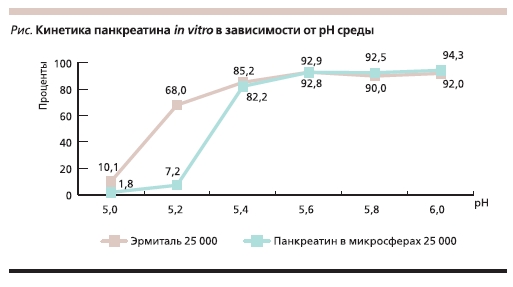
свиньи. Эрмиталь представляет собой капсулу, содержащую микротаблетки. Высвобождение ферментов из них происходит при рН более 5,0 за счет наличия кислотоустойчивой оболочки. Данные о кинетике панкреатина in vitro в зависимости от pH среды представлен на рисунке [15]. В зависимости от дозы липазы существует три формы: Эрмиталь 10 тыс. ЕД, Эрмиталь 25 тыс. ЕД и Эрмиталь 36 тыс. ЕД, что определяет большие возможности использования данного препарата при различных заболеваниях.
Использование микротаблетированного полиферментного препарата Эрмиталь в терапии экзокринной
недостаточности ХП показало явные медико-социальные преимущества перед таблетированным панкреатином. И.В. Маев и соавт. [14] убедительно продемонстрировали этот факт в результате
проведения фармако-экономического анализа с помощью методов “показатель стоимости болезни”, “затраты/эффективность”. Микротаблетированный панкреатин снижает стоимость болезни в 1,3 раза по сравнению с таблетированным.
Эрмиталь показал свои эффективность и безопасность при заместительной терапии ХП [12, 13]. Кроме того, препарат обладает хорошим противоболевым эффектом за счет высокого содержания протеаз, что может приводить к подавлению панкреатической секреции по принципу обратной связи. В исследованиях А.В. Охлобыстина [15] показана высокая эффективность капсулированной формы панкреатина (Эрмиталя) в купировании боли у пациентов с ХП.
Таким образом, микротаблетированный препарат Эрмиталь является удачным добавлением к арсеналу современных полиферментных лекарственных средств, используемых в стандартах консервативного лечения ХП.



