Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – одна из ведущих причин заболеваемости и смертности во всем мире [1]. ХОБЛ – заболевание, характеризующееся ограничением воздушного потока с развитием неполностью обратимой бронхиальной обструкции; ограничение воздушного потока прогрессирует и связано с усиленным патологическим воспалительным ответом дыхательных путей на повреждающие частицы или газы [2, 3]. По данным ряда недавно выполненных исследований, распространенность ХОБЛ в мире среди людей старше 40 лет составляет 10,1 % (11,8 % среди мужчин и 8,5 % среди женщин) [4]. Сегодня ХОБЛ представляет собой значительную экономическую и социальную проблему, является единственной болезнью, от которой смертность продолжает увеличиваться [5, 6].
Развитие обострений заболевания – характерная черта течения ХОБЛ, частота обострений прогрессивно увеличивается с нарастанием тяжести заболевания [2]. Обострение ХОБЛ является одной из самых частых причин обращения больных за неотложной медицинской помощью [7]. Частое развитие обострений у больных ХОБЛ приводит к более быстрому прогрессированию заболевания [8], значимому снижению качества жизни больных [9] и сопряжено с существенными экономическими расходами на лечение [7]. Более того, тяжелое обострение заболевания, приводящее к острой дыхательной недостаточности, остается основной причиной смерти больных ХОБЛ [10].
Воспаление дыхательных путей при ХОБЛ
Главным патофизиологическим нарушением у больных ХОБЛ является экспираторное ограничение воздушного потока. В его основе лежат как обратимые (сокращение гладкой мускулатуры бронхов; накопление воспалительных клеток, слизи и экссудата плазмы в просвете бронхов), так и необратимые компоненты (фиброз и сужение бронхов; разрушение альвеолярной поддержки просвета малых дыхательных путей) [11, 12].
Курение и другие ингаляционные ирританты инициируют развитие воспалительного ответа в дыхательных путях и легочной паренхиме. Воспаление у пациентов ХОБЛ по составу клеточных элементов, медиаторов и протеаз очень похоже на воспаление у “здоровых” курильщиков, но более выраженно [11, 12]. Поэтому полагают, что воспаление при ХОБЛ представляет собой усиленный хронический воспалительный ответ на ирританты (в первую очередь табачный дым) [13]. Механизм такого усиления, или амплификации, пока остается до конца не изученным, он может детерминироваться генетическими факторами [14], латентными вирусными инфекциями [15, 16] и нарушением активности деацетилазы гистонов [17]. Ацетилирование гистонов приводит к активации ядерных гистонов, что в свою очередь усиливает транскрипцию воспалительных генов. Противоположный процесс – деацетилирование гистонов – у пациентов с ХОБЛ серьезно нарушен [17, 18].
Важное место в патогенезе ХОБЛ занимают процессы дисбаланса “протеазы–антипротеазы” и “оксиданты–антиоксиданты”, которые возникают в результате как повышенной продукции протеиназ и оксидантов, так и инактивации или пониженной продукции антипротеиназ и антиоксидантов [13, 14].
При ХОБЛ состав воспалительного инфильтрата в крупных и малых дыхательных путях, а также в легочной паренхиме и стенке легочных сосудов в целом примерно одинаков [13]. Данное воспаление может разрешаться или приводить к фиброзу, протеолизу и ремоделированию. Hogg и соавт. показали, что по мере возрастания тяжести ХОБЛ происходит прогрессирующее утолщение стенки бронха, вызванное аккумуляцией клеток воспаления, а также накопление избытка слизи в просвете бронха [12]. Воспалительный инфильтрат состоит из нейтрофилов, макрофагов и Т-лимфоцитов (CD4+ и CD8+) (рис. 1). При ХОБЛ тяжелой и крайне тяжелой степеней лимфоциты могут быть организованы в фолликулы, что указывает на развитие адаптивного иммунного ответа, вероятно как реакции на колонизацию дыхательных путей микрофлорой.
Макрофаги играют регулирующую роль в воспалении при ХОБЛ путем выброса таких медиаторов, как фактор некроза опухоли-α, интерлейкина-8 (ИЛ-8) и лейкотриена В4 (ЛТ-В4), способствующих нейтрофильному воспалению [19]. Эпителиальные клетки дыхательных путей и альвеол также являются важным источником медиаторов воспаления при ХОБЛ [20]. При обострении у некоторых больных ХОБЛ может также наблюдаться увеличение числа эозинофилов дыхательных путей [21].
Одну из ведущих ролей в воспалении при ХОБЛ играют нейтрофилы. Пока точно не установлено, почему у пациентов с ХОБЛ находят повышенное содержание нейтрофилов в мокроте и жидкости бронхоальвеолярного лаважа [22–26], но их достаточно немного в слизистой оболочке бронхов, по крайней мере в субэпителиальном слое [27, 28]. Возможно, это связано с быстрым транзитом нейтрофилов через дыхательные пути и паренхиму легких. В некоторых исследованиях были выявлены тесные взаимодействия нейтрофилов с поверхностным эпителием и муцин-продуцирующими железами [29, 30]. Интересно, что быстрое снижение показателя объема форсированного выдоха за первую секунду (ОФВ1) у курильщиков ассоциировано с повышенным содержанием нейтрофилов в мокроте [31]. Анализ бронхиальных биопсий и индуцированной мокроты у бывших курильщиков демонстрирует схожий воспалительный процесс, что предполагает персистенцию воспаления даже после прекращения действия ингаляционных ирритантов (курения) [32, 33].
Нейтрофилы секретируют сериновые протеазы, включая нейтрофильную эластазу, катепсин G и протеиназу-3 (рис. 1). Данные ферменты приводят к деструкции альвеолярной стенки, а также являются мощным стимулятором продукции бронхиального секрета [34, 35]. В процесс рекрутирования нейтрофилов в дыхательные пути вовлечен процесс сосудистой адгезии, при этом экспрессия Е-селектина на бронхиальном эндотелии значительно повышена у пациентов с ХОБЛ [36]. Вероятно, факторы хемотаксиса для нейтрофилов, такие как ИЛ-8 и ЛТ-B4, высвобождаются не только из активированных макрофагов, но и из эпителиальных клеток и CD8+-T-лимфоцитов. Повышенное содержание нейтрофилов в мокроте и бронхиальных биопсиях коррелирует с тяжестью ХОБЛ [36].
Традиционные подходы к терапии ХОБЛ
Медикаментозная терапия при ХОБЛ используется для предупреждения и контроля симптомов заболевания, повышения качества жизни больных, уменьшения частоты и тяжести обострений, снижения летальности больных [2, 3]. Спектр лекарственных средств, в настоящее время рекомендованных для длительной поддерживающей терапии ХОБЛ, относительно невелик: коротко- и длительнодействующие (ДД) бронходилататоры, ингаляционные глюкокортикостероиды (ИГКС), комбинированные препараты (ИГКС/ДДБА [длительно действующие β2-агонисты]), антиоксиданты и вакцины [2, 3].
Предпосылками использования ИГКС при ХОБЛ являются данные о доказанной важности воспалительного процесса в прогрессировании заболевания [12]. Несмотря на то что ИГКС – весьма эффективные препараты подавления воспаления дыхательных путей у больных бронхиальной астмой, они не так эффективны в отношении влияния на воспаление дыхательных путей у больных ХОБЛ [37–44].
Краткосрочная терапия ИГКС (в течение 2–3 месяцев) больных среднетяжелой ХОБЛ приводила к уменьшению числа тучных клеток, но не влияла на CD8+-лимфоциты, нейтрофилы и макрофаги [41]. Терапия ИГКС в течение 30 месяцев приводила к стойкому уменьшению числа T-лимфоцитов и тучных клеток в слизистой оболочке бронхов, однако после прекращения терапии ИГКС в течение 6 месяцев вновь наблюдалось усиление воспалительной реакции [43]. Несмотря на то что краткосрочные исследования продемонстрировали более выраженный противовоспалительный эффект терапии ИГКС/ДДБА по сравнению с монотерапией ИГКС [42, 44], долгосрочные исследования указывают на то, что эти эффекты не “закрепляются” надолго [43].
Невысокая эффективность ИГКС при ХОБЛ не может быть объяснена только с позиции их плохой доставки в дистальные дыхательные пути, т. к. системные ГКС также недостаточно эффективны для пациентов с ХОБЛ [45]. Одной из причин резистентности к ГКС при ХОБЛ является снижение экспрессии и активности одного из ключевых ядерных ферментов – деацетилазы гистонов-2 (HDAC-2), необходимой ГКС для “выключения” активированных воспалительных генов [45, 46]. Снижение активности HDAC-2 является следствием окислительного и нитративного стресса в дыхательных путях пациентов ХОБЛ.
Сравнительно недавно появился новый класс препаратов терапии ХОБЛ – ингибиторы фосфодиэстеразы-4 (ФДЭ-4), которые открывают новые перспективы противовоспалительной терапии больных ХОБЛ [47].
Фармакологическая характеристика рофлумиласта
Рофлумиласт является избирательным ингибитором изофермента фосфодиэстеразы-4 (ФДЭ-4), оказывающим разнообразное противовоспалительное действие, и специфически влияет на основные механизмы воспаления при ХОБЛ. Практически все клетки, участвующие в воспалении дыхательных путей при ХОБЛ, содержат изофермент ФДЭ-4 [47, 48]. В исследованиях in vitro продемонстрирована способность рофлумиласта и его активного метаболита рофлумиласт-N-оксида оказывать влияние на функцию многих типов клеток, в т. ч. нейтрофилов, моноцитов и макрофагов, CD4+- и CD8+T-лимфоцитов, клеток эндотелия и эпителия, гладкомышечных клеток и фибробластов [49, 50].
Рофлумиласт принимается в виде таблеток независимо от приема пищи и времени дня. После приема внутрь препарат быстро и практически полностью всасывается. Максимальная концентрация в плазме (Tmax) достигается менее чем через час после приема. Абсолютная биодоступность составляет 79 % (табл. 1). Рофлумиласт связывается с белками плазмы (98,9 %), равновесная концентрация в плазме достигается через 4 дня приема внутрь один раз в день [51].
* Натощак, ** после быстрой внутривенной инфузии.
Основной метаболит рофлумиласта – рофлумиласт-N-оксид, фармакодинамически активен и значительно повышает общую биологическую активность исходного препарата. Рофлумиласт быстро метаболизируется при участии ферментов цитохрома P450 (CYP3A4 и CYP1A2) до активного метаболита N-оксида [9]. Подавляющая активность рофлумиласт-N-оксида по отношению к изоферменту ФДЭ-4 всего лишь в 2–3 раза ниже, чем у исходного вещества. N-оксид сохраняет высокую избирательность в отношении других изоферментов ФДЭ без избирательности в отношении подвидов ФДЭ-4 [51, 52]. У человека около 90 % ФДЭ-4 ингибируется именно рофлумиласт-N-оксидом и только 10 % – неметаболизированным рофлумиластом. Tmax рофлумиласт-N-оксида составляет 4–12 часов, равновесная концентрация в плазме достигается через 6 дней. При приеме рофлумиласта внутрь здоровыми лицами объем распределения (величина площади под кривой AUC) активного метаболита N-оксида в 12,4 раза выше, а кажущийся конечный период полувыведения из плазмы Т1/2 (21 час) длиннее, чем у исходного соединения (16 часов). Эти данные свидетельствуют в пользу режима приема 1 раз в день (табл. 1) [51, 52]. Рекомендованная доза рофлумиласта – 500 мкг перорально 1 раз в сутки независимо от приема пищи.
Наличие у пациента почечной недостаточности, цирроза печени легкой и средней степеней тяжести не требует коррекции дозы препарата. Курение также не оказывает существенного влияния на фармакокинетику рофлумиласта.
Влияние рофлумиласта на воспаление
Противовоспалительная активность рофлумиласта в модели астмы на мышах и in vitro в легочных фибробластах эмбриона человека проявлялась в уменьшении ремоделирования дыхательных путей и антифибротическом эффекте, сравнимом с таковым дексаметазона при хроническом аллергическом воспалении [47]. В моделях ХОБЛ у животных рофлумиласт снижал число нейтрофилов в бронхоальвеолярном смыве и гиперсекрецию слизи, однако при хроническом воздействии табачного дыма противовоспалительный эффект рофлумиласта проявлялся только при высоких дозах препарата и заключался в уменьшении макрофагального воспаления и уменьшении площади эмфиземы без влияния на гиперплазию бокаловидных клеток [47]. Данные, полученные на различных животных моделях, свидетельствуют о способности рофлумиласта уменьшать содержание нейтрофилов, воспаление дыхательных путей, в то же время о неэффективности ГКС (метилпреднизолона, будесонида и дексаметазона) [48, 50].
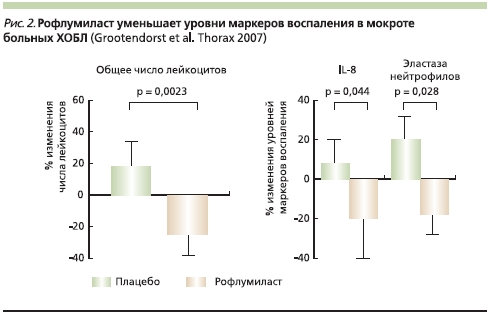
Grootendorst и соавт. в рандомизированном плацебо-контролируемом перекрестном исследовании изучали эффекты рофлумиласта на цитологический профиль индуцированной мокроты у больных ХОБЛ [53]. Терапия рофлумиластом в течение 4 недель привела к улучшению функциональных показателей, а также снижению числа воспалительных клеток в мокроте, таких как нейтрофилы, лимфоциты и эозинофилы (рис. 2) [53]. Кроме того, на фоне терапии рофлумиластом отмечено уменьшение концентрации воспалительных маркеров – нейтрофильной эластазы, ИЛ-8 (рис. 2), эозинофильного катионного белка и α2-макроглобулина – маркера микроваскулярной проницаемости [53].
Клинические исследования, посвященные эффективности рофлумиласта при ХОБЛ
Клиническая эффективность рофлумиласта в отношении пациентов с ХОБЛ среднетяжелого и тяжелого течений была продемонстрирована в серии крупных рандомизированных плацебо-контролируемых исследований RECORD, OPUS, RATIO, EOS, HEILOS, AURA и HERMES (табл. 2) [54–57]. Первичными точками в этих исследованиях являлись изменения легочной функции, число обострений и качество жизни, связанное со здоровьем.
Примечание. Пост-БД ОФВ1 – постбронходилатационный ОФВ1.
Влияние рофлумиласта на легочную функцию при ХОБЛ
Рофлумиласт не обладает прямыми бронхорасширяющими свойствами, однако благодаря противовоспалительным эффектам препарат способен улучшать функциональные показатели пациентов с ХОБЛ [47].
В исследовании RECORD рофлумиласт улучшил постбронходилатационный ОФВ1 на 74 мл (доза рофлумиласта – 250 мкг/сут) и на 97 мл (доза рофлумиласта – 500 мкг/сут) по сравнению с плацебо [54]. В исследованиях OPUS и RATIO изменения добронходилатационного (до-БД) ОФВ1 на фоне приема рофлумиласта были на 51 мл больше постбронходилатационного (пост-БД) ОФВ1 – на 53 мл больше по сравнению с плацебо, причем эти результаты не зависели от фенотипа ХОБЛ и сопутствующего приема ИГКС [55].
В исследованиях EOS и HELIOS на больных ХОБЛ с продуктивным кашлем рофлумиласт в сочетании с салметеролом или тиотропием достоверно улучшал до- и пост-БД ОФВ1 и ФЖЕЛ независимо от стадии заболевания и статуса курения [56]. В исследованиях AURA и HERMES до-БД ОФВ1 увеличился суммарно на 46 мл, также достоверно повысился пост-БД ОФВ1 [57].
Влияние рофлумиласта на симптомы и качество жизни больных ХОБЛ
В объединенном анализе результатов исследований OPUS и RATIO рофлумиласт по сравнению с плацебо в целом не вызывал существенных улучшений качества жизни, оцененного по Респираторному вопроснику госпиталя Святого Георгия (SGRQ – St. George's respiratory questionnaire). Однако качество жизни больных ХОБЛ с бронхитическим фенотипом, а также больных ХОБЛ, одновременно получавших ИГКС, достоверно улучшилось [55].
В исследовании HELIOS терапия рофлумиластом привела к улучшению качества жизни, связанного со здоровьем, уменьшению одышки и потребности в препаратах для облегчения симптомов у больных ХОБЛ с продуктивным кашлем [56].
В исследованиях AURA и HERMES рофлумиласт достоверно уменьшил выраженность одышки по шкале TDI по сравнению с плацебо независимо от одновременного приема ДДБА, но в большей степени – у пациентов с частыми обострениями ХОБЛ [57].
Влияние рофлумиласта на частоту обострений ХОБЛ
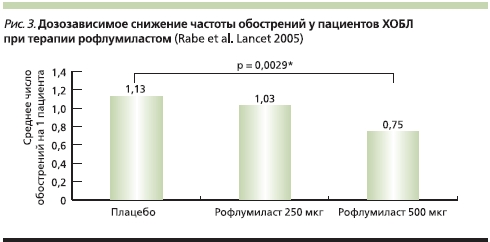
В исследовании RECORD (576 больных получали рофлумиласт в дозе 250 мкг/сут, 555 – рофлумиласт в дозе 500 мкг/сут и 280 больных – плацебо), более высокие дозы препарата эффективнее снижали частоту обострений ХОБЛ по сравнению с низкими дозами (1,13 обострения на 1 пациента в группе плацебо, 1,03 обострения на 1 пациента в группе 250 мкг и 0,75 обострения на 1 пациента в группе 500 мкг рофлумиласта) (рис. 3) [54].
Объединенный анализ результатов исследований RATIO и OPUS выявил, что частота среднетяжелых и тяжелых обострений ХОБЛ на фоне лечения рофлумиластом была достоверно ниже (на 14,3 %), чем на фоне плацебо (0,52 и 0,61 обострений в год соответственно). У больных, получавших одновременно ИГКС, частота обострений ХОБЛ достоверно уменьшилась на 18,8 % [55].
В исследованиях AURА и HERMES среднее число тяжелых и среднетяжелых обострений ХОБЛ на одного пациента в год значительно снизилось у больных, получавших рофлумиласт, по сравнению с плацебо: отношение риска (ОР) – 0,83; 95 % доверительный интервал (ДИ) – 0,75–0,92 независимо от одновременного приема ДДБА [57]. Время до начала первого, второго и третьего тяжелого или среднетяжелого обострений значительно увеличилось у всех больных, получавших рофлумиласт [57].
Эффективность применения рофлумиласта у пациентов с различными фенотипами ХОБЛ
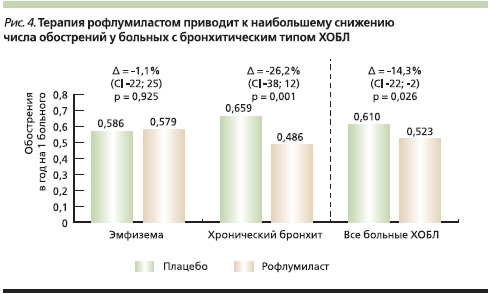
Rennard и соавт. выполнили совокупный post-hoc-анализ исследований OPUS и RATIO, изучавших эффективность рофлумиласта в отношении пациентов с тяжелой и очень тяжелой ХОБЛ (стадии III и IV по классификации GOLD), и показали значительное снижение числа обострений ХОБЛ в подгруппе больных бронхитическим вариантом ХОБЛ (т. е. с хроническим кашлем и продукцией мокроты) на 26,2 % (95 % ДИ – 38–12, р = 0,001), в то время как в целом по группе ХОБЛ снижение числа обострений составило 14,3 % (95 % ДИ – 25–2, р = 0,026) (рис. 4) [58].
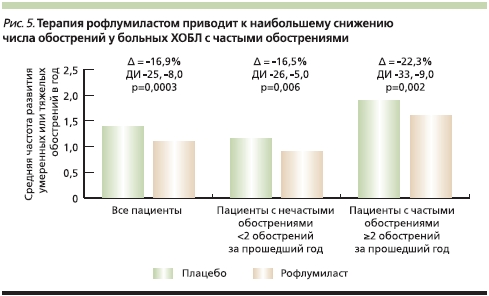
Bateman и соавт. на основе исследований AURA и HERMES проанализировали влияние рофлумиласта на число обострений у пациентов с ХОБЛ с частыми (≥ 2 обострений в год) и нечастыми (< 2 обострений в год) обострениями [59]. У пациентов с нечастыми обострениями терапия рофлумиластом приводила к достоверному снижению числа обострений по сравнению с плацебо на 16,5 % (0,96 против 1,15 обострения в год соответственно, р = 0,006). Однако у пациентов с частыми обострениями различие с плацебо оказалось еще более выраженным – 22,3 % (1,51 против 1,95 обострения в год соответственно, р = 0,002) (рис. 5).
Идентификация подгрупп пациентов, особенно хорошо отвечающих на определенную терапию, соответствует современной концепции, согласно которой, популяция больных ХОБЛ состоит из многих фенотипов. Такой подход является шагом навстречу персонализированной медицине, при которой для каждого фенотипа будет подобрана соответствующая терапия [60, 61]. Необходимо отметить, что анализы, представленные Rennard и соавт. и Batemen и соавт., могут быть использованы в дальнейших исследованиях для изучения эффективности рофлумиласта в целевой популяции пациентов с ХОБЛ. При ХОБЛ такой подход, способствующий индивидуализации фармакологической терапии, используется впервые.
Wedzicha и соавт. провели анализ двух 12-месячных исследований, посвященных эффективности рофлумиласта в отношении 3091 пациента с ХОБЛ III–IV стадий по классификации GOLD [71]. На основании частоты обострений за предшествующий год пациенты были разделены на категории с частыми (≥ 2 в год) и нечастыми обострениями (1 в год). Среди пациентов с частыми обострениями, принимавших рофлумиласт, через год частые обострения сохранялись у 32,0 % по сравнению с 40,8 % в группе плацебо (отношение риска – [ОР] = 0,799; p = 0,0148). Среди пациентов с нечастыми обострениями, получавших рофлумиласт, через год 17,5 % перешли в категорию пациентов с частыми обострениями по сравнению с 22,9 % – группы плацебо (ОР = 0,768, p = 0,0018). Таким образом, впервые было показано, что противовоспалительная терапия рофлумиластом позволяет изменить фенотип больных ХОБЛ: перевести пациентов с ХОБЛ из фенотипа с частыми обострениями в более стабильную категорию с нечастыми обострениями.
Совместное использование рофлумиласта с бронхолитиками и ингаляционными кортикостероидами
Рофлумиласт хорошо сочетается со всеми известными препаратами, используемыми в длительной поддерживающей терапии ХОБЛ. Можно говорить о синергичном эффекте рофлумиласта с ДДБА, длительно действующими антихолинергическими препаратами (ДДАХП) и ИГКС. В исследовании EOS [56] был изучен эффект рофлумиласта у пациентов с ХОБЛ, принимавших поддерживающую терапию ДДБА салметеролом. Оказалось, что прирост ОФВ1 при совместном применении рофлумиласта и салметерола был значительно выше, чем при монотерапии салметеролом (различия 49 мл [95 % ДИ – 27–71 мл; p < 0,0001] до приема бронходилататоров и 60 мл [95 % ДИ – 32–82 мл; p < 0,0001] после приема бронходилататоров соответственно). Таким образом, положительный эффект рофлумиласта проявляется в дополнение к бронхорасширяющему действию ДДБА. Кроме того, в данном исследовании было достигнуто значимое снижение частоты обострений и удлинение времени до последующего обострения у пациентов, одновременно получавших ДДБА [56].
В исследовании HELIOS [56] изучена эффективность рофлумиласта для пациентов ХОБЛ, принимающих поддерживающую терапию ДДАХП тиотропием. В исследовании было отмечено статистически достоверное и клинически значимое улучшение функции легких у больных, получавших рофлумиласт и тиотропий. Прирост ОФВ1 при совместном применении препаратов был значительно выше, чем при монотерапии тиотропием (различия – 80 мл [95 % ДИ – 5–110 мл; p < 0,0001] до приема и 81 мл [95 % ДИ 51–110 мл; p < 0,0001] после приема бронходилататоров соответственно). На фоне совместной терапии отмечено также удлинение времени до первого обострения.
Rennard и соавт. в совокупном анализе двух крупных рандомизированных клинических исследований, изучавших эффективность рофлумиласта в отношении пациентов с тяжелой и очень тяжелой ХОБЛ (стадии III и IV по классификации GOLD), показали более выраженное снижение числа обострений ХОБЛ у больных, принимавших ИГКС, по сравнению с пациентами, их не принимавшими [58].
В мета-анализе Mills и соавт. была оценена относительная эффективность ДДБА, ДДАХП, ИГКС и рофлумиласта в терапии ХОБЛ. Было проанализировало 26 рандомизированных клинических исследований, в которых изучалась эффективность перечисленных препаратов и их комбинаций на больных ХОБЛ. Не было выявлено достоверных различий по влиянию разных режимов терапии на частоту среднетяжелых и тяжелых обострений ХОБЛ, однако, по мнению авторов, добавление рофлумиласта к ДДБА и ДДАХП может дать дополнительные преимущества снижению риска обострений ХОБЛ [62].
Оценка безопасности рофлумиласта
Из наиболее частых нежелательных явлений (НЯ) при применении рофлумиласта можно отметить диарею, тошноту, снижение аппетита, снижение массы тела и головную боль [63].
Агентство Food and Drug Administration (FDA) опубликовало данные совокупного анализа, основанного на 14 плацебо-контролируемых исследованиях 2-й и 3-й фаз, которые составили т. н. пул безопасности ХОБЛ [64]. Данный пул включал приблизительно 12 тыс. пациентов ХОБЛ, из которых более половины (5766 [88 %]) получали рофлумиласт в дозе 500 мкг один раз в сутки и 797 (12 %) – в дозе 250 мкг один раз/сут. Среди больных, получавших 500 мкг рофлумиласта, 1232 пациента принимали препарат минимум год, 1081 – от 6 до 12 месяцев, 2081 – от 3 до 6 месяцев и 1370 – менее 3 месяцев. Средняя экспозиция к дозе рофлумиласта 500 мкг составила 167 дней [64]. Наиболее частым побочным эффектом рофлумиласта была диарея (10,1 % в группе рофлумиласта 500 мкг/сут против 2,6 % в группе плацебо) (табл. 3). Другие побочные эффекты представлены в табл. 4.
Примечание. Представлены все НЯ с частотой ≥ 2 % у пациентов, принимавших терапию рофлумиластом.
Большинство НЯ носили легкий и умеренный характер. Нежелательные явления при приеме рофлумиласта появлялись чаще всего в первые недели приема препарата и разрешались в ходе его дальнейшего приема [48]. Считается, что причина НЯ со стороны желудочно-кишечного тракта – в угнетении изоформы фермента ФДЭ-4D в головном мозге. Например, другой ингибитор ФДЭ-4 – силомиласт, разработка которого уже прекращена из-за развития выраженных диспепсических явлений, проявлял в 10 раз бoльшую избирательность в отношении ФДЭ-4D, чем к другим изоформам фермента ФДЭ-4D [65]. Более хорошая переносимость рофлумиласта объясняется отсутствием избирательности по отношению к ФДЭ-4D.
У пациентов с ХОБЛ, получавших терапию рофлумиластом, было отмечено более частое по сравнению с плацебо снижение массы тела. После отмены рофлумиласта масса тела большинства пациентов восстановилась в течение 3 месяцев. Лицам с пониженным питательным статусом необходимо контролировать массу тела во время каждого визита.
Неожиданное положительное влияние рофлумиласта на глюкозу крови у пациентов с сахарным диабетом (СД)
Одной из неожиданных находок, выявленных при проведении клинических исследований, стало благоприятное влияние рофлумиласта на гликемический профиль у пациентов с ХОБЛ с сопутствующим СД 2 типа: препарат приводил к отчетливому снижению уровня глюкозы крови натощак и снижению концентрации гликолизированного гемоглобина (HbA1c) [66]. Предположительно гипогликемические эффекты рофлумиласта опосредуются также через влияние на внутриклеточные уровни цАМФ, т. к. небольшие изменения в массе тела пациентов вряд ли могли бы оказать такое влияние на метаболизм глюкозы. Уровни глюкозы крови натощак не менялись у пациентов с ХОБЛ без СД. Данные недавно выполненного клинического исследования указывают на возможность терапии рофлумиластом улучшить гликемический профиль при сочетании ХОБЛ с СД [66]. В другом исследовании рофлумиласт снизил уровень фруктозамина, маркера длительного контроля СД, и концентрации HbA1c у больных с впервые выявленным СД без сопутствующего ХОБЛ (табл. 4) [67]. Необходимо проведение дальнейших исследований для определения роли рофлумиласта в достижении контроля диабета и возможности препарата предотвращать осложнения СД.
Место рофлумиласта в современных рекомендациях по ведению пациентов с ХОБЛ
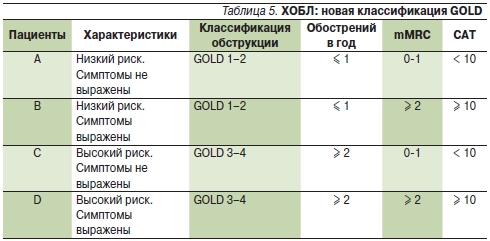
По сравнению с предыдущими руководствами новая версия глобального руководства по ведению пациентов с ХОБЛ (GOLD) предлагает новую классификацию ХОБЛ, призванную обеспечить более индивидуализированную терапию заболевания на основе оценки симптомов заболевания (выраженные или невыраженные симптомы), степени обструкции дыхательных путей (классифицируемой как “легкая”, “средняя”, “тяжелая” и “очень тяжелая”, что соответствует прежним стадиям 1–4 по GOLD) и риска развития обострений (классифицируемых как “низкий”: ≤1 обострения в года или “высокий”: ≥2 обострений в год). С учетом этих трех важнейших характеристик пациенты могут быть распределены в одну из четырех групп (категорий), обозначаемых как A, B, C или D (табл. 5). Рекомендации по терапии ХОБЛ даются с учетом группы, к которой относится пациент [2]. Однако пока еще нет данных, насколько новый подход к терапии позволит улучшить исходы больных ХОБЛ.
Рофлумиласт и его активный метаболит рофлумиласт N-оксид являются селективными ингибиторами ФДЭ-4, механизм действия которых проявляется в снижении активации воспалительных клеток [68]. Рофлумиласт зарегистрирован для применения в Европейском Союзе в 2010 г., а в России – в 2011 г. пациентами с ХОБЛ со стадиями 3 и 4 по классификации GOLD (ОФВ1 < 50 % после приема бронходилататора) и частыми обострениями, несмотря на корректное использование длительно действующих бронходилататоров. В США в настоящее время рофлумиласт зарегистрирован как “препарат снижения риска обострения ХОБЛ у пациентов с тяжелым ХОБЛ с хроническим бронхитом и частыми обострениями в анамнезе” [69]. Хронический бронхит диагностируют при наличии кашля и продукции мокроты минимум в течение 3 месяцев на протяжении 2 последовательных лет [2]. В соответствии с современными рекомендациями GOLD рофлумиласт рассматривается как терапия, назначаемая дополнительно к приему ДДАХП или ДДБА, а также к комбинации ИГКС + ДДБА пациентам с тяжелой или очень тяжелой бронхиальной обструкцией и высоким риском обострений (“группы С и D”) (табл. 6) [2]. Рофлумиласт является первым и единственным ингибитором ФДЭ-4, зарегистрированным в качестве лечения пациентов, с очень четко прописанными показаниями к применению [58]. Сегодня проводятся дальнейшие исследования с целью определения роли рофлумиласта и для больных бронхиальной астмой [70].
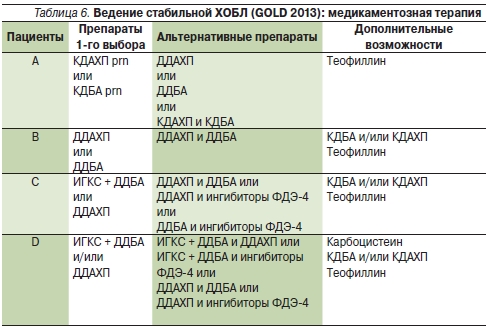
КДАХП – коротко действующие антихолинергические препараты, КДБА – коротко действующие β2-агонисты, ДДАХП – длительно действующие антихолинергические препараты, ДДБА – длительно действующие β2-агонисты, ИГКС – ингаляционные глюкокортикостероиды,ФДЭ-4 – ингибиторы фосфодиэстеразы-4.
Примечание. Препараты в каждом боксе упомянуты в алфавитном порядке, а не в порядке предпочтения.
Заключение
Рофлумиласт является первым и пока единственным ингибитором ФДЭ-4, зарегистрированным в качестве дополнительной терапии пациентов с тяжелой ХОБЛ и частыми обострениями, уже получавшими терапию длительно действующими бронходилататорами.
Основной механизм действия рофлумиласта связан с угнетением воспаления дыхательных путей у пациентов с ХОБЛ. В клинических исследованиях 3-й фазы показано, что рофлумиласт приводит к улучшению функциональных параметров, симптомов, качества жизни и снижению числа обострений ХОБЛ.



