Сердечно-сосудистые (ССЗ) и цереброваскулярные заболевания (ЦВЗ), представленные в официальной международной статистике как болезни системы кровообращения, являются ведущей причиной смертности населения практически во всех странах мира, в частности в Российской Федерации (РФ), на их долю в числе умерших от всех причин приходится более 55% смертей как среди мужчин, так и среди женщин [1].
Единство патофизиологических процессов, приводящих к развитию и прогрессированию ССЗ и ЦВЗ, подтверждается едиными для них факторами риска, такими как артериальная гипертензия (АГ), атерогенная дислипидемия, гипергликемия и сахарный диабет (СД), ожирение, особенно абдоминальный тип, метаболический синдром, инсулинорезистентность, хроническая болезнь почек (ХБП), а также курение и гиподинамия.
Как видно из представленных составляющих факторов риска, многие из них уже являются самостоятельными заболеваниями, приводящими к развитию или ухудшению прогноза сосуществующих с ними болезней у человека. Такая клиническая картина взаимодействия нескольких патологий у одного больного хорошо известна всем врачам, поскольку редко в настоящее время, особенно среди пациентов среднего и пожилого возраста, можно встретить только одну патологию. Термин «коморбидность» (лат. со – вместе, morbus – болезнь) предложил в 1970 г. A. Feinstein – врач, исследователь и эпидемиолог, оказавший значительное влияние на технику проведения клинических исследований, особенно в области клинической эпидемиологии. Он вкладывал в этот термин представление о наличии дополнительной клинической картины, которая уже существует или может появиться самостоятельно помимо текущего заболевания и всегда отличается от него [2]. Однако принципиальное уточнение термину «коморбидность» дали H.C. Kraemer и M. Akker, определив ее как сочетание у одного больного нескольких, именно хронических, заболеваний. Они же предложили первую классификацию коморбидности [3, 4]. Согласно их данным, фактором, влияющим на развитие коморбидности, могут являться хроническая инфекция, воспаление, инволютивные и системные метаболические изменения, ятрогения, социальный статус, экологическая обстановка и генетическая предрасположенность [5].
Согласно современным данным, число больных с пятью и более коморбидными заболеваниями увеличилось с 42% в 1988–1994 гг. до 58% в 2003–2008-х [6, 7]. Среди существующих сегодня систем оценки коморбидности наиболее распространен индекс Charlson, предложенный для оценки отдаленного прогноза больных в 1987 г.
Данный индекс представляет собой балльную систему оценки (от 0 до 40) наличия определенных сопутствующих заболеваний и используется для прогноза летальности [8]. При его расчете суммируются баллы, соответствующие сопутствующим заболеваниям, а также добавляется 1 балл на каждые 10 лет жизни при превышении пациентом 40-летнего возраста (т.е. 50 лет – 1 балл, 60 лет – 2 балла и т.д.) (табл. 1, 2).

Частые варианты коморбидности в амбулаторной клинической практике
Рассмотрим, какие варианты коморбидности встречаются чаще всего. АГ – одна из актуальнейших проблем современной терапии, кардиологии и неврологии. Распространенность АГ в европейских странах, в т.ч. и в РФ, находится в диапазоне 30–45% от общей популяции с резким возрастанием по мере старения населения. АГ часто сопровождает и является признанным ведущим фактором риска развития ССЗ, таких как инфаркт миокарда (ИМ), инсульт, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность (ХСН), а также ЦВЗ: хроническая ишемия головного мозга, гипертоническая энцефалопатия, ишемический или геморрагический инсульт, транзиторная ишемическая атака; почечных заболеваний: хроническая болезнь почек (ХБП) и терминальная почечная недостаточность. АГ является самым частым компонентом коморбидности в практике любого врача, присутствуя в 90% случаев всех возможных сочетаний заболеваний в терапевтической практике [9]. Наиболее распространенный вариант коморбидности – АГ с атеросклерозом или дислипидемией.
Атеросклероз – заболевание, поражающее артерии эластического типа, такие как аорта, подвздошные сосуды, а также крупные и средние артерии мышечного типа (коронарные, сонные, внутримозговые, артерии нижних конечностей). Атеросклероз проявляется уплотнением сосудистой стенки и образованием атеросклеротических бляшек. Это динамичный процесс, для которого характерно как прогрессирование, так и обратное развитие изменений в стенке артерии. Однако со временем атеросклероз прогрессирует, приводя в конечном итоге к клиническим проявлениям заболевания. Основным осложнением атеросклероза коронарных артерий является ИБС, которая клинически проявляется стенокардией, ИМ и кардиосклерозом, ведущими к прогрессирующей сердечной недостаточности. Поражение магистральных артерий головного мозга проявляется симптомами его хронической ишемии с последующим развитием атеросклеротической энцефалопатии и инсульта. Атеросклероз артерий нижних конечностей сопровождается клинической картиной перемежающей хромоты. В отсутствие соответствующего лечения заболевание прогрессирует и может закончиться развитием гангрены нижних конечностей [8, 9].
ХБП – наднозологическое понятие, объединяющее сохраняющиеся в течение 3 и более месяцев признаки повреждения почек и/или их функции. Концепция ХБП была сформулирована в 2002 г. экспертами Национального почечного фонда США и к настоящему времени получила признание Международного медицинского сообщества, в 2007 г. была введена в Международную классификацию болезней 10-го пересмотра и заменила устаревший термин «хроническая почечная недостаточность» [10]. Снижение скорости клубочковой фильтрации (СКФ) в процессе формирования ХБП рассматривается в качестве маркера неблагоприятного прогноза распространенных в популяции заболеваний, прежде всего ССЗ, что соответствует утвердившейся в настоящее время концепции 5 типов кардиоренальных взаимоотношений [11–13]. По данным различных популяционных регистров и исследований, распространенность почечной патологии составляет 10–13%, достигая в группах риска 20%.

ССЗ и ХБП имеют общие «традиционные» факторы риска (ожирение, дислипидемия, метаболический синдром, СД и др.), при этом рост численности популяции пациентов с почечными нарушениями в настоящее время происходит в основном за счет вторичного повреждения почек в рамках ССЗ: АГ, атеросклероза, ИБС, ХСН и фибрилляции предсердий [14].
Следующим заболеванием, входящим в самые частые коморбидные ассоциации, является СД. Действительно, сегодня СД приобрел максимальную распространенность в популяции: к 2030 г., по данным экспертов Всемирной организации здравоохранения (ВОЗ), в мире предполагается увеличение числа больных с данной патологией до 552 млн человек, при этом более 90% из них будут больные СД 2 типа (СД2) [15]. Согласно данным, озвученным на съезде Международной федерации диабета, в РФ в 2011 г. число пациентов с СД2 достигло 12,5 млн, что составляет почти 10% популяции. На сегодняшний день СД2 рассматривают как эквивалент присутствия у пациента клинически выраженного ССЗ. Собственно, сами ССЗ встречаются у пациентов с СД2 в 2–5 раз чаще, чем у лиц без СД. При этом высок риск развития таких состояний, как ИБС, ИМ, АГ, инсульт. В структуре коморбидности у пациентов с СД присутствуют: АГ – 80%, атеросклероз – 70%, диастолическая дисфункция миокарда – 50–75%, ХСН – 12–22%. Смертность от ИМ среди больных СД в 1,5–2,0 раза выше, чем среди людей, не страдающих этим заболеванием, как в острой стадии ИМ, так и при продолжительном наблюдении. Внезапная сердечная смертность пациентов с СД2 среди всей кардиоваскулярной летальности составляет 50%, центральное место в этом занимает аритмогенный характер СД [16]. Дополнительной при СД является проблема компенсации уровня сахара в крови, которая связана с риском возникновения гипогликемий (снижение уровня глюкозы в крови ниже нормальных значений). Известно, что индекс гипогликемий нарастает с длительностью СД более 6 лет, при этом у пациентов выраженные гипогликемии ассоциированы с высоким риском внезапной сердечно-сосудистой смерти, развитием ИМ, инсульта, а также деменции [17].
Согласно современным представлениям, нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН) являются состоянием, способным прогрессировать с исходом в СД2. В 1990-х гг. эксперты ВОЗ предложили использовать новый термин «преддиабет», который объединил НТГ и НГН.
Сегодня в мире около 314 млн человек имеют преддиабет, через 20 лет их число увеличится в 1,5 раза и составит около 500 млн человек, именно они пополнят многомиллионную армию больных СД2 уже в ближайшем будущем [15]. Установлено, что частота развития СД у пациентов с НТГ и НГН примерно одинаковая. Поскольку НТГ – более распространенное, чем НГН, состояние в популяциях, с этим состоянием связано большее число новых случаев СД. По данным эпидемиологических исследований, в группе пациентов с преддиабетом переход в СД2 зависит от возраста, расовой принадлежности, степени ожирения и в среднем составляет 5% в год (от 3,6 до 8,7%). При 5-летнем наблюдении за такими пациентами СД2 разовьется у 35–40%, а при сочетании НТГ и НГТ – у 65% пациентов [17]. Также известно, что СД2 и гипергликемия без СД (преддиабет) являются независимым фактором риска быстрого развития системного атеросклероза с поражением сосудов различных локализаций, в т.ч. мозговых. Поэтому изучению особенностей течения преддиабета, его ранней диагностики и возможности первичной и вторичной профилактики придается большое значение.
Врачу любой специальности, но особенно терапевту, рекомендуется выявлять следующие факторы риска развития СД2:
- возраст ≥45 лет;
- избыточная масса тела и ожирение (ИМТ≥25 кг/м2);
- семейный анамнез СД (родители и сибсы с СД2);
- привычно низкая физическая активность;
- НГТ или НТГ в анамнезе;
- гестационный СД или рождение крупного плода в анамнезе;
- артериальная гипертензия (≥140/90 мм рт.ст. или медикаментозная гипертензия);
- уровни холестерина липопротеидов высокой плотности ≤0,9 ммоль/л и/или триглицеридов ≥2,82 ммоль/л;
- синдром поликизтозных яичников;
- наличие ССЗ.
Также рекомендуется проводить скрининг (табл. 3), поскольку рано выявленный преддиабет и правильно предпринятые профилактические меры могут в итоге изменить судьбу пациента.
Как видно из табл. 3, главным фактором риска развития СД2 для пациента является наличие избыточной массы тела, особенно при отложении жира в абдоминальной области, характерное для развития метаболического синдрома (МС). Таким образом, вариантом раннего скрининга на коморбидность будет выявление МС [18]. Клиническая значимость нарушений и заболеваний, объединенных в рамки синдрома, заключается в том, что их сочетание в значительной степени ускоряет развитие и прогрессирование заболеваний, связанных с атеросклерозом, – СД2, ИБС, инсульт, ИМ, ХСН, которые имеют не только медицинское, но и социальное значение в современном обществе.
Конечно же, без упоминания о хронической обструктивной болезни легких (ХОБЛ) наш обзор не будет полным. За последние 20 лет заболеваемость ХОБЛ переместилась с 12-го на 5-е место, а смертность по причине ХОБЛ – с 6-го на 2-е [19].
В настоящее время ХОБЛ рассматривают как системное заболевание с множественными внелегочными эффектами, которые в ряде случаев и определяют прогноз для пациентов. Диагностика и оценка степени тяжести ХОБЛ проводятся по выраженности бронхиальной обструкции, однако вместе с тем большое значение в прогнозе течения заболевания имеют взаимосвязи нарушений функции внешнего дыхания и физической работоспособности, состояния сердечно-сосудистой системы, метаболического статуса, интенсивности нейрогуморальной и провоспалительной активации. Хроническая гипоксия, развивающаяся при ХОБЛ, как стрессовый фактор утяжеляет течение всех сопутствующих заболеваний.
На фоне гипоксии активируется синтез тромбоксана А2, что в сочетании с повышением показателей гематокрита у больных ХОБЛ вызывает микроциркуляторные нарушения в миокарде, способствует развитию коронароспазма, дистрофии миокарда, сердечной недостаточности.
Разнообразные нарушения ритма при сочетании ХОБЛ с ИБС или АГ имеют место более, чем у 90% пациентов [20]. Помимо ИБС и АГ частыми коморбидными сочетаниями, на фоне которых манифестирует ХОБЛ, часто являются МС, СД2 и ХСН.
Полипрагмазия – фокус на безопасность терапии
Таким образом, с учетом высокой распространенности коморбидных состояний в современной популяции прием лекарств для существенной доли лиц среднего и подавляющего большинства лиц старшего возраста становится обязательным на протяжении всей жизни [21]. Далеко нередкая ситуация, когда пациенты на постоянной основе получают несколько препаратов для лечения всех хронических заболеваний.
Основные группы пациентов, входящих в данную категорию:
- пожилые пациенты (на них приходится до 30% всех потребляемых лекарственных средств);
- пациенты с ССЗ (ИБС, ХСН, инсультом др.);
- пациенты с другими (не ССЗ) хроническими заболеваниями, например ХОБЛ, бронхиальная астма, ХБП;
- пациенты с СД;
- пациенты с множественными факторами риска (АГ, дислипидемия и т.д.);
- пациенты, которые постоянно самостоятельно принимают лекарства (без назначения врача или безрецептурные).
Поэтому в практику прочно вошли такие понятия, как «нежелательные явления» и «побочные эффекты», при использовании лекарственных средств (ЛС). Они составляют четвертую по частоте причину смертности в США и являются поводом для госпитализации примерно 5% больных [22].
В реальной клинической практике врачи постоянно сталкиваются с проблемой выбора наиболее безопасных и эффективных комбинаций ЛС, особенно при лечении пациентов с коморбидными заболеваниями. По данным разных авторов, до 25% назначаемых врачами комбинаций ЛС потенциально опасны, т.е. могут повысить риск побочных эффектов [23]. Так, недавнее исследование, проведенное в условиях многопрофильного стационара Москвы среди пациентов, получающих более пяти ЛС одновременно, выявило, что в 57% случаев назначались потенциально опасные комбинации ЛС [24]. Причем среди выявленных потенциально опасных комбинаций ЛС в 50% отмечено фармакокинетическое взаимодействие на уровне системы цитохрома Р450.
В другом крупном исследовании было отмечено, что наиболее значимым фактором риска развития неблагоприятных побочных эффектов является собственно количество принимаемых ЛС: чем больше лекарств принимал пациент, тем чаще развивались у него побочные эффекты [25]. И действительно, прием нескольких ЛС представляет потенциальную опасность вследствие их взаимодействия и увеличения риска развития серьезных побочных эффектов от каждого из них. При анализе смертельных исходов от побочных эффектов выяснилось, что в трети случаев применялись потенциально опасные комбинации ЛС [25]. Кроме того, побочные эффекты, возникающие при применении потенциально опасных комбинаций, также представляют собой серьезную экономическую проблему, т.к. расходы на их лечение составляют половину от затрат на терапию всех лекарственных осложнений. Поэтому снижение риска развития таких неблагоприятных событий, связанных с межлекарственным взаимодействием, остается актуальной задачей для современных врачей любой специальности. Также актуальной проблемой является тот факт, что до 20% пациентов сочетают прием ЛС с витаминно-минеральными комплексами, биологически активными добавками (БАД) и другими парафармацевтическими и/или функциональными продуктами [26]. Следует отметить, что для всех вариантов используемых препаратов, будь то классические рецептурные ЛС или их комбинации с безрецептурными фитопрепаратами или БАД, возможно развитие любых вариантов межлекарственного взаимодействия, вплоть до летального.
Факторы риска развития реакций взаимодействия ЛС
Риск возникновения опасных взаимодействий ЛС зависит от многих факторов, основными из которых являются возраст больного, сопутствующие заболевания, наличие полипрагмазии, терапевтическая широта применяемых ЛС. При наличии факторов риска пациентам необходим более строгий контроль эффективности и безопасности при применении ЛС. Наиболее часто нежелательные взаимодействия развиваются при применении следующих групп ЛС [27]:
- пероральные антикоагулянты;
- сердечные гликозиды;
- пероральные гипогликемические ЛС;
- теофиллин/эуфиллин;
- противосудорожные;
- цитостатики;
- антидепрессанты;
- нейролептики;
- ноотропы.
В клинической практике встречаются следующие виды взаимодействия ЛС [26]:
- фармацевтическое;
- фармакокинетическое;
- фармакодинамическое.
Фармацевтическое взаимодействие может происходить до поступления ЛС в организм пациента, в его основе лежат физико-химические реакции между ЛС. Наибольшее клиническое значение имеют фармакокинетическое и фармакодинамическое взаимодействия ЛС. Фармакокинетическое взаимодействие – влияние одного ЛС на фармакокинетические процессы (всасывание, распределение, метаболизм, выведение) другого. В результате фармакокинетического взаимодействия изменяется концентрация ЛС в плазме крови, а следовательно, и его взаимодействие со специфическими молекулами-мишенями (рецепторами, ферментами, ионными каналами и др.). Фармакодинамическое взаимодействие – влияние одного ЛС на процесс генерации и реализации фармакологического эффекта другого, при этом концентрация ЛС в плазме может не изменяться. Чаще всего при фармакодинамическом взаимодействии одно ЛС вмешивается в механизм действия другого. Фармакокинетическое и фармакодинамическое взаимодействия могут происходить по разным механизмам, знание которых позволяет врачу избегать применения нерациональных и потенциально опасных комбинаций ЛС [27].
Механизмы фармакокинетического взаимодействия
- На этапе всасывания ЛС из желудочно-кишечного тракта (ЖКТ) происходит образование комплексов и нерастворимых хелатных соединений; изменение рН желудочного содержимого, состояния нормальной микрофлоры ЖКТ, моторики ЖКТ; влияние на активность Р-гликопротеина. Эти изменения могут приводить к ослаблению или усилению всасывания ЛС из ЖКТ. Как правило, взаимодействие ЛС при всасывании развивается при их одновременном приеме или если интервал между приемами ЛС составляет менее 2 часов. Если интервал между приемами ЛС составляет более 4 часов, взаимодействие на уровне всасывания практически невозможно. Взаимодействие при всасывании особенно значимо для ЛС с коротким периодом полувыведения (менее 12 часов) и для препаратов, фармакологический эффект которых развивается только при быстром достижении максимальной терапевтической концентрации. Это связано с тем, что даже незначительное уменьшение интенсивности всасывания подобных ЛС приводит к достижению лишь субтерапевтических концентраций и, следовательно, к снижению эффективности данной фармакотерапии. Это относится прежде всего к снотворным и ненаркотическим анальгетикам.
В то же время изменение всасывания практически не влияет на биодоступность ЛС с длинным периодом полувыведения (более 12 часов). - На этапе распределения действуют механизмы вытеснения связей с белками плазмы крови; влияния ЛС на активность Р-гликопротеина, локализованного в эндотелиоцитах гематоэнцефалического барьера. Наибольшее клиническое значение данные механизмы взаимодействия имеют для ЛС, которые связываются с белками плазмы более чем на 90% (непрямые антикоагулянты, противосудорожные, пероральные гипогликемические средства – производные сульфонилмочевины).
- На этапе биотрансформации ЛС действуют механизмы индукции или ингибирования изоферментов цитохрома Р450. Известно более 300 ЛС, влияющих на метаболизм других лекарственных препаратов. При этом они способны как повышать активность ферментов метаболизма ЛС (индукция), так и подавлять ее (ингибирование). Индукция ведет к ускорению биотрансформации ЛС – субстратов соответствующих ферментов и, как правило, к снижению их фармакологической активности. Среди индукторов ферментов биотрансформации ЛС наиболее широко известны в клинической практике рифампицин (индуктор изоферментов цитохрома Р450 1А2, 2С9, 2С19, 3A4, 3А5-7) и барбитураты (индукторы изоферментов цитохрома Р450 1A2, 2В6, 2C8, 2С9, 2С19, 3A4, 3А5-7). Индукция ферментов, вызванная рифампицином и барбитуратами, может приводить к снижению фармакологической эффективности непрямых антикоагулянтов (варфарина, ривароксабана, апиксабана, аценокумарола, фениндиона), циклоспорина, глюкокортикоидов, кетоконазола, теофиллина, хинидина, дигитоксина и верапамила, что требует коррекции режима дозирования данных ЛС (увеличение дозы). Следует подчеркнуть, что при отмене индуктора ферментов биотрансформации ЛС необходимо сразу уменьшить дозировку сочетаемого ЛС, т.к. происходит увеличение его концентрации в крови. Пример такого взаимодействия – комбинирование антикоагулянтов непрямого действия (варфарина, ривароксабана, апиксабана) и фенобарбитала. Причиной кровотечений при лечении непрямыми антикоагулянтами в 14% случаев становится отмена ЛС, индуцирующих ферменты биотрансформации.
Ингибирование ферментов биотрансформации ЛС – угнетение активности ферментов метаболизма под действием ЛС и ксенобиотиков. Снижение активности ферментов биотрансформации ЛС под действием соответствующих ингибиторов ведет к повышению концентрации в крови ЛС (субстратов ферментов) и удлинению их периода полувыведения, что служит причиной развития токсичных побочных эффектов. Некоторые ингибиторы влияют сразу на несколько изоформ ферментов биотрансформации. - На этапе выведения существуют механизмы влияния на клубочковую фильтрацию, угнетения канальцевой секреции или секреции гепатоцитами в желчь (осуществляется с помощью транспортеров ЛС), изменения канальцевой реабсорбции.
Механизмы фармакодинамического взаимодействия
Клиническим проявлением фармакодинамического взаимодействия ЛС может быть антагонизм или синергизм. Синергичное или антагонистичное фармакодинамическое взаимодействие в зависимости от механизма, лежащего в его основе, может быть прямым и косвенным (непрямым, в частности на уровне функциональных систем) [27]. Например, у пациентов с фибрилляцией предсердий, которым проведено стентирование коронарных сосудов, назначается комбинация ацетилсалициловая кислота+клопидогрел+варфарин. При этом возможно фармакодинамическое взаимодействие на уровне системы гемостаза, результатом которого может быть клинически значимое кровотечение.
Взаимодействие ЛС с пищей, алкоголем и фитопрепаратами
ЛС могут вступать как в фармакокинетическое, так и в фармакодинамическое взаимодействие с пищей и алкоголем, что может существенно влиять на эффективность и безопасность получаемой терапии основных заболеваний. Например, сок и ягоды клюквы повышают антикоагулянтное действие варфарина. Сок грейпфрута за счет ингибирования CYP3A4 может повышать концентрацию статинов, блокаторов кальциевых каналов, иммуносупрессоров и других ЛС, повышая риск развития побочных эффектов [27].
Прямое фармакодинамическое взаимодействие на уровне транспортных медиаторных систем происходит при применении антидепрессантов из группы ингибиторов моноаминооксидазы (МАО) совместно с продуктами, богатыми симпатомиметиком тирамином. Под действием тирамина из окончаний симпатических нервов выбрасывается избыточное количество норадреналина, накапливающегося в результате угнетения МАО. При этом развивается выраженный гипертонический криз, который может сопровождаться делирием и нарушениями ритма работы сердца. Тирамин в больших количествах находится в некоторых сортах сыра (Камамбер, Чеддер, Моцарелла, Пармезан), соевом соусе, колбасе салями, куриной печени, квашеной капусте, бананах, авокадо, изюме, пиве, винах херес и рислинг. Перед назначением ингибиторов МАО больных следует предупредить о необходимости строго соблюдать соответствующую диету. Некоторые продукты питания могут вступать с ЛС в непрямое фармакодинамическое взаимодействие. Так, употребление продуктов с большим содержанием хлорида натрия (колбасы, ветчина, мясные и рыбные консервы, сало-шпик, соленая и копченая рыба и др.) может снизить гипотензивный эффект антигипертензивных ЛС (диуретиков, β-адреноблокаторов, блокаторов медленных кальциевых каналов, ингибиторов ангиотензинпревращающего фермента – АПФ и др.). Богатые калием продукты (сухофрукты, абрикосы, картофель «в мундире», бананы, фиги, апельсиновый сок и др.) могут спровоцировать гиперкалиемию при применении спиронолактона, ингибиторов АПФ, антагонистов ангиотензиновых рецепторов. Таким образом, пища может оказывать разнообразное влияние на фармакокинетику и фармакодинамику ЛС, что необходимо учитывать при проведении фармакотерапии [27].
Взаимодействие ЛС с фитопрепаратами
По данным разных авторов, от 20 до 30% больных, длительно получающих те или иные ЛС, дополнительно самостоятельно принимают различные безрецептурные лекарственные препараты и биологически активные добавки, содержащие растительное сырье (фитопрепараты). Из них лишь 20–25% сообщают об этом своему лечащему врачу. Взаимодействие ЛС с лекарственными растениями изучено недостаточно. Для предупреждения развития побочных лекарственных эффектов и предотвращения снижения эффективности ЛС, которые могут стать следствием подобных взаимодействий, при проведении фармакотерапии врач должен активно собирать информацию от больного о применении им фитопрепаратов [27, 28]. Возможно и врачебное назначение фитопрепаратов узкими специалистами, часто считающими, что «природное» происхождение ЛС является синонимом и гарантией его безопасности. Так, чаще всего фитопрепараты рекомендуют детям, пожилым людям, а также женщинам в период беременности и лактации или климактерическом периоде. Наиболее типичным показанием являются тревожность, депрессия, деменция, снижение памяти и умственной работоспособности, болевой синдром, мигрень, доброкачественная гиперплазия предстательной железы [27, 28].
В основном в состав фитопрепаратов входят:
- гинкго билоба (Gincgo biloba);
- зверобой продырявленный (Hypericum perforatum);
- жень-шень (Panax spp.);
- чеснок (Allium sativum);
- эхинацея (Echinacea spp.);
- карликовая пальма (Serenoa palmetto);
- кава-кава (Piper methysticum).
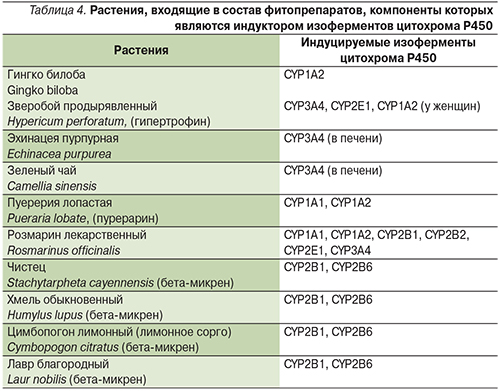
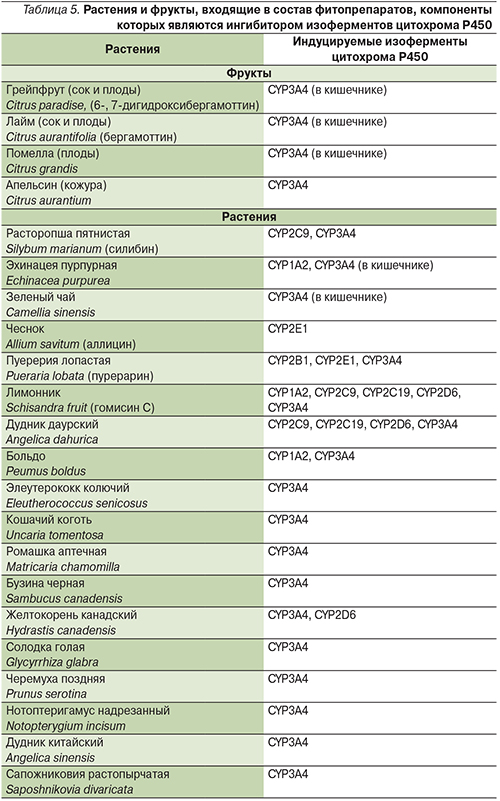
Взаимодействие ЛС с фитопрепаратами может быть как фармакокинетическим, так и фармакодинамическим и осуществляться на различных уровнях. Наиболее хорошо изучено фармакокинетическое взаимодействие между ЛС и фитопрепаратами на уровне биотрансформации. В исследованиях in vitro и in vivo продемонстрировано влияние различных лекарственных растений на активность изоферментов цитохрома Р450 (ингибирование и индукция). Фитопрепараты, содержащие перечисленные в табл. 4, 5 растения, влияют на фармакокинетику ЛС, метаболизирующихся данными изоферментами.
В половине случаев побочные эффекты возникают при совместном применении ЛС с фитопрепаратами, содержащими зверобой или гинго билоба. Так, прием зверобоя снижает эффективность дигоксина, непрямых антикоагулянтов, циклоспорина, амитриптилина, индинавира. Возможно повышение концентрации теофиллина в крови, высок риск кардиотоксического эффекта. При приеме антидепрессантов из группы ингибиторов обратного захвата серотонина больным категорически противопоказаны препараты зверобоя. Другой частый вариант неблагоприятного взаимодействия – препарат гинго билоба, причем не только с точки зрения изменения активности ферментов цитохрома Р450 (является индуктором и делает бессмысленным назначение препаратов, метаболизирующихся этим ферментом), но и фармакодинамического эффекта – ингибирования фактора активации тромбоцитов. Поэтому при назначении непрямых антикоагулянтов (варфарина, ривароксабана, апиксабана) и антиагрегантов (аспирина, клопидогрела, тикагрелора) с препаратами гинго билоба, чеснока или дягиля следует соблюдать особую осторожность и тщательно контролировать показатели свертывания крови (международное нормализованное отношение, активированное частичное тромбопластиновое время), т.к. подобные комбинации могут приводить к геморрагическим осложнениям и серьезным последствиям кровотечений (в т.ч. внутримозговых). Многие фитопрепараты (особенно выпускаемые как таблетки для похудения) содержат слабительные лекарственные растения (сенна, сабур, крушина, жостер, алоэ), при этом увеличение скорости пассажа кишечного содержимого может уменьшать биодоступность многих ЛС и снижать эффективность фармакотерапии, применяемой для лечения основных заболеваний.
Что делать лечащему врачу, или Правила профилактики нежелательных взаимодействий
Основные правила, позволяющие врачу избегать нежелательных взаимодействий ЛС:
- При назначении нескольких ЛС необходимо ознакомиться с разделом «Взаимодействие с другими ЛС» инструкции по применению ЛС, всегда учитывать эту информацию при выборе ЛС.
- При выборе ЛС врачу необходимо учитывать уже назначенные другими специалистами препараты.
- Врачу необходимо согласовывать назначения ЛС со всеми специалистами, консультирующими данного пациента по разным заболеваниям.
- При назначении ЛС необходимо уточнять, активно расспрашивать пациентку, какие БАД или витамины принимает пациент.
- Коморбидным пациентам, уже получающим постоянную терапию, выбирать заведомо безопасные ЛС с минимальными рисками или в идеале – с отсутвием возможного межлекарственного взаимодействия.
Для поиска информации о взаимодействии ЛС можно воспользоваться специально созданными компьютерными программами (некоторые из них размещены в свободном доступе в Интернете и функционируют в режиме on-line), позволяющими ввести ЛС, которые планируется назначать больному, и получать возможные нежелательные взаимодействия (например, раздел «Interactions cheсker» сайта www.drugs.com, с помощью которого можно не только прогнозировать взаимодействия ЛС, но и получать практические рекомендации по их профилактике. Ресурс регулярно обновляется и доступен бесплатно.
Однако во многих клинических ситуациях все специалисты (неврологи, кардиологи, эндокринологи, пульмонологи, нефрологи и др) имеют дело, как правило, с традиционным набором одних и тех же заболеваний. Это как раз самые распространенные, имеющие наибольший вклад в заболеваемость и смертность современного человека коморбидные состояния – АГ, аритмия, ХБП, атеросклероз, СД, нарушение когнитивных функций, деменция, перенесенные инсульт и инфаркт. Все эти состояния влияют на прогноз пациента и требуют постоянной терапии традиционными для них ЛС: антигипертензивными, статинами, антиагрегантами, антикоагулянтами, сахароснижающими, антиаритмическими и, конечно, влияющими на когнитивные функции. Как правило, каждый специалист назначает «свои» препараты, не оценивая их сочетаемость с уже назначенной базовой терапией и не меняя последнюю. Например, невролог не будет вмешиваться в сахароснижающую терапию, несмотря на то что многие эффекты данной терапии могут ухудшать клиническое течение неврологических заболеваний, в частности когнитивной функции, о чем не всегда догадывается эндокринолог. Но что же может в данной ситуации невролог? Безусловно, точно может подобрать безопасные препараты для лечения данного пациента с учетом уже принимаемой терапии. Для этого не нужно долго искать данные в интернет-сервисах или погружаться в длительное чтение всей новой информации по клинической фармакологии ЛС, достаточно знать несколько препаратов с универсальным или специальным действием, хорошей доказательной базой и главное – всегда абсолютно безопасных для применения в любой ситуации и любым самым сложным коморбидным пациентом. Такие препараты есть в неврологии, но их немного.
Вариант безопасной терапии
Один из немногих препаратов в неврологии, обладающий достаточной доказательностью в плане не только эффективности, но и безопасности – Церебролизин. Сегодня это единственный пептидергический препарат с доказанной in vitro и in vivo нейронспецифической нейротрофической активностью, аналогичной действию собственных нейротрофических факторов роста нейронов [29–32].
Церебролизин представляет собой комплекс биологически активных олигопептидов (20–25%) и аминокислот (75–80%), полученных из головного мозга свиньи. Современные технологии производства также позволяют сохранить в составе препарата макроэлементы, эссенциальные микроэлементы. В препарате содержится более 100 биологически активных олигопептидов, которые обладают структурным сходством со следующими нейротрофическими факторами: цилиарный нейротрофический фактор (CNTF), нейротрофический фактор глиальных клеток (GDNF), инсулиноподобные факторы роста-1 и -2 (IGF-1, IGF-2), фактор роста нервов (NGF) [29, 37]. В результате комплексного анализа состава препарата также были обнаружены пептидные фрагменты энкефалинов, нейропептида VF, орексина и галанина [29]. Помимо нейропептидов в Церебролизине выделяют активную фракцию аминокислот, обладающую суммарным полифункциональным действием. Препарат строго стандартизирован по концентрации аминокислот в 1 мл препарата. Первоначально считалось, что эти аминокислоты несут только общетрофическую нагрузку, представляя собой материал для построения белков. Сейчас получены новые знания о нейропротективных и регенераторных свойствах отдельных аминокислот, входящих в состав Церебролизина. Так, гистидин предотвращает апоптоз нейронов, обладает иммуномодулирующими свойствами; метионин обеспечивает антиоксидантную нейропротекцию; лизин участвует в формировании коллагена и восстановлении тканей, ингибирует эксайтотоксичность [30]. Свой вклад в активацию процессов нейропротекции и нейрорегенерации также вносят микро- и макроэлементы, содержащиеся в препарате. Макроэлементы представлены Na, K, P, Ca, Mg; эссенциальные микроэлементы – Zn, Co, Se, Mn, Li. Данные элементы находятся в препарате в виде комплексов с лигандами, аналогичными естественным транспортерам, поэтому они легче проникают через гематоэнцефалический барьер и усваиваются нейронами [29, 30].
Несмотря на такой многокомпонентный состав, препарат совместим почти со всеми препаратами, применяющимися пациентами с коморбидными заболеваниями. Однако, согласно инструкции по применению [40], с учетом фармакологического профиля Церебролизина следует уделить особое внимание следующим факторам:
- возможным аддитивным эффектам при совместном применении с антидепрессантами или ингибиторами МАО. В таких случаях рекомендуется снизить дозу антидепрессанта. Применение высоких доз Церебролизина (30–40 мл) в сочетании с высокими дозами ингибиторов МАО может вызывать повышение артериального давления.
- Не следует смешивать в одном растворе для инфузий Церебролизин и сбалансированные растворы аминокислот, а также препараты, улучшающие сердечное кровообращение.
- Церебролизин не совместим с растворами, в состав которых входят липиды, и с растворами, изменяющими рН среды (5,0–8,0).
Эффективность Церебролизина обеспечивается динамическим улучшением следующих процессов:
- нейропротекции (за счет активации механизмов защиты от повреждения);
- нейропластичности (за счет стимуляции роста аксонов, синаптогенеза, ангиогенеза, реорганизации функциональных зон мозга);
- нейрогенеза (за счет стимуляции роста нейронов и клеток глии из стволовых клеток);
- нейротрофической регуляции, которая обеспечивает координацию и поддержание данных процессов на оптимальном уровне [31, 32].
Надежный современный контроль безопасности и минимально выраженный процент побочных эффектов, возможность длительного применения для пациентов всех возрастных групп выгодно отличают данный препарат от других ноотропных средств. Помимо этого необходимо подчеркнуть, что Церебролизин получается на основе совершенной технологии, гарантирующей отсутствие возможности переноса «прионовых болезней» [29, 30].
Результаты многочисленных исследований, проведенных по стандартам GCP (Good Clinical Practice), мета-анализов рандомизированных двойных слепых контролируемых исследований, показали, что Церебролизин эффективно влияет на уровень общего функционирования, активности в повседневной жизни и, конечно, на улучшение когнитивных функций как у мужчин, так и у женщин [33–35, 38, 39]. На сегодняшний день Церебролизин включен в 11 утвержденных стандартов оказания медицинской помощи в РФ: при болезни Альцгеймера, сосудистой деменции, лечении острой или хронической недостаточности кровоснабжения головного мозга, консервативном лечении внутримозгового и субарахноидального кровоизлияния и т.д. Рекомендуемый курс лечения Церебролизином для снижения когнитивных нарушений на фоне коморбидных сердечно-сосудистых заболеваний от 5 мл внутримышечно или от 10 мл внутривенно ежедневно в течение 15 или 5 дней в неделю на протяжении 3 недель.
В постинсультном периоде – по 30 мл/сут внутривенно в течение 21 дня.
Сегодня Церебролизин, эффективно поддерживая естественные репаративные процессы в нервной системе, является базовым безопасным средством, широко применяемым при различных неврологических заболеваниях или травмах у пациентов любого возраста.



