Бисфосфонаты (БФ) активно используются в медицине с конца 1960-х гг., хотя первый БФ (этидронат) был синтезирован более 100 лет назад – в 1897 г. H. von Baeyer и K.S. Hoffmann. БФ относятся к дифосфоновым кислотам и являются синтетическими аналогами пирофосфатов, а структурное сходство с гидроксиапатитом кости делает их устойчивыми к химическому и ферментативному гидролизу, способными адсорбироваться на поверхности гидроксиапатитных кристаллов. БФ длительно сохраняются в кости, оставаясь в ней до 10 лет и более, пока старая кость не заменится новой в ходе постоянно протекающего процесса костеобразования. Особенности их фармакокинетики и фармакодинамики определили широкое применение БФ при заболеваниях, связанных с нарушением метаболизма костной ткани, таких как остеопороз (ОП), болезнь Педжета, метастатическое поражение костной ткани при онкологических заболеваниях, миеломная болезнь.
Широкое использование БФ при ОП началось с 1995 г., когда алендронат – первый пероральный азотсодержащий БФ, был зарегистрирован во всем мире для применения по этому показанию. Повсеместное применение БФ сыграло большую роль в снижении частоты переломов, особенно перелома проксимального отдела бедра, в различных популяциях.
Хотя БФ продемонстрировали хороший профиль безопасности в ходе рандомизированных клинических исследований (РКИ), в реальной клинической практике их прием ассоциировался с различными нежелательными явлениями (НЯ), которые могли быть связаны как с БФ, так и с одновременным
приемом других препаратов или сопутствующими заболеваниями у конкретного больного. Переносимость БФ в значительной степени зависит от дозы и режима введения препарата. Для терапии ОП используются невысокие дозы БФ, при которых частота НЯ и их выраженность довольно небольшие. Мы остановимся на наиболее значимых, а также “спорных” НЯ, с которыми могут столкнуться врачи в своей повседневной работе при назначении БФ.
Острофазовые реакции
От 10 до 30 % пациентов после проведения первой инфузии БФ испытывают проявления острофазовых реакций (ОФР): повышение температуры, общее недомогание, миалгии, артралгии, боли в костях [1, 2]. Причиной развития ОФР является транзиторное повышение уровня пирогенных
цитокинов, таких как интерлейкин-6 (ИЛ-6) и фактор некроза опухоли α, за счет активации γδ-Т-лимфоцитов и развития Th1 иммунного ответа [3, 4]. Эти явления возникают через 1–3 дня после введения препарата и могут продолжаться до 7–14 дней, однако их частота и выраженность резко снижаются при последующих инфузиях. Проявления ОФР купируются приемом нестероидных противовоспалительных препаратов (НПВП) или парацетамола. При применении пероральных БФ подобные реакции возникают во много раз реже и их проявления менее выражены.
Мышечно-скелетные боли
Применение БФ в некоторых случаях сопровождается появлением выраженных болей в костях, суставах, мышцах и развитием синовитов, которые по своей клинической картине отличаются от ОФР. Основные различия заключаются в том, что данные симптомы имеют тенденцию к более длительному течению и могут возникать как в начале лечения, так и спустя несколько лет. Прекращение приема БФ, как правило, приводит к исчезновению указанных явлений, однако некоторые пациенты отмечают их затяжное течение или неполное купирование [5].
Причина возникновения таких болей в настоящее время не ясна. Существует несколько гипотез, объясняющих их развитие. Так, у некоторых пациентов помимо ОП могут выявляться признаки
дефицита витамина D, в т. ч. и остеомаляция. В некоторых случаях лечение БФ также может сопровождаться развитием вторичного гиперпаратиреоза. Повышенный уровень паратиреоидного гормона (ПТГ) приводит к усилению костного обмена и относительно избыточному локальному накоплению БФ. Увеличение уровня ПТГ и концентрации БФ в костной ткани в ряде случаев может стимулировать синтез провоспалительных цитокинов, например ИЛ-6, что в свою очередь приводит к
развитию воспалительной реакции [6]. В любом случае возникновение подобных симптомов требует анализа ситуации и решения вопроса о возможном прекращении терапии БФ.
Поражение желудочно-кишечного тракта
Лечение пероральными формами БФ может сопровождаться различными симптомами со стороны верхних отделов желудочно-кишечного тракта (ЖКТ): диспепсия, тошнота, боли в эпигастрии. В постмаркетинговых исследованиях выявлены случаи эрозивного и язвенного поражения пищевода. Однако при анализе возникших НЯ было отмечено, что наиболее серьезные осложнения происходили в случаях несоблюдения инструкций по применению препарата: прием БФ на фоне уже существующего поражения пищевода, принятие горизонтального положения непосредственно после приема таблетки; некоторые пациенты вообще не запивали препараты или запивали небольшим количеством воды.
Анализ данных многоцентровых РКИ свидетельствует, что при условии соблюдения правил приема препарата поражение верхних отелов ЖКТ при приеме пероральных форм БФ встречается с той же частотой, что и в общей популяции. Так, в одном из наиболее показательных исследований эффективности алендроната как средства профилактики переломов (FIT) пациенты принимали 5 или 10 мг препарата ежедневно на протяжении около 4 лет. Общая частота НЯ со стороны верхних отелов ЖКТ составила 47,5 % в основной группе и 46,2 % в группе плацебо (р > 0,05). Частота таких серьезных НЯ, как язвы, кровотечения и перфорации желудка, также незначимо различалась между группами (1,6и 1,9 % соответственно). Частота НЯ, непосредственно связанных с поражением пищевода, составляла 10 % в группе принимавших алендронат и 9,4 % в группе плацебо, при этом различия были статистически недостоверными [7]. Более того, использование БФ 1 раз в неделю или месяц приводит к снижению частоты встречаемости НЯ со стороны ЖКТ [8, 9].
Как правило, пациенты, страдающие ОП, имеют ряд сопутствующих заболеваний, требующих назначения препаратов, потенциально способных вызывать поражение ЖКТ. Так, Cryer и соавт. провели трехмесячное исследование безопасности алендроната 70 мг 1 раз в неделю по сравнению с плацебо для пациентов, принимавших НПВП. Авторы не выявили повышения частоты поражения верхних отделов ЖКТ среди лиц, получавших алендронат, по сравнению с группой плацебо (9,3
и 10,8 % соответственно) [9]. Следует отметить, что при проведении РКИ осуществляется тщательный отбор пациентов с учетом критериев включения и исключения, причем критерии исключения соответствуют противопоказаниям, отмечаемым в инструкциях по применению пероральных БФ.
Таким образом, при соблюдении имеющихся рекомендаций назначение БФ существенно не будет влиять на риск поражения верхних отделов ЖКТ.
Поскольку БФ могут оказывать влияние на слизистую оболочку верхних отелов ЖКТ, особенно на фоне
сопутствующего поражения пищевода, определенное внимание было уделено случаям возникновения аденокарциномы пищевода у лиц, принимающих пероральные БФ. Однако на основании выявленных случаев рака пищевода сделать вывод об их связи с БФ не представлялось возможным, поскольку отсутствовала информация о других факторах риска для этих пациентов, не было данных о распространенности аденокарциномы пищевода в изучаемых популяциях, отсутствовала группа
контроля [10].
В 2010 г. опубликованы 2 независимые работы, в которых была проанализирована база данных общей практики Великобритании, содержащая информацию о длительном использовании пероральных БФ 6 млн пациентов. В одной из работ было обнаружено, что частота рака пищевода в 2 раза выше среди лиц, кому 10 раз и более выписывался рецепт на пероральные БФ, или они получали рецепты на БФ в течение в среднем 5 лет [11]. Заболеваемость раком пищевода в странах Европы и Северной Америки, по данным ВОЗ, составляет 1/1000 человек в возрасте 60–79 лет в течение 5-летнего периода, следовательно, даже увеличение этого показателя до 2/1000 человек не имеет клинической значимости ввиду низкой частоты встречаемости. Одновременно другое исследование, проведенное с использованием той же базы данных, но с периодом наблюдения, составившим в среднем 4,5 года,
не выявило увеличения риска рака пищевода [12]. Следует особо отметить, что не было обнаружено связи между приемом БФ и раком желудка, а также толстого кишечника [11].
D.H. Solomon и соавт. проанализировали аналогичную американскую базу данных US Medicare, но не выявили различий в заболеваемости раком пищевода между лицами, принимавшими БФ по поводу ОП, по сравнению с теми, кто принимал другие препараты, а также с общей популяцией [13]. Еще одно исследование в Дании, в котором оценивался риск рака пищевода для лиц, перенесших переломы,
показало даже более низкий его риск среди лиц, получавших БФ в среднем 2,8 года, по сравнению с теми, кто их не получал [14]. У пациентов с эзофагитом Барретта, получавших терапию БФ, также не было отмечено увеличения риска аденокарциномы пищевода [15].
Таким образом, в настоящее время нет убедительных данных, свидетельствующих о возможном риске развития рака пищевода при приеме БФ, однако пациентам, находившимся на терапии БФ, у которых развилась симптоматика дисфагии или появились боли в верхних отделах ЖКТ, рекомендуется проводить эзофагогастродуоденоскопию.
Фибрилляция предсердий
С момента введения БФ в терапевтическую практику в качестве антирезорбтивных средств и на протяжении многих лет их применения ни разу не поднимался вопрос о влиянии БФ на риск развития фибрилляции предсердий (ФП). Впервые сообщение о повышенной частоте нарушений ритма сердца были получены при анализе НЯ при назначении золедроновой кислоты 1 раз в год (исследование
HORIZON-РFT) [16]. Различия касались прежде всего нарушений ритма, рассматриваемых в качестве серьезных НЯ, т. е. требующих госпитализации, или фатальных. Исследователи также обратили внимание на то, что почти все эти эпизоды регистрировались в среднем спустя месяц после введения
препарата, когда золедроновая кислота в системном кровотоке уже не определялась. В другом РКИ по эффективности применения золедроновой кислоты больными после перелома бедра (HORIZON-RFT) анализ полученных данных не выявил повышения частоты ФП в группе лечения (1,1 %) по сравнению с группой плацебо (1,3 %) [17].
Результаты исследования HORIZON-РFT впервые затронули тему возможной причинно-следственной связи межу приемом БФ и возникновением ФП. Поскольку нарушения ритма сердца могут выступать в качестве серьезных НЯ или вызывать фатальные последствия, были проведены ретроспективные анализы исследований и других БФ, однако не было получено четких доказательств повышения
частоты ФП по сравнению с плацебо в группе лиц, принимавших алендронат (относительный риск [ОР] = 1,14; 95 % доверительный интервал [ДИ]: 0,83, 1,57; р > 0,05) [18]. Популяционный ретроспективный анализ национальной медицинской базы данных Дании также не обнаружил влияния БФ на риск ФП. Не было отмечено повышения риска развития ФП среди лиц, принимавших алендронат или этидронат,
по сравнению с никогда не принимавшими их (ОР = 0,95; 95 % ДИ: 0,84, 1,07; р > 0,05); кроме того не было выявлено связи между количеством (10 и более) назначений алендроната и ФП (ОР = 0,90; 95 % ДИ: 0,79, 1,03; р > 0,05) [19]. В то же время опубликованные к настоящему моменту четыре мета-анализа, включившие РКИ и популяционные исследования, имеют противоречивый характер: в двух из них авторы выявили повышение риска ФП при терапии БФ, в двух других – нет [20–23]. Таким
образом, в настоящее время нет убедительных данных, однозначно свидетельствующих о повышении риска ФП на фоне терапии БФ.
В 2008 г. FDA, проведя анализ различных работ, сделало заявление, что результаты клинических исследований не подтвердили однозначную связь между приемом БФ и возникновением ФП, соответственно, рекомендовало клиницистам следовать инструкциям по применению препаратов, а пациентам продолжать прием БФ [24].
Остеонекроз челюсти
Остеонекроз челюсти (ОНЧ) на фоне приема БФ определяется как патологическое состояние, характеризующееся обнажением некротизированной кости в челюстно-лицевой области, которое продолжается не менее 8 недель. Клинически ОНЧ проявляется дефектом слизистой оболочки с гладкими или неровными краями и обнажением костной ткани. ОНЧ может сопровождаться припухлостью, болью, парастезиями, появлением изъязвлений, нагноением мягких тканей, потерей зубов, при этом на начальных стадиях симптоматика может быть достаточно скудной. Диагноз ставится при визуальном осмотре и на основании клинических данных. Применение лучевых методов существенно расширяет возможности диагностики и позволяет ставить диагноз на ранних стадиях [25].
В 2002 г. FDA получило сообщения о нескольких случаях развития ОНЧ в процессе лечения золедроновой кислотой пациентов с онкологическими заболеваниями [26]. В последующие годы зарегистрированы новые случаи развития ОНЧ у лиц, получавших БФ. В настоящее время нет данных о частоте этой патологии в общей популяции. Однако имеются данные о развитии БФ-ассоциированного ОНЧ при различных заболеваниях. Так, частота ОНЧ при терапии ОП или болезни Педжета составляет от 1/10 тыс. до < 1/100 тыс. человеко-лет. У пациентов, страдающих онкологическими заболеваниями, частота ОНЧ значительно выше и может достигать от 1 до 10/100 человеко-лет [25]. Отчасти подобные различия могут объясняться особенностью применения БФ при терапии онкологических больных.
Для развития ОНЧ имеет значение как длительность проводимой терапии, так и способ введения препарата. Например, инфузионные формы БФ чаще ассоциируются с риском развития ОНЧ по сравнению с пероральными препаратами, при применении которых он очень мал и может реализоваться скорее всего при лечении более 3 лет [27].
Наиболее часто процесс ОНЧ локализуется в нижней челюсти. Так, по данным S.B. Woo и соавт., 65 % случаев приходилось на поражения нижней челюсти, 26 % – верхней и лишь в 9 % изменения затрагивали обе челюсти, при этом у трети лиц процесс протекал безболезненно [28].
Выделяют следующие основные факторы риска ОНЧ: лучевая терапия области лица и шеи, заболевания периодонта, стоматологические хирургические манипуляции, постоянная травматизация слизистой оболочки полости рта плохо подогнанными зубными протезами. К дополнительным факторам риска относят злокачественные заболевания, химиотерапию, применение глюкокортикоидов, системную или региональную инфекцию. Считается, что в качестве факторов риска могут выступать также сахарный диабет, злоупотребление алкоголем, курение, плохая гигиена полости рта. Пациенты с воспалительными заболеваниями полости рта в анамнезе, такими как периодонтит и абсцесс, имеют в 7 раз более высокий риск развития ОНЧ [27].
Профилактика ОНЧ включает осмотр стоматологом перед назначением БФ и каждые 6 месяцев в процессе лечения. Если у пациента предполагаются инвазивные лечебные процедуры, то по возможности БФ должны назначаться после этих вмешательств.
В настоящее время нет однозначного объяснения развития ОНЧ у лиц, получающих БФ. Более того, некоторые авторы считают связь между терапией БФ и развитием ОНЧ недоказанной [29, 30].
Механизм развития ОНЧ может быть вызван двумя факторами. Известно, что костный обмен в костях челюсти повышен на 10–20 % по сравнению с остальным скелетом, что обусловлено необходимостью быстрого замещения микроповреждений новой костной тканью на фоне часто повторяющихся механических воздействий. Относительно высокий уровень обмена требует хорошей васкуляризации, что в конечном итоге может обусловливать и более высокую концентрацию БФ именно в данной
области. С другой стороны, слизистая оболочка полости рта довольно тонкая и постоянно подвергается механическим воздействиям, что также может способствовать развитию локальной
инфекции при соответствующих условиях. БФ снижают скорость метаболизма костной ткани, а при повышенной концентрации последних это может приводить к избыточному локальному подавлению костного обмена и, соответственно, накоплению микроповреждений. В случае присоединения
местной инфекции создаются дополнительные предпосылки к развитию ОНЧ. Определенное значение имеют и генетические факторы [31–33].
В 2011 г. вышли рекомендации Американской ассоциации дантистов, в которых указывается, что распространенность ОНЧ, ассоциированного с применением антирезорбтивной терапии ОП и профилактики переломов, составляет всего лишь 0,1 %. В связи с тем что в настоящее время нельзя
заранее определить лиц, у которых впоследствии разовьется ОНЧ, лечение БФ необходимо назначать всем нуждающимся в нем пациентам, однако следует проводить регулярную санацию ротовой полости. Отмена антирезорбтивной терапии может не снижать риска развития ОНЧ, но в то же время может негативно сказаться на лечении основного заболевания [34].
Атипичные переломы
В литературе встречаются описания как отдельных клинических эпизодов, так и серий случаев т. н. атипичных переломов (АП) бедренной кости на фоне лечения БФ. Вместе с тем БФ являются препаратами первой линии лечения ОП, значимо снижающими риск остеопоротических переломов у
мужчин и женщин. Подобное противоречие вызывает ряд вопросов, связанных с безопасностью проводимой терапии и в некоторых случаях может ставить лечащего врача в тупик при выборе лечения. Для прояснения этой неоднозначной ситуации следует прежде всего остановиться на определении понятия “атипичный перелом”. К АП относят переломы, возникающие в подвертельной области и на 5 см ниже края малого вертела (см. рисунок). В некоторых случаях АП может возникать в средней трети бедренной кости. В отличие от АП “остеопоротический” перелом бедренной кости
возникает преимущественно в проксимальном отделе, в который входят шейка и межвертельный регион, что, впрочем, не исключает и другие локализации, в т. ч. характерные для АП (рис. 1).
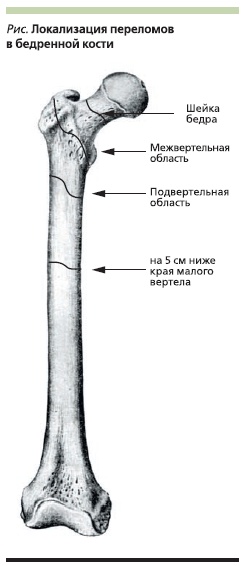
Выделяют большие и малые признаки АП (см. таблицу). Рентгенологическая картина, характерная для АП, может напоминать стрессовые переломы, также сопровождающиеся периостальной реакцией, остеосклерозом и поперечной линией перелома. В настоящее время патогенез АП при приеме БФ до конца не ясен и существуют лишь гипотетические объяснения возможных механизмов. По мнению некоторых авторов, БФ предположительно способны отрицательно влиять на формирование коллагена, что может уменьшать прочность кости, нарушать процессы минерализации, чрезмерно снижать уровень костного обмена [35–37]. Однако истинная роль этих механизмов, их значимость в развитии АП в настоящее время не выяснены.
Таблица. Признаки атипичных переломов.
Изучение АП представляет определенные трудности, связанные с редкостью их возникновения. Так, по данным 11-летнего исследования National Centre for Health Statistics and Market Scan [38], из всех переломов бедренной кости только 3 % приходилось на подвертельную область, 5 % – на среднюю
треть и 5 % – на дистальные отелы, в то время как 87 % составляли переломы проксимального отдела бедренной кости, типичные для ОП.
В литературе встречаются описания отдельных эпизодов и серий случаев АП при приеме алендроната, ризедроната, памидроната, ибандроната, золедроновой кислоты. Средняя продолжительность приема БФ составляла 7,3–7,5 лет. Нарастание сообщений о новых случаях АП заставило исследователей
провести анализ основных международных многоцентровых РКИ, уделив внимание АП, которые могли быть связаны с приемом БФ. Так, по сравнению с плацебо ОР АП составил 1,03 (95 % ДИ: 0,1, 16,5; р = 0,98) у лиц, принимавших алендронат в исследовании FIT, и ОР = 1,3 (95 % ДИ: 0,1, 14,7; р = 0,82)
при пролонгированном его приеме в исследовании FLEX. Для золедроновой кислоты (HORIZON-PFT) ОР = 1,5 (95 % ДИ: 0,3, 9,0; р = 0,65). Полученные данные свидетельствуют об отсутствии значимого влияния БФ на риск АП. Однако интерпретация этих результатов имеет ограничения, обусловленные
небольшим числом случаев АП, возникших в период проведениях указанных исследований.
В основных РКИ эффективности ибандроната было выявлено 9 АП, однако все они были связаны с травматическим воздействием, в то же время 5-летний постмаркетинговый анализ приема ибандроната в режиме 150 мг 1 раз в месяц или 3 мг внутривенно 1 раз в 3 месяца не выявил ни одного
случая АП [39].
Низкая частота АП, отмеченная в многоцентровых РКИ, не позволила провести полноценный анализ связи терапии БФ с риском АП. Для сопоставления случаев АП с приемом БФ были использованы более крупные базы данных, основанные на результатах постмаркетинговых наблюдений и данных фармконтроля, которые также продемонстрировали низкую частоту подвертельных переломов (1–3/1 млн человеко-лет) при применении как пероральных, так и парентеральных форм БФ [40–42].
В 2010 г. FDA США представило доклад, согласно которому не обнаружено четкой и однозначной связи
между приемом БФ и риском АП. FDA рекомендовало лечащим врачам продолжить назначение БФ согласно официальным показаниям [43], т. к. положительный эффект БФ, направленный на снижение риска остеопоротических переломов, существенно превышает риск возникновения АП. В связи с
тем что АП являются очень редким, потенциально возможным осложнением применения БФ, пациенты должны находиться под динамическим наблюдением, при этом лечащему врачу следует обращать особое внимание на появление необъяснимых болей в области бедер и в случае необходимости
проводить рентгенологическое обследование. Особое внимание следует уделять пациентам, длительно – свыше 5 лет – принимающим БФ, а в случае возникновения стрессового перелома необходимо рассматривать целесообразность дальнейшей терапии БФ.
Токсическое влияние БФ на почки
Токсическое влияние БФ на почки при лечении ОП отмечается крайне редко, оно практически не характерно для пероральных БФ при условии соблюдения соответствующих инструкций. Перед назначением препаратов и в процессе лечения необходим мониторинг функции почек, особенно людям старше 80 лет. Согласно рекомендациям FDA, БФ не должны назначаться при клиренсе креатинина менее 35 мл/мин.
Поражение глаз
Среди НЯ поражение глаз встречается довольно редко. В клинической практике наиболее характерно возникновение конъюнктивитов, которые протекают в мягкой форме и очень быстро купируются на фоне локальной терапии. Значительно реже отмечено возникновение увеита, периорбитального отека, неврита зрительного нерва. Во всех этих случаях необходима отмена препарата и консультация офтальмолога.
В заключение необходимо еще раз отметить, что БФ в настоящее время относятся к препаратам первой линии в терапии ОП. Их применение в клинической практике позволяет существенно снижать риск переломов. Серьезные побочные эффекты на фоне терапии БФ возникают очень редко, а соблюдение инструкции по использованию позволяет сводить их к минимуму. В целом применение БФ рассматривается в качестве современного безопасного и эффективного лечения.



