Артериальная гипертензия (АГ) в Российской Федерации остается одной из наиболее значимых медико-социальных проблем. Это обусловлено широким распространением данного заболевания – около 40 % взрослого населения РФ имеет повышенный уровень артериального давления (АД) [1, 2]. АГ является причиной ряда грозных осложнений, в т. ч. терминальной почечной недостаточности, требующей проведения гемодиализа; инфаркта миокарда, хронической сердечной недостаточности, внезапной смерти, инсульта (ишемического или геморрагического), а также сосудистой деменции [1].
Развитию этих осложнений предшествует бессимптомное поражение соответствующих органов-мишеней – почек (микроальбуминурия), сердца (гипертрофия миокарда левого желудочка), головного мозга [1]. К сожалению, стандартный план диагностики у больного АГ не включает обследование головного мозга как органа-мишени АГ, поэтому в клинической практике врач констатирует его поражение уже на этапе развития осложнений (инсульта и/или деменции).
Субклинические поражения головного мозга (поражения головного мозга как органа-мишени АГ) отмечены среди 44 % больных АГ, что примерно в 2 раза превышает распространенность поражения сердца и почек как органов-мишеней АГ [3]. Проявлениями поражения головного мозга как органа-мишени АГ считают когнитивные расcтройства и лейкоареоз и/или “немые” лакуны, выявляемые при магнитно-резонансной томографии (МРТ) головного мозга [3–5]. В рекомендациях по диагностике и лечению АГ впервые о необходимости выявления субклинических поражений головного мозга как органа-мишени АГ говорится лишь в 2009 г. в согласительном документе Европейского общества по АГ [4].
Поэтому для выявления поражения головного мозга как органа-мишени АГ требуются специальные методы диагностики. Наиболее полное и точное представление о наличии и выраженности поражения головного мозга можно получить с использованием нейровизуализации – компьютерной томографии (КТ) и МРТ головного мозга [5]. Лейкоареоз визуализируется в виде двусторонних очаговых или диффузных областей пониженной плотности в белом веществе при КТ и Т1-взвешенных изображениях на МРТ или в виде областей повышенной плотности на Т2-взвешенных изображениях при МРТ [5]. При МРТ-исследовании в Т2-режиме могут выявляться мелкие очаги измененного МР-сигнала, чаще локализующиеся в базальных ядрах или в глубоких отделах белого вещества полушарий и соответствующие гипертоническим малым глубинным (лакунарным) инфарктам. Кроме того, выявляются признаки атрофии коры больших полушарий.
Однако метод МРТ головного мозга в силу своей стоимости не может на сегодняшний день являться скрининговым для всех больных АГ. Поэтому метод исследования когнитивных функций представляется оптимальным по соотношению эффективность/стоимость для выявления поражения головного мозга как органа-мишени АГ. Следует отметить, что из клинических симптомов наиболее тесную взаимосвязь со степенью поражения белого вещества головного мозга (МРТ) имеют именно нарушения когнитивных функций [6].
Когнитивные (син.: высшие мозговые, высшие психические, высшие корковые, познавательные) функции – это наиболее сложные функции головного мозга, с помощью которых осуществляется процесс рационального познания мира и обеспечивается целенаправленное взаимодействие с ним [7]. К основным пяти когнитивным функциям относят гнозис (восприятие информации), праксис (произвольное, целенаправленное двигательное действие), речь, память и интеллект [7]. Согласно классификации Н.Н. Яхно (2005), выделяют легкие, умеренные и тяжелые когнитивные расстройства (КР) [7]. Легкие КР – снижение одной или нескольких когнитивных функций по сравнению с исходным более высоким уровнем (индивидуальной нормой), не влияющее на бытовую, профессиональную и социальную деятельность, в т. ч. на наиболее сложные ее формы. Умеренные когнитивные нарушения – это расстройства одной или нескольких когнитивных функций, которые выходят за рамки среднестатистической возрастной нормы, но не вызывают дезадаптации, хотя могут приводить к трудностям в сложных и непривычных для пациента ситуациях.
Необходимо понимать, что КР – это прогрессирующее состояние, которое со временем трансформируется в деменцию. Так, через один год у 5–15 % пациентов с умеренными КР разовьется деменция (для сравнения – в общей популяции вероятность ее развития составляет 1–5 %), а через 4 года таких пациентов будет уже 70 %, соответственно, через 5 лет деменции будут подвержены 100 % пациентов с когнитивными нарушениями [8, 9].
Тяжелые КР – расстройства когнитивных функций, которые приводят к полной или частичной утрате независимости и самостоятельности пациента, т. е. вызывают профессиональную, социальную и/или бытовую дезадаптацию. К тяжелым КР относится и деменция, в т. ч. сосудистая [7].
Сосудистая деменция, так же как и инсульт (ишемический и геморрагический), является уже осложнением АГ [1]. Согласно Международной классификации болезней 10-го пересмотра, деменцию диагностируют при нарушении памяти и по крайней мере одной из других когнитивных функций (речи, праксиса, гнозиса, мышления) при условии, что они затрудняют профессиональную деятельность или социальную адаптацию и сохраняются не менее 6 месяцев. Принципиальным отличием от легких и умеренных КР является наличие инвалидизации – невозможность продолжать профессиональную деятельность или социальная, в т. ч. бытовая, дезадаптация [10]. Особенно часто деменция отмечается в пожилом возрасте. Согласно популяционным исследованиям, от 5 до 20 % пожилых лиц имеют деменцию [11]. Деменция и преддементные КР обычно сочетаются с эмоциональными нарушениями, прежде всего в виде депрессивных и тревожно-депрессивных расстройств [7].
Инсульт является одним из самых частых и самых грозных осложнений АГ [1]. Когнитивные нарушения различной степени тяжести выявляются среди 40–70 % пациентов, перенесших инсульт, в среднем примерно у половины пациентов [12]. Распространенность деменции в первые 3–6 месяцев после инсульта колеблется от 5 до 32 %, а спустя 12 месяцев – от 8 до 26 % [13]. Более корректно постинсультную деменцию рассматривать как мультифакторное состояние, в развитии которого важную роль помимо самого инсульта может играть ряд других факторов (пожилой возраст, преморбидные когнитивные нарушения, дополнительная церебральная патология, АГ, сахарный диабет, сердечная недостаточность, мерцательная аритмия и т. д.) [14].
Всем пациентам с когнитивными нарушениями безусловно показано адекватное лечение заболеваний сердечно-сосудистой системы, в т. ч. АГ. Принципы ее лечения подробно описаны в Российских рекомендациях по диагностике и лечению АГ [1]. Следует подчеркнуть, что достижение целевого уровня АД должно быть планомерным и постепенным, т. к. слишком быстрое снижение АД может приводить к ухудшению перфузии головного мозга [1].
Коррекцию дисметаболических нарушений, лечение сердечно-сосудистой патологии и устранение депрессии можно отнести к “базовой терапии” КР, т. к. данные мероприятия показаны при любой выраженности и этиологии нарушений [7]. В отличие от этого выбор специфического лечения когнитивных нарушений определяется как стадией, так и особенностями патологического процесса.
На сегодняшний день не существует общепринятого протокола ведения пациентов с недементными (легкими и умеренными) когнитивными нарушениями [7]. Однако на практике нейропротективный эффект того или иного препарата доказать очень трудно, поскольку это требует многолетнего сравнительного наблюдения за параллельными группами пациентов с плацебо-контролем. Проведение таких исследований не всегда оправдано с экономической и этической точек зрения. Эмпирически при легких и умеренных когнитивных нарушениях различной этиологии чаще всего назначают препараты с вазоактивным и/или метаболическим эффектами [7, 15, 16].
Основными направлениями нейропротекции в лечении пациентов с cосудистыми заболеваниями головного мозга являются антиоксидантная терапия, торможение местной воспалительной реакции (применение антагонистов провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга, нейроиммуномодуляция, регуляция рецепторных структур [17]. Указанный многосторонний комплексный подход к лечению определяет целесообразность применения препаратов комбинированного действия.
Одним из таких лекарств, обладающих комплексным действием, является комбинированный препарат Вазобрал, представляющий собой комбинацию α-дигидроэргокриптина (алкалоида спорыньи) и кофеина. Дигидроэргокриптин обладает блокирующим действием в отношении α1- и α2-адренорецепторов, а также стимулирующим действием на дофаминовые и серотониновые рецепторы головного мозга, оказывает нейропротективный, антигипоксический и вазоактивный эффекты. Кофеин прежде всего повышает биодоступность дигидроэргокриптина, а также оказывает легкий стимулирующий эффект.
В исследовании A. Sim и соавт. показано, что Вазобрал на 180 % увеличивает число функционирующих капилляров [18]. Возможности Вазобрала в увеличении плотности капилляров имеют особое значение для больных АГ. Было установлено, что при АГ изменена (снижена) плотность капилляров и, таким образом, снижена перфузия тканей [19]. Кроме того, выявлено, что при применении Вазобрала интенсивность захвата глюкозы увеличивается на 40–50 %, а уровень мозгового кровообращения по сравнению с контролем повышается в среднем на 64 % [20]. А как известно, для головного мозга характерно интенсивное потребление глюкозы крови [21]. Ни один орган не поглощает глюкозу крови с такой скоростью и в таких количествах, как мозг, и ни для одной ткани организма не отмечено такой острой потребности в этом субстрате окисления для поддержания нормального функционального состояния. Головным мозгом потребляется до 70 % глюкозы, образующейся в печени и выделяющейся из нее в кровь [21]. Потребление глюкозы мозгом взрослого человека, рассчитанное по артериовенозной разнице, составляет в среднем 0,25–0,30 мкмоль-г/мин. Эти данные позволяют считать, что глюкоза является основным субстратом окисления в головном мозге [21].
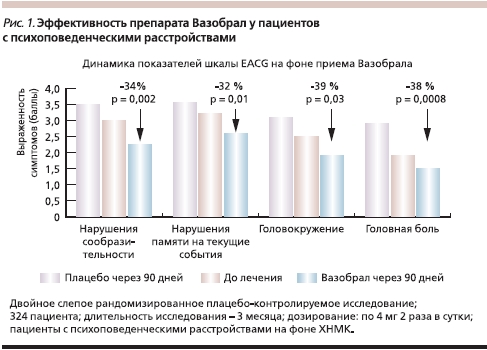
В клинических исследованиях доказано, что у пациентов, получавших Вазобрал, достоверно улучшаются когнитивные функции. Так, в двойном слепом рандомизированном плацебо-контролируемом исследовании, в котором на протяжении 3 месяцев наблюдали 324 пациента с психоповеденческими расстройствами на фоне хронической недостаточности мозгового кровообращения (ХНМК), на фоне лечения Вазобралом (в дозе по 4 мг 2 раза в сутки) достоверно улучшилась память на текущие события, ориентировка во времени и пространстве, а также регрессировали головокружение и головная боль (рис. 1) [22].
В другом двойном слепом плацебо-контролируемом исследовании клинической эффективности препарата Вазобрал в лечении 140 пациентов с когнитивными нарушениями (длительность терапии – 3 месяца; средний возраст – 63 года; 4 мг препарата Вазобрал 2 раза в сутки) обнаружено достоверное выраженное положительное влияние Вазобрала на запоминание и хранение полученной информации, достоверное улучшение кратковременной и долговременной памяти (рис. 2) [23]. На фоне лечения Вазобралом выявлено также улучшение зрительной памяти [24].

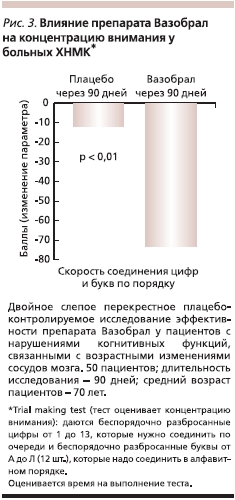
Было проведено двойное слепое перекрестное плацебо-контролируемое исследование эффективности препарата Вазобрал у пациентов с нарушениями когнитивных функций, связанными с возрастными изменениями сосудов мозга. В течение 90 дней наблюдали 50 пациентов, средний возраст которых составлял 70 лет. Констатировано достоверное улучшение параметров зрительной памяти, а также скорости когнитивных процессов [24]. В этом исследовании констатированы также достоверные различия в пользу Вазобрала по сравнению с плацебо по влиянию на концентрацию внимания (рис. 3) [24].
Особого внимания заслуживают результаты исследования И.В. Марченко, в котором приняли участие 30 пожилых пациентов с начальными проявлениями недостаточности мозгового кровообращения и дисциркуляторной энцефалопатией I стадии на фоне АГ (11 мужчин и 19 женщин, средний возраст – 73,1 ± 4,2 года). При монотерапии ингибиторами ангиотензинпревращающего фермента (эналаприл), блокаторами кальциевых каналов (нитрендипин) у пациентов был достигнут нормальный уровень АД, подтвержденный данными суточного мониторирования [25]. Больные получали Вазобрал по 2 мл 2 раза в сутки на протяжении 2 месяцев в амбулаторных условиях. После лечения достоверно (р < 0,001) уменьшился средний рейтинговый балл оценки выраженности субъективных симптомов: головной боли – на 44,0 %, головокружения – на 33,3 %, шума в голове – на 33,3 %, нарушений сна – на 38,5 %, повышенной утомляемости – на 36,4 %, снижения памяти – на 33,3 %. По результатам нейропсихологического тестирования на фоне терапии Вазобралом достоверно уменьшилось среднее время выполнения пробы Шульте (на 18,2 %; р < 0,01). Кроме того, отмечено увеличение аккуратности при выполнении пробы Бурдона, что выразилось в статистически значимом уменьшении частоты допускаемых ошибок на 39,2 % (р < 0,05). После лечения Вазобралом зафиксировано достоверное повышение речевой активности больных: увеличилось число слов при выполнении пробы на свободные ассоциации, называние глаголов и растений, при этом уменьшилось число допускаемых ошибок. Кроме того, увеличилось число семантических полей, что свидетельствует о снижении инертности психической деятельности. Для анализа динамики показателей памяти автор взял результаты первого и последнего непосредственных воспроизведений, результат отсроченного воспроизведения, а также время, необходимое для заучивания 10 слов, и время выполнения интерферирующей пробы на серийный счет. Отмечена статистически значимая положительная динамика всех перечисленных показателей: увеличилось число слов при первом и последнем непосредственном и отсроченном воспроизведениях на 11,9, 9,3, 17,7 % соответственно (р <0,05), уменьшились среднее время серийного счета и среднее время запоминания на 17,6 и 36,8 % [25]. Имеются данные и об эффективности Вазобрала у больных, перенесших инсульт [26, 27]. Так, по данным Т.Т. Батышевой и соавт. [26], препарат оказывал положительное влияние на память и другие интеллектуальные функции пациентов, перенесших инсульт.
Установлено, что весьма распространенной причиной когнитивных нарушений у лиц с сердечно-сосудистыми заболеваниями, в т. ч. и у пожилых, является депрессия, которая может быть как ситуативно обусловленной, так и связанной с органическим поражением головного мозга [7]. Депрессия наиболее характерна для хронической сосудистой мозговой недостаточности, болезни Паркинсона и других заболеваний с преимущественным поражением подкорковых базальных ганглиев [7]. В случае одновременного наличия как эмоциональных, так и когнитивных нарушений лечение советуют начинать с коррекции депрессии [7]. При лечении депрессии в пожилом возрасте следует избегать препаратов с клинически значимым холинолитическим эффектом, таких как трициклические антидепрессанты, поскольку они оказывают негативное воздействие на когнитивные функции. Напротив, селективные антагонисты обратного захвата серотонина или селективные антагонисты обратного захвата серотонина и норадреналина способствуют улучшению высшей нервной деятельности [7]. Также возрастает значение препаратов нейропротективного действия, обладающих помимо прочих и свойствами, уменьшающими эмоциональные расстройства. Например, в работе А.С. Аведисовой и соавт. [28], проводивших исследование Вазобрала в течение 6 недель, показано статистически достоверное позитивное влияние препарата на самочувствие больных, их активность и настроение (по балльной оценке шкалы САН – Самочувствие, Активность, Настроение), что, по мнению исследователей, обусловливало достоверное повышение внимания у этих больных. В цитируемой выше работе И.В. Марченко при курсовой терапии Вазобралом отмечено улучшение психосоматического статуса и качество жизни пожилых пациентов (рис. 4) [25]. Было выявлено достоверное (p < 0,05) снижение соматизации на 12,0 %, выраженности обсессивно-психоастенического синдрома – на 18,0 %, внутренней чувствительности – на 26,6 %, депрессии – на 27,3 %, тревоги – на 25,8 %, жестокости – на 13,6 %, страхов – на 19,5 %, параноидальных идей – на 23,2 % и явлений психотизма – на 31,4 %. На фоне лечения Вазобралом зафиксировано статистически значимое (р < 0,05) уменьшение степени выраженности нарушений, оцениваемых по шкале Sandoz: нейродинамики – на 28,6 %, памяти – на 30,8 %, раздражительности – на 24,2 %, неусидчивости – на 22,2 %, безразличия – на 20,0 %, депрессии – на 29,6 %, тревожности – на 32,1 %. Лечение Вазобралом не оказало существенного влияния на гемодинамические показатели [25]. Положительное воздействие Вазобрала на эмоциональную сферу выявлено и среди больных, перенесших инсульт [26].
В связи с этим особо следует отметить, что Вазобрал повышает уровень серотониновой и дофаминовой нейротрансмиссии. В последние годы дофаминергическая система мозга рассматривается как наиболее уязвимая к возрастным изменениям. Уменьшение плотности дофаминергических рецепторов (D2), расположенных во фронтальной области, по данным последних исследований с использованием нейровизуальных методов (позитронно-эмиссионной томографии), напрямую связано с нарушением когнитивных функций у пожилых пациентов. Повышение серотонинергической активности в центральной нервной системе, наблюдающееся при применении Вазобрала, возможно, способствует улучшению настроения и уменьшению эмоциональной лабильности у пациентов с сосудистой патологией головного мозга [28].
Назначают Вазобрал по 1/2–1 таблетке или по 2–4 мл раствора 2 раза в сутки [17, 29]. Есть данные, указывающие на бoльшую эффективность дозировки 4 мг (1 таблетка или 4 мл раствора) 2 раза в сутки. Продолжительность курса лечения составляет 2–3 месяца, имеются указания на целесообразность проведения более длительных курсов терапии (до 6 и более месяцев). Вазобрал в виде таблеток следует принимать во время еды, запивая небольшим количеством воды. Раствор перед применением следует разбавлять небольшим количеством воды. Препарат хорошо переносится, побочные эффекты неспецифичны и встречаются редко. Вазобрал, как правило, не вступает в лекарственные взаимодействия, может назначаться вместе с антитромбоцитарными средствами, препаратами для коррекции уровня АД. Противопоказанием к назначению Вазобрала является только индивидуальная гиперчувствительность к компонентам препарата. Нежелательные эффекты при его применении редки: менее чем в 3 % случаев возникают побочные эффекты со стороны желудочно-кишечного тракта (тошнота, диспепсия), в 1 % случаев – головокружение, головная боль и в 0,1 % случаев – аллергические реакции [17, 29].
Таким образом, проведенные исследования показали хорошую переносимость Вазобрала и его высокую эффективность в лечении начальных проявлений ХНМК у пожилых больных АГ, в том числе и на фоне антигипертензивной терапии. Применение Вазобрала позволит улучшить качество жизни этих пациентов и повысить их приверженность лечению.



