Фолат (витамин B9) – это важное питательное вещество, необходимое для репликации ДНК; кроме того, это субстрат, необходимый для ряда ферментативных реакций, которые происходят в процессе синтеза аминокислот и метаболизма витаминов. Потребность в фолатах во время беременности возрастает, поскольку они нужны для роста и развития плода. Дефицит фолатов связывают с развитием нарушений как у матери (анемия, периферическая невропатия), так и у плода (врожденные аномалии развития). Давно известно, что прием пищевых добавок с фолиевой кислотой (ФК) до и после зачатия снижает риск развития дефектов нервной трубки у детей [1–4]. В данной статье рассматриваются метаболизм ФК, правильное дополнительное применение ФК во время беременности и потенциальная польза ФК, а также возможность приема добавки L-метилфолата для профилактики осложнений во время беременности, не связанных с дефектами нервной трубки.
Фолаты, фолиевая кислота
и L-метилфолат
Для обсуждения роли фолатов в питании и репродуктивной биологии важно точно определиться с терминами. Термин “фолаты” обычно используется как непатентованное название группы химически родственных соединений на основе структуры ФК. Фолат, или витамин B9, считается одним из 13
незаменимых витаминов. Фолаты не синтезируются заново в организме, их нужно получать либо из пищи, либо посредством дополнительного приема. Пищевые фолаты – это питательные вещества, присутствующие в натуральных пищевых продуктах, таких как зеленые листовые овощи, бобовые,
яичный желток, печень и цитрусовые. Фолиевая кислота – это синтетическая пищевая добавка, которая присутствует в обогащенных пищевых продуктах и витаминных препаратах. Ни фолаты, ни ФК не являются метаболически активными; чтобы участвовать в клеточном метаболизме, они должны
подвергаться редуцированию. L-5-метилтетрагидрофолат (L-метилфолат) является доминирующей формой фолата, которая циркулирует в плазме крови и участвует в биологических
процессах [5].
Метаболизм фолиевой кислоты
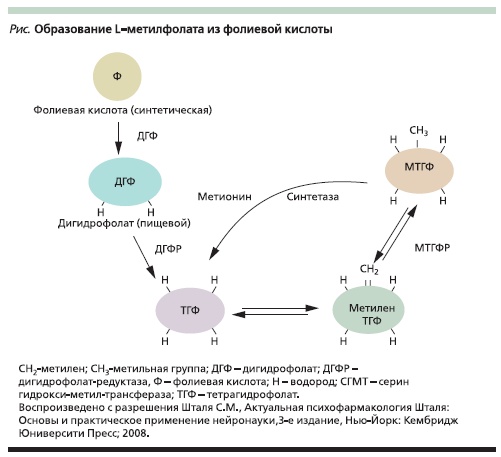
Чтобы перейти в метаболически активную форму, ФК должна сначала превратиться в дигидрофолат (ДГФ), а затем в тетрагидрофолат (ТГФ) посредством ферментативного восстановления, которое катализируется ферментом ДГФ-редуктазой (ДГФР). Затем ТГФ с помощью фермента метилентетрагидрофолатредуктазы (МТГФР) может перейти в биологически активную форму L-метилфолат (см. рисунок), участвующую в реакции переноса одноуглеродных групп (передаче
метила), что необходимо для синтеза пурина/пиримидина в процессе сборки ДНК и РНК, для метилирования ДНК и регулирования метаболизма гомоцистеина [6, 7]. МТГФР является важнейшим ферментом практически для всех биологических процессов, которые включают метаболизм фолатов и метионина.
Генетические полиморфизмы и метаболизм фолиевой кислоты
Генетические вариации (полиморфизмы)* в геноме человека возникают часто и в некоторых случаях
могут приводить к продуцированию белков с измененной биологической активностью. Несколько таких полиморфизмов были выявлены в генах, кодирующих белки, участвующие в метаболизме фолатов. Как отмечено выше, метаболические процессы, для которых нужна передача метильных групп, регулируются ферментом МТГФР. В США примерно 60 % населения – люди со средней скоростью
метаболизма фолатов или носители гетерозиготной формы полиморфизма гена фермента МТГФР [8], до 25 % определенных групп населения являются носителями гомозиготной формы этих генетических вариаций [5]. Эти полиморфизмы в разной степени препятствуют превращению фолата в
его активную форму L-метилфолат. Например, лица с медленным метаболизмом фолатов являются носителями гомозиготного распространенного генотипа 677C->T гена МТГФР и демонстрируют примерно 30 % активности фермента, характерной для лиц с диким типом (CC), а у носителей гетерозиготной формы этого полиморфизма активность составляет примерно 65 % от активности фермента у лиц с диким типом [9]. При другом варианте генотипа, 1298A-> C, гена МТГФР у носителей гомозиготной формы может проявляться сниженная каталитическая активность фермента, составляющая до 68 % от активности, характер-ной для лиц с диким типом [10]. С учетом высокого показателя распространенности генетических полиморфизмов МТГФР среди населения и проблем, связанных с пониженной активностью фермента, соответственно, меньшим количеством биологически доступного L-метилфолата, новые исследования в этой области стали фокусироваться скорее на добавке L-метилфолата, чем на дополнительном приеме ФК в качестве средства профилактики патологий, связанных с дефицитом фолатов.
Фолиевая кислота и профилактика дефектов нервной трубки
Давно известно, что прием пищевых добавок с ФК в период до и после зачатия снижает риск развития дефектов нервной трубки у детей [1–4]. Хотя такая профилактика является эффективной, она направлена только на женщин, планирующих беременность или недавно забеременевших. Дополнительные меры по увеличению уровня потребления ФК населением в целом включают прием поливитаминных добавок и обогащение пищевых продуктов на основе зерновых, таких как мука, крупы и макароны. С января 1998 г. в США [11] и с декабря 1998 г. в Канаде [12] обогащение зерновых продуктов ФК стало обязательным требованием. За несколько месяцев эти законодательные предписания привели к значительному увеличению концентраций фолатов в эритроцитах у женщин детородного возраста [13, 14] и к уменьшению частоты случаев рождения младенцев с дефектами
нервной трубки [15, 17]. Чтобы обеспечить достаточные запасы фолатов у женщин в период беременности, Национальные институты здравоохранения США и Институт медицины рекомендуют ежедневный прием
600 мкг ФК для беременных женщин на протяжении всей беременности с последующим уменьшением дозы до 500 мкг ежедневно в течение периода лактации [18].
Действующие в настоящее время рекомендации в США включают следующие указания:
• женщинам группы высокого риска рождения ребенка с дефектом нервной трубки (наличие дефекта нервной трубки в личном или семейном анамнезе, рождение в прошлом ребенка с дефектом нервной трубки или прием противосудорожных препаратов) ежедневно принимать пищевую добавку 5 мг ФК до зачатия;
• всем женщинам репродуктивного возраста принимать от 0,4 до 1,0 мг ФК ежедневно на протяжении
минимум 2–3 месяцев до зачатия, в течение всей беременности и послеродового периода.
Действующие в настоящее время рекомендации в Канаде зависят от демографических характеристик пациентки, стиля жизни и теоретического риска развития структурных аномалий у плода (краткое изложение рекомендаций представлено в табл. 1) [19]. Кроме того, в последнем двойном слепом рандомизированном плацебоконтролируемом исследовании с участием 144 женщин детородного
возраста Ламерс и его коллеги продемонстрировали, что прием добавки L-метилфолата эффективнее, чем ФК, повышал концентрации фолатов в эритроцитах [20].
Таблица 1. Канадские рекомендации по дополнительному приему фолиевой кислоты и поливитаминов во время беременности.
Фолиевая кислота и профилактика анемии
Увеличение объема крови в результате увеличения объема плазмы и эритроцитов является нормальным физиологическим изменением во время беременности. Хотя в крови матери становится больше плазмы, чем эритроцитов, увеличение объема эритроцитов также является существенным и
в среднем составляет около 450 мл [21]. Из-за увеличения объема плазмы концентрация гемоглобина и гематокрит во время беременности обычно немного уменьшаются. Однако хотя в среднем концентрация гемоглобина составляет 12,5 г/дл, около 5 % женщин имеют анемию с концентрациями гемоглобина ниже 11,0 г/дл (табл. 2) [22].
Таблица 2. Концентрации гемоглобина у 85 здоровых женщин с подтвержденным запасом железа.
Эритропоэз является процессом, посредством которого формируются эритроциты в гематопоэтической
ткани костного мозга. Среди прочего для активного эритропоэза требуются достаточные запасы трех ключевых питательных веществ: фолатов, кобаламина (витамин B12) и железа. Хотя полная детализация роли этих питательных веществ в эритропоэзе не предусмотрена данным обзором, важно понимать, что реакция в нормальном эритропоэзе, в которой задействованы и фолаты, и витамин B12, представляет собой перенос метильной группы из L-метилфолата в гомоцистеин с помощью метилкобаламина для регенерации метионина [23]. Следовательно, низкие уровни содержания фолатов и/или витамина B12, вероятно, будут вызывать анемию. Например, в последнем ретроспективном анализе анемии во время беременности, проведенном Бентли и соавт., беременным женщинам прописывали пренатальное лечебное питание с добавкой 1,13 мг L-метилфолата в дополнение к 0,4 мг ФК и 500–1000 мкг витамина B12 (высокий уровень фолатов, высокий уровень витамина B12) и сравнивали с беременными женщинами, которым прописывали стандартные пренатальные витамины, содержащие только 0,8–1,0 мг ФК и 0–12 мкг витамина B12 (низкий уровень фолатов, низкий уровень витамина B12) [24]. В группе женщин, получавших фолаты и витамин B12 в большом количестве, отмечены значительно более высокие уровни гемоглобина при родах (11,8 по сравнению с 10,7 г/дл; p = 0,001), чем в контрольной группе, получавшей стандартные пренатальные витамины. В будущем предстоит определить, как эти результаты проявятся в проспективных рандомизированных исследованиях и какое влияние будет оказывать непосредственный прием добавки
L-метилфолата на другие процессы, связанные с фолатами.
Фолиевая кислота и профилактика преждевременных родов
Преждевременные роды, т. е. роды, наступившие в сроке беременности до 37 недель, являются осложнением 12,5 % (1 из 8) всех родов в США. Это основная причина смертности и заболеваемости новорожденных. Недоношенные дети находятся в группе риска развития внезапных осложнений со стороны дыхательной, желудочно-кишечной, иммунной и центральной нервной систем, а также длительных последствий со стороны моторики, когнитивных и нейроповеденческих функций. В результате издержки для общества, связанные с преждевременными родами, только в США превышают 26 млрд долл. в год [25]. Преждевременные роды являются скорее синдромом, чем диагнозом, поскольку этиология преждевременных родов весьма разнообразна. Около 20 % преждевременных родов являются ятрогенными и проводятся по показаниям для матери или плода, включая задержку внутриутробного развития, преэклампсию, предлежание плаценты и неутешительные результаты исследований плода.
Хотя полного понимания причин остальных 80 % преждевременных родов пока нет, описывают четыре
основных патофизиологических механизма:
• преждевременная активация гипоталамо-гипофизарно-надпочечниковой оси;
• внутриутробная инфекция/воспаление;
• децидуальное кровотечение (отслойка плаценты);
• патологическое растяжение матки [26].
Лечение преждевременных родов направлено в основном на торможение сокращений матки, но это не снижает частоту преждевременных родов и не улучшает исход для новорожденного [27]. С учетом такого терапевтического нигилизма стали уделять больше внимания профилактике. Фолиевая кислота является одним из изучаемых средств профилактики преждевременных родов у женщин как с низким, так и с высоким риском преждевременных родов.
Эпидемиологические данные
Существуют косвенные доказательства, позволяющие сделать вывод о том, что фолаты действительно могут оказывать существенное влияние на определение времени родов. В наблюдательных исследованиях более короткий период беременности был связан с низкими уровнями содержания фолатов в сыворотке крови [6, 28] и с тем фактом, что во время беременности не осуществлялся дополнительный прием ФК [29]. Первые интервенционные исследования были сосредоточены на приеме добавок, содержащих множество питательных микроэлементов, было показано значительное
снижение осложнений беременности при их приеме, в т. ч. таких как низкая масса тела при рождении, малые размеры, не соответствующие гестационному возрасту, а также анемия у матери [30–33]. Мощность таких исследований была недостаточной, чтобы продемонстрировать различия в отношении преждевременных родов, преждевременного разрыва плодных оболочек или отслоения плаценты. Интересно, что эти различия теряют свою значимость при сравнении добавок, содержащих много питательных микроэлементов, с добавкой, содержащей только железо/ФК [29]. Это позволяет сделать вывод о том, что именно эти элементы являются наиболее важными.
Последующие исследования указывают на то, что дополнительный прием только лишь ФК может защитить от риска преждевременных родов, при этом не повышая риска невынашивания, структурных аномалий, много-плодной беременности или мертворождения [29, 34–36]. Самое крупное из таких исследований – вторичный анализ проспективного наблюдательного исследования FASTER, проведенного в США в 1999–2002 гг. [36]. Этот вторичный анализ включал данные 34 480 женщин с одноплодной беременностью начиная с I триместра, у которых роды произошли между 20-й и 42-й неделями беременности. Спонтанные преждевременные роды определялись как роды между 20-й и
36-й неделями беременности в отсутствие медицинских или акушерских осложнений или показаний. Из исследования исключались беременности, завершившиеся плановым прерыванием или мертворождением, и беременности с наличием хромосомных или структурных аномалий у плода. На первоначальном этапе включения в исследование в I триместре беременности всем участницам задавали вопросы об их питании, конкретно – о дозе и продолжительности приема ФК.
В этой группе по сравнению с таковой, не принимавшей дополнительно ФК, прием добавки до и после зачатия на протяжении ≥ 1 года был связан со значительным снижением спонтанных преждевременных родов (отношение рисков [ОР] = 0,22, 95 % доверительный интервал [ДИ] – 0,08–0,61; p = 0,004 для родов на 20–28-й неделе; ОР = 0,45, 95 % ДИ, 0,24–0,83; p = 0,010 для родов на 28–32-й неделе). Авторы заключили, что дополнительный прием фолатов до и после зачатия снижает риск спонтанных преждевременных родов и что эта причинная связь является сильной, специфической, дозозависимой, согласуется с данными, полученными в других исследованиях, биологически вероятна и остается по сути неизменной после корректировки с учетом потенциальных мешающих факторов [36].
Последние данные позволяют сделать вывод о том, что продолжительность дополнительного приема ФК может быть такой же важной, как и доза. В крупном проспективном когортном исследовании, упомянутом выше [36], риск спонтанных преждевременных родов был обратно пропорционален продолжительности дополнительного приема ФК и самым низким для женщин, которые сообщали,
что принимали добавку ФК более года до зачатия.
Биологическая вероятность
Если дополнительный прием ФК действительно связан со снижением риска преждевременных родов, то в чем тогда заключается этот механизм? Данный вопрос осложняется тем фактом, что о молекулярных механизмах, ответственных за начало родов у человека, как своевременных, так и преждевременных, известно очень мало, не говоря уж о способах сохранения беременности, осложненной преждевременными родами. Становится очевидным, что многие случаи преждевременных родов связаны с патологической воспалительной реакцией, которая может быть спровоцирована внутриутробной инфекцией или кровотечением [22]. Известно, что фолаты важны для нормальной иммунной функции. У людей с дефицитом фолатов имеется, например, дисфункция как клеточного, так и гуморального иммунитета [37]. Кроме того, у людей с дефицитом фолатов полиморфоядерные лейкоциты имеют пониженные фагоцитарные и бактерицидные способности, что повышает их чувствительность к таким инфекциям, как асимптомная бактериурия [38]. Было показано, что прием
пищевой добавки, содержащей ФК, улучшает иммунную функцию у таких людей и снижает содержание циркулирующих биомаркеров воспаления, в т. ч. альфа-1-кислый гликопротеин и
C-реактивный белок [39].
Недавно было описано несколько генетических вариаций в ключевых генах, участвующих в метаболизме фолатов, которые определяют повышенный риск спонтанных преждевременных родов. Один из таких вариантов включает потерю 19-й пары оснований (bp) в гене ДГФР [40], которая является важным ферментом в каскаде метаболизма фолатов, поскольку, как обсуждалось выше, поглощенный фолат должен полностью редуцироваться, прежде чем начнется дальнейший процесс метаболизма. Аллель с делецией 19-й пары оснований ДГФР препятствует метаболизму фолатов и транспортировке восстановленных фолатов через плаценту.
Другой пример вариации последовательности в гене СГМТ1 (серин гидроксиметилтрансферазы 1) известен как вариант SHMT1(1420)T. Он приводит к пониженной транскрипционной активности СГМТ1 и связан с повышенным риском спонтанных преждевременных родов. Этот эффект был наиболее выражен среди пациенток с низким уровнем потребления ФК [41].
Результаты, аналогичные перечисленным, повышают вероятность того, что даже женщины с “достаточным”потреблением фолатов могут подвергаться риску преждевременных родов, если они являются носительницами определенной генетической вариации. В настоящее время еще неизвестно,
будет ли полезен для таких женщин прием добавки, содержащей более высокие дозы ФК, или непосредственный прием добавки L-метилфолата.
Дополнительная польза приема фолиевой кислоты
Помимо профилактики дефектов нервной трубки дополнительный прием ФК до и после зачатия оказывает другое полезное действие – профилактику врожденных заболеваний сердца и ротовых расщелин [42–45], а также преждевременных родов (что обсуждалось выше). Механизмы, посредством которых ФК оказывает профилактическое действие в отношении развития структурных аномалий у плода, неизвестны, но они могут включать регуляцию метаболизма гомоцистеина [46].
Некоторые исследователи сделали вывод о том, что прием ФК может оказывать дополнительное полез-
ное действие на исход беременности. Эта линия исследований возникла в результате того, что эпидемиологические исследования показали, что воздействие антагонистов ФК во время беременности связано со значительно более высокими показателями осложнений беременности, связанных с плацентой [47–50]. Антагонисты ФК представляют собой широкий спектр лекарственных препаратов, применяющихся по самым разным клиническим показаниям, в т. ч. при лечении эпилепсии, аффективных расстройств и инфекций мочевыводящих путей.
Антагонисты ФК можно разделить на две группы:
a) ингибиторы ДГФР (например, сульфаметоксазол + триметоприм), которые блокируют превращение
фолата в его более активные метаболиты (см. рисунок);
b) другие антагонисты ФК, представляющие собой группу, состоящую главным образом из противосудорожных препаратов (фенобарбитал, фенитоин, примидон и карбамазепин), но также включающую отилония бромид (спазмолитический препарат, содержащий низкие дозы фенобарбитала) и холестирамин.
В одном исследовании было отмечено, что воздействие ингибиторов ДГФР (n = 12 546) или других антагонистов ФК (n = 1565) во время беременности было связано с повышенным риском развития преэклампсии (скорректированное отношение шансов [ОШ] = 1,52, 95 % ДИ – 1,39–1,66), тяжелой преэклампсии (ОШ = 1,77, 95 % ДИ – 1,38–2,28), отслоением плаценты (ОШ = 1,32, 95 % ДИ – 1,12–1,57), задержкой внутриутробного развития < 10-го процентиля (ОШ = 1,07; 95 % ДИ – 1,01–1,13), задержкой внутриутробного развития < 3-го процентиля (ОШ = 1,22; 95 % ДИ – 1,11–1,34) и гибелью плода (ОШ = 1,35, 95 % ДИ – 1,07–1,70) [49]. У этих нежелательных явлений есть одна общая особенность: все они возникают в результате нарушений имплантации и формирования плаценты, которые происходят на раннем сроке беременности. Поскольку было показано, что ФК регулирует инвазию трофобласта [51], существует биологическая возможность того, что дефицит фолатов может мешать развитию плаценты на ранних стадиях, приводя к осложнениям беременности на более поздних сроках.
Риски, связанные с приемом фолатов в больших дозах
Хотя было показано, что дополнительный прием ФК в дозах, превышающих физиологические, может
оказывать полезное, как описывалось выше, влияние на беременных женщин и плод, необходимо все-таки учитывать потенциальный риск, связанный с приемом фолатов в больших дозах. Во-первых, дополнительный прием фолатов может приводить к маскировке дефицита витамина B12 (пернициозная анемия), поэтому необходимо быть внимательным, особенно с чувствительными людьми, чтобы не пропустить этот диагноз. Также поднимались вопросы о потенциально неблагоприятном действии неметаболизированной синтетической ФК в отношении онкологических заболеваний, депрессии и нарушения когнитивных функций [52]. С учетом всех этих проблем начальные данные позволяют предположить, что снизить указанные риски может прием добавки L-метилфолата,
а не ФК [53].
Заключение
Дополнительный прием ФК до и после зачатия защищает от риска развития структурных аномалий у плода, в т. ч. дефектов нервной трубки и врожденных пороков сердца. Последние данные позволяют заключить, что дополнительный прием ФК также может защищать от риска преждевременных родов. Важность генетических полиморфизмов в генах, регулирующих метаболизм фолатов (в частности, гена МТГФР), а также механизмы их влияния на биодоступность L-метилфолата и, соответственно, стратегии приема добавок, содержащих фолаты, до конца еще не установлены. Хотя для более точного определения времени приема, доз и подходящих составов нужны дополнительные исследования, имеющиеся данные позволяют сделать вывод о том, что прием пищевой добавки, содержащей ФК, является хорошей идеей для женщин репродуктивного возраста. Для женщин с установленными мутациями гена МТГФР может быть полезен непосредственный прием добавки L-метилфолата, однако в настоящее время данных для окончательного вынесения такого заключения недостаточно.
Выводы
• Потребность в фолатах в период беременности возрастает, поскольку они нужны для роста и развития плода. Дефицит фолатов связывают с развитием нарушений как у матери (анемия, периферическая невропатия), так и у плода (врожденные аномалии развития).
• Термин “фолаты” обычно используется как непатентованное название группы химически родственных соединений на основе структуры ФК. Фолат, или витамин B9, считается одним из 13 незаменимых витаминов. Фолаты не синтезируются заново в организме: их нужно получать либо из пищи, либо посредством дополнительного приема. Фолиевая кислота – это синтетическая пищевая добавка, которая присутствует в обогащенных пищевых продуктах и витаминных препаратах. Ни фолаты, ни ФК не являются метаболически активными. Чтобы участвовать в клеточном метаболизме, они должны подвергнуться редуцированию. L-5-метилтетрагидрофолат (L-метилфолат) является доминирующей формой фолата, которая циркулирует в плазме крови и участвует в биологических процессах.
• С учетом высокого показателя распространенности генетических полиморфизмов МТГФР среди населения и проблем, связанных с пониженной активностью фермента, и, соответственно, меньшим количеством биологически доступного L-метилфолата, новые исследования в этой области стали фокусироваться скорее на добавке L-метилфолата, чем на дополнительном приеме ФК в качестве
средства профилактики патологий, связанных с дефицитом фолатов.
• В последнем двойном слепом рандомизированном плацебоконтролируемом исследовании с
участием 144 женщин детородного возраста Ламерс и соавт. продемонстрировали, что прием добавки
L-метилфолата эффективнее, чем ФК, повышал концентрации фолатов в эритроцитах.
• Дополнительный прием ФК до и после зачатия защищает от риска развития структурных аномалий у
плода, в т. ч. дефектов нервной трубки и врожденных пороков сердца. Согласно последним данным, дополнительный прием фолиевой кислоты также может защищать от риска преждевременных родов. Следовательно, прием пищевой добавки, содержащей ФК, является хорошей идеей для женщин репродуктивного возраста. Хотя для более точного определения времени приема, доз и подходящих
составов нужны дополнительные исследования.


