Главной целью лечения сахарного диабета 2 типа (СД2) является достижение стабильной и длительной компенсации углеводного обмена. Согласно многочисленным международным исследованиям, именно компенсация заболевания является основой профилактики осложнений, увеличения продолжительности и улучшения качества жизни больных.
Несмотря на достижения в управлении СД2 и разнообразие современных пероральных сахароснижающих препаратов (ПССП), достижение стойкой компенсации диабета и сегодня представляет значительные трудности. Гликемический контроль остается неоптимальным у большинства пациентов. По данным крупномасштабного популяционного исследования UKPDS (United Kingdom Prospective Diabetes Study), через 3 года монотерапии ПССП компенсация сохранилась только у 45 % больных, а через 6 лет – только у 30 % [1]. Это связано, с одной стороны, с прогрессирующим характером заболевания, а с другой – с определенным дисбалансом между улучшением контроля гликемии и риском развития нежелательных явлений на фоне проводимой терапии. Среди них на первом месте по клинической значимости находятся риск гипогликемий и увеличение массы тела.
Действительно, гипогликемия является основным барьером на пути к оптимизации и интенсификации сахароснижающей терапии с целью достижения оптимальной гликемии. Это особенно заметно у пациентов с диабетом 1 типа, для которых гипогликемии – довольно частое явление [2]. Однако у пациентов с СД2 гипогликемии также являются реальной проблемой, особенно на фоне терапии препаратами сульфонилмочевины [3, 4]. Последствиями серьезных гипогликемий становятся нарушения познавательной способности и поведения, серьезные сердечно-сосудистые осложнения, которые могут приводитьк летальному исходу, обусловленному некупируемой аритмией [5, 6].
Существенный недостаток многих ПССП и инсулина – увеличение массы тела [7, 8], которое является серьезной проблемой, особенно у пациентов с СД2. Оно может рассматриваться как прогностический фактор при оценке риска сердечно-сосудистых заболеваний и сердечно-сосудистой смертности [9], в т. ч. риска внезапной сердечно-сосудистой смерти, а также как мотивационный фактор при назначении и интенсификации терапии [10], особенно инсулинотерапии.
Клинические исследования последних лет показали, что стойкое уменьшение массы тела, снижая смертность и риск сердечно-сосудистых заболеваний, значительно улучшает прогноз жизни у больных СД2 [9, 11]; соответственно, увеличение массы тела, наоборот, этот показатель ухудшает. Показано отрицательное влияние повышения массы тела на мотивацию пациентов СД2 и их приверженность терапии [10–13]: повышение массы тела заставляет их (по собственному признанию) периодически пропускать инъекции инсулина в призрачной надежде хоть немного уменьшить массу тела.
Таким образом, боязнь гипогликемий и увеличения массы тела является причиной клинической инерции, мешающей врачам своевременно назначать, а главное – оптимизировать и интенсифицировать лечение [14]. С другой стороны, даже пациенты, понимающие преимущества адекватного гликемического контроля в отношении долгосрочного прогноза, часто испытывают страх перед интенсификацией сахароснижающей терапии [15, 16], заранее опасаясь нежелательных эффектов. Поэтому появление в арсенале средств для лечения СД2 новых препаратов, позволяющих не только устранять метаболические нарушения, но и минимизировать риски гипогликемии и увеличения массы тела, при этом стимулируя и активизируя физиологические механизмы регуляции секреции инсулина и содержания глюкозы крови, могло бы положительно сказаться на готовности больных следовать врачебным рекомендациям.
Наконец, оптимальное управление СД2 предполагает возможность воздействия на другие сердечно-сосудистые риски, в т. ч. влияние на артериальное давление (АД) – важный фактор сердечно-сосудистых заболеваемости и смертности. Известно, что уровень систолического АД (САД) повышается при увеличении длительности диабета. При этом снижение САД на 5,6 мм рт. ст. создает предпосылки для достоверного снижения риска преждевременной сердечной смерти у таких больных на 18 % [17].
Принимая во внимание сложные патофизиологические связи между инсулинорезистентностью, нарушениями гликемического контроля, ожирением, дислипидемией, артериальной гипертензией и атеросклерозом, особое значение приобретает способность сахароснижающих препаратов не только обеспечивать контроль гликемии, но и влиять на прогрессирование макрососудистых осложнений и частоту развития инфаркта миокарда, инсульта у больных СД2. Совершенно очевидно, что и врачи, и пациенты нуждаются во внедрении в клиническую практику новых и эффективных средств для лечения СД2, которые могли бы преодолеть определенные ограничения существующих терапевтических подходов, использующихся для достижения и поддержания компенсации диабета. Поэтому появление препаратов группы инкретинов вселяет большие надежды в плане решения ряда проблем терапии СД.
Инкретины – это гормоныжелудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие глюкозозависимую стимуляцию секреции инсулина, что является принципиальной особенностью их сахароснижающего действия. “Инкретиновый эффект” был впервые описан двумя независимыми исследовательскими группами (McIntyre, Elrick) еще в 1964 г. как механизм стимуляции выработки инсулина в ответ на прием пищи. В настоящее время наиболее изученными инкретинами являются глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП).
У здоровых людей ГПП-1 оказывает выраженное глюкозозависимое стимулирующее действие, в первую очередь на секрецию инсулина β-клетками поджелудочной железы, на биосинтез инсулина, а также подавляющее действие на выработку глюкагона [18], опосредованное через соматотропный гормон (рис. 1). Клинически важным следствием выраженной глюкозозависимой стимуляции секреции инсулина ГПП-1 является минимизация риска развития гипогликемии на фоне его применения.
Рисунок 1. Динамика уровней инсулина глюкагона и гликемии на фоне терапии лираглутидом.
Кроме того, ГПП-1 может снижать уровень гликемии, особенно прандиальной, за счет “неинсулиновых” механизмов путем замедления опорожнения желудка и снижения потребления пищи, а также ингибируя в печени продукцию глюкозы и способствуя усвоению глюкозы жировой и мышеч
ной тканью [19]. Однако эти эффекты вторичны по отношению к регуляции секреции инсулина и глюкагона.
Улучшение гликемических показателей на фоне приема ГПП-1 может быть результатом восстановления нормальной функции β-клеток. Исследования in vitro свидетельствуют о том, что β-клетки, резистентные к глюкозе, после введения ГПП-1 становятся “глюкозокомпетентными” [20]. Кроме того, ГПП-1 обладает рядом важных метаболических эффектов. Он улучшает периферическую чувствительность к инсулину, способствует активному поглощению глюкозы печенью, мышечной и жировой тканями, влияет на сердечно-сосудистую и центральную нервную системы [21]. Важным преимуществом ГПП-1, которое представляет особый интерес при лечении СД2, является его способность увеличивать массу β-клеток и уменьшать их апоптоз [21, 22].
Несмотря на то что инкретиновые гормоны были открыты почти 50 лет назад, возможность применения ГПП-1 в клинической практике не могла быть реализованной из-за его быстрой деградации в кишечнике ферментом дипептидилпептидазой-4 (ДПП-4) до неактивных метаболитов [23]. Но прогресс науки в области изучения инкретиновой терапии в течение последнего десятилетия создал реальные предпосылки для прорыва в области лечения диабета. Усилия ученых привели к созданию двух абсолютно новых классов сахароснижающих препаратов: ингибиторов ДПП-4, которые повышают эндогенный уровень сывороточного ГПП-1 (вилдаглиптин, ситаглиптин, саксаглиптин), и агонистов рецептора ГПП-1, резистентных к действию ДПП-4 (эксенатид, лираглутид).
В отличие от эксенатида, который только на 53 % гомологичен нативному ГПП-1, лираглутид (Виктоза®) является первым аналогом человеческого ГПП-1, аминокислотная последовательность которого на 97 % аналогична нативному гормону [24]. Замена одной аминокислоты (аргинина на лизин) в позиции 34 и добавление к лизину в позиции 26 пальмитиновой кислоты сделали препарат более устойчивым к протеолитической деградации ДПП-4 (период полужизни увеличился до 13 часов). Поэтому введение лираглутида один раз в сутки позволяет поддерживать стабильную концентрацию ГПП-1 в течение 24 часов [25].
Говоря о сахароснижающей эффективности лираглутида (Виктоза®), можно отметить, что на сегодняшний день это самый сильный по данному показателю препарат в классе инкретинов [26]. Результаты многочисленных клинических исследований (программа LEAD – Liraglutide Effect and Action in Diabetes) убедительно продемонстрировали, что применение лираглутида в терапевтических дозировках приводит к выраженному, клинически значимому стабильному снижению уровня гликозилированного гемоглобина (HbА1с) на 1,1–1,6 %, превосходящему эффекты плацебо и некоторых препаратов сравнения [27–32]. Так, например, при использовании лираглутида в монотерапии у пациентов с СД2, ранее находившихся на диете и физических нагрузках, было показано снижение уровня HbA1с на 1,6 %, в то время как монотерапия глимепиридом в дозе 8 мг/сут сопровождалась снижением HbA1с только на 0,88 % [29]. Обобщая данные 6 клинических исследований программы LEAD, необходимо отметить важную особенность сахароснижающего эффекта лираглутида – зависимость от исходного уровня гликемии, что выгодно отличает его от других препаратов для лечения СД (рис. 2). Так, среди больных СД с выраженной декомпенсацией (уровень HbA1с ≥ 9,5 %) динамика HbA1с достигает 2,74 % [33]. Несомненно, это очень значительное улучшение, с которым может конкурировать только инсулин.
Рисунок 2. Динамика HbA1с на фоне терапии лираглутидом в зависимости от исходного уровня Динамика HbA1с.
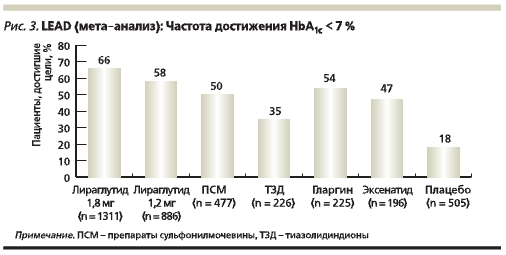
Важным показателем эффективности сахароснижающей терапии является доля пациентов, достигших целей гликемического контроля. В большинстве случаев при проведении клинических исследований в качестве целевого параметра используют уровень HbА1с < 7 %, рекомендованный ADA (American Diabetes Association) и Российскими национальными стандартами. Результаты мета-анализа клинических исследований LEAD показали, что при лечении лираглутидом (Виктоза®) в дозах 1,8 и 1,2 мг один раз в сутки доля пациентов, достигших целевого уровня HbА1с, была более 50 % (66 и 58 % соответственно), т. е. значительно больше, чем при терапии другими ПССП (рис. 3) [34].
Возможно, именно вследствие высокой сахароснижающей активности и возможности достижения целевого контроля гликемии у большинства пациентов Американская Ассоциация клинических эндокринологов (AACE-ACE Consensus Statement, 2009) рассматривает терапию агонистами ГПП-1 в качестве основного компонента комбинированной терапии СД2 с использованием двух ПССП [35]. При этом подчеркивается преимущество агонистов ГГП-1 по сравнению с ингибиторами ДПП-4 в отношении снижения прандиальных колебаний гликемии. Более того, высказывается предположение, что агонисты ГПП-1 со временем могут вытеснить традиционные препараты сульфонилмочевины, которые с точки зрения сахароснижающего потенциала на сегодняшний день считаются наиболее сильными среди других традиционных ПССП.
Поскольку сахароснижающие эффекты лираглутида аналогичны таковым нативного ГПП-1 и являются абсолютно глюкозозависимыми, соответственно, при достижении уровня гликемии, близкого к нормогликемии, его стимулирующее действие на секрецию инсулина и подавляющее действие на глюкагон снижаются. А при достижении гликемии, пограничной с гипогликемическим уровнем (< 4,5 ммоль/л), это влияние вовсе прекращается. Таким образом, риск гипогликемий сводится к минимуму и главным образом зависит от гипогликемического профиля ПССП, с которыми применяется лираглутид (Виктоза®), что подтверждено результатами крупномасштабных клинических исследований [27–32]. Так, на больших когортах пациентов с СД2 (n = 2735), получавших лираглутид (Виктоза®) в дозе 1,2 и 1,8 мг один раз в cутки (исследования LEAD 1–6), лишь у 6 больных были зафиксированы эпизоды тяжелой гипогликемии. При этом все пациенты получали лираглутид в сочетании с препаратом сульфонилмочевины [27, 31, 36]. Частота легких гипогликемий в исследованиях LEAD была очень низкой, сопоставимой с плацебо, и составила 0,03–1,93 эпизода/пациенто-лет [36].
Терапия лираглутидом (Виктоза®) при СД2 демонстрирует выраженную клиническую эффективность в отношении снижения массы тела пациентов. В отличие от препаратов сравнения (производных сульфонилмочевины, тиазолидиндионов, инсулина), применение которых по отдельности или в комбинации ассоциируется с повышением массы тела (2 кг на 1 % снижения HbА1с), терапия лираглутидом приводит к достоверному и стойкому снижению массы тела. Важно отметить, что снижение массы тела отмечалось даже у пациентов, получавших лираглутид в комбинации с препаратами сульфонилмочевины [27], терапия которыми обычно ассоциируется с увеличением массы тела.
Длительная (52 недели) монотерапия лираглутидом в дозе 1,2 или 1,8 мг/сут, привела к снижению массы тела на 2,1 и 2,5 кг соответственно по сравнению с увеличением массы тела на 1,1 кг на фоне терапии глимепиридом в дозе 8 мг/сут [29]. Клинически значимое снижение массы тела наблюдалось уже на первых неделях лечения и поддерживалось в течение всего периода наблюдения [29]. При этом, согласно данным мета-анализа исследований LEAD 1–5, динамика массы тела зависела от исходного индекса массы тела (ИМТ) (рис. 4) и была максимальной у пациентов с выраженным ожирением (ИМТ > 35 кг/м2) [37]. У пациентов с ИМТ, близким к нормальным значениям (< 25 кг/м2) на фоне применения лираглутида, масса тела практически не изменилась (ΔИМТ = -0,1–0,2 кг/м2).
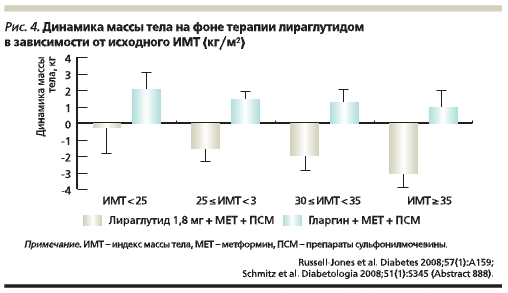
Необходимо подчеркнуть, что динамика массы тела не зависела от наличия и выраженности побочных эффектов – тошноты и рвоты. Кроме того, снижение массы тела на фоне терапии лираглутидом происходит преимущественно за счет снижения массы висцерального и абдоминального жира [38], а это в свою очередь влияет на улучшение гликемии натощак, толерантности к глюкозе, липидного профиля.
Особенно следует отметить динамику САД на фоне терапии лираглутидом (Виктоза®). По данным различных исследований, многие пациенты с СД2 (до 75 %) страдают артериальной гипертензией [39]. При этом уровень САД постоянно повышается с увеличением продолжительности СД. Сочетание декомпенси-рованного СД2 и неконтролируемой гипертензии минимум в 2 раза повышает риск преждевременной смерти от сердечно-сосудистой патологии. В то же время снижение уровня САД на 5,6 мм рт. ст. приводит к снижению риска смерти от сердечно-сосудистых заболеваний при СД2 на 18 % [17], а снижение САД на каждые 10 мм рт. ст. сокращает риск осложнений диабета на 12 % [40].
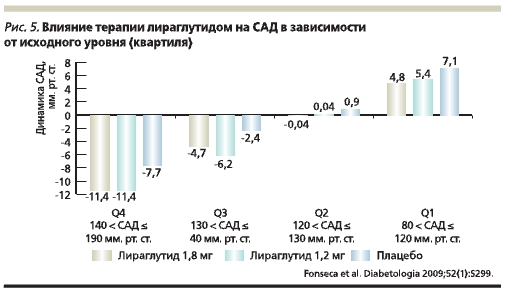
В исследованиях LEAD терапия лираглутидом сопровождалась достоверным, клинически значимым снижением уровня САД (до -6,7 мм рт. ст.) [30], Уровень снижения САД, наблюдаемый в исследованиях LEAD, был сравнимым с динамикой данного показателя на фоне применения традиционных классических антигипертензивных препаратов, таких как ингибиторы ангиотензинпревращающего фермента и антагонисты рецепторов ангиотензина II (-8 мм рт. ст.) [41]. В связи с этим важно подчеркнуть, что у части пациентов с СД2, особенно с исходно более высоким уровнем АД (САД > 140 мм рт. ст.), на фоне терапии лираглутидом снижение САД может быть даже более существенным (-11,4 мм рт. ст.; рис. 5) [42, 43].
Таким образом, лираглутид (Виктоза®), первый аналог человеческого ГПП-1 длительного действия, может быть использован в качестве препарата для монотерапии СД2 или компонента комбинированной терапии (в сочетании с одним или двумя ПССП). Его применение высокоэффективно в отношении улучшения гликемического контроля с высокой вероятностью достижения целевого контроля у большинства пациентов с СД2. Вместе с тем терапия лираглутидом является безопасной, поскольку риск гипогликемий любой степени тяжести сведен к минимуму. Дополнительными положительными свойствами препарата являются снижение массы тела и уровня САД у значительной части пациентов с СД2. Лираглутид (Виктоза®), являясь представителем инновационного класса сахароснижающих препаратов – инкретинов, открывает новые перспективы в лечении СД2 как с точки зрения достижения контроля диабета, так и в отношении улучшения его долгосрочного прогноза.



