Введение
В настоящее время хронический панкреатит (ХП) является относительно распространенным заболеванием, которое часто приводит к временной нетрудоспособности, а в дальнейшем – и к инвалидизации, что делает его значимой социальной и экономической проблемой современной медицины [1]. Хронические боли и нарушение функции поджелудочной железы (ПЖ) приводят к развитию трофологической недостаточности, способствующей дальнейшему прогрессированию заболевания. Развитие клинической симптоматики и дальнейшее снижение функции ПЖ усугубляют трофологическую недостаточность, замыкая тем самым порочный круг патогенеза ХП [1]. В последние годы все большее число исследователей обращаются к изучению актуальных вопросов патогенеза внешнесекреторной недостаточности поджелудочной железы (ВНПЖ) у больных ХП, поскольку знание механизмов этого синдрома позволяет лечить таких больных наиболее эффективно. Тем не менее консервативная терапия ВНПЖ у больных ХП на сегодняшний день остается сложной задачей, а рекомендации по купированию этого синдрома противоречивы и не всегда эффективны.
При изучении вопросов патологии ВНПЖ следует отметить, что дефицит ферментов может возникать в результате истинного снижения синтеза и/или доставки ферментов в двенадцатиперстную кишку (ДПК) или вследствие недостаточной активации или инактивации ферментов в ДПК и начальных отделах тощей кишки [2].
Нередко первичные механизмы ВНПЖ усугубляются в результате следующих вторичных причин [1, 2–4]:
• инактивации панкреатических ферментов вследствие ацидификации ДПК (снижения интрадуоденального уровня рН < 5,5) как результата снижения выработки бикарбонатов;
• асинхронного поступления желчи, панкреатических ферментов и химуса в ДПК в результате сбоя моторики, что нарушает смешивание ферментов с пищевым химусом и активацию липазы (например, при билиарной обструкции, холестазе, гепатите, циррозе печени);
• быстрого транзита кишечного содержимого (снижения концентрации ферментов в результате разведения);
• синдрома избыточного бактериального роста в ДПК и тощей кишке, сопровождающегося бактериальным гидролизом панкреатических ферментов.
При проведении эффективной заместительной ферментной терапии (ЗФТ) с учетом вышеизложенных фактов необходимо соблюдать следующие условия [5–7]:
• применять только галенические препараты чистого панкреатина, в которых обеспечена защита фермента в мини-микросферах (микротаблетках);
• для адекватного высвобождения ферментов в ДПК интрагастральный рН не должен превышать 5, а интрадуоденальный рН должен быть не ниже 5,5;
• пищевой химус должен поступать в ДПК совместно с ферментами, что происходит только при использовании энтеросолюбильных микросфер малых размеров (менее 1,8 мм);
• для стартовой терапии на основной прием пищи применять ферментный препарат с высоким содержанием липазы (25000–40000 ЕД).
Известно немало работ как российских, так и зарубежных ученых, доказывающих целесообразность учета вторичных причин возникновения экзокринной панкреатической недостаточности [8, 10, 11], поскольку развитие ВНПЖ у больных ХП обусловлено различными механизмами, часто сочетающимися друг с другом, что создает порочный круг и приводит к низкой эффективности ЗФТ [8–10]. Научных работ, посвященных изучению длительной терапии препаратами панкреатина, не так много, а работ, учитывающих при этом вторичные механизмы ВНПЖ, практически нет совсем.
Целью исследования явилась оценка целесообразности и эффективности длительной, дифференцированной в зависимости от механизмов ВНПЖ ЗФТ у больных ХП с синдромом экзокринной недостаточности.
Материал и методы
На базе консультативно-диагностического и гастроэнтерологического отделений НУЗ ЦКБ № 2 им. Н.А. Семашко ОАО РЖД Москвы проведено открытое двухэтапное сравнительное исследование, в которое были включены 140 больных ХП с ВНПЖ, в т. ч. 68 (48,6 %) мужчин и 72 (51,4 %) женщины; их средний возраст составил 45,7 ± 2,0 года. Средняя длительность анамнеза ХП составила 7,4 ± 2,8 года.
В исследование включили больных ХП с ВНПЖ, имевших один и более признаков каждой группы критериев:
• клинические проявления экзокринной недостаточности ПЖ: нарушения стула, стеаторея, вздутие живота;
• анамнестические критерии ХП:
регулярное употребление алкоголя (более 100 г/сут) и/или табакокурение в течение нескольких лет и/или доказанная органическая патология билиарного тракта/фатерова соска и/или документированный острый панкреатит в анамнезе;
• “лучевые” признаки ХП: изменение размеров ПЖ, дилатация главного панкреатического протока более 2 мм и/или повышение эхогенности его стенок, неровность контуров и неоднородность паренхимы ПЖ, конкременты протоков или кальцификация паренхимы ПЖ;
• прогрессирование трофологической недостаточности при адекватном калораже рациона в отсутствие других объективных причин похудания;
• информированное согласие пациента на участие в исследовании.
Критерии исключения из исследования:
• клинико-инструментальные и лабораторные признаки острого панкреатита;
• наличие гепатита, цирроза печени любой этиологии;
• любая нозология, требующая длительного применения ингибиторов протонной помпы в любом режиме;
• суб- или декомпенсированный рубцово-язвенный стеноз выходногоотдела желудка и ДПК;
• состояние после резекции желудка, гастрэктомии, ваготомии;
• обструктивный, ишемический или аутоиммунный ХП;
• любые другие причины хронической диареи (глутеновая энтеропатия, лактазная недостаточность, воспалительные заболевания кишечника и др.);
• сопутствующий прием препаратов, влияющих на тонус сфинктера Одди: блокаторов кальциевых каналов, нитратов и/или препаратов, прямо воздействующих на экзокринную панкреатическую секрецию (октреотид);
• любые сопутствующие заболевания в стадии декомпенсации (сердечно-сосудистая, почечная недостаточность, сахарный диабет и др.);
• любые опухолевые (злокачественные) заболевания органов пищеварения и других локализаций, химиотерапия и лучевая терапия в анамнезе;
• гиперчувствительность к лекарственным препаратам, используемым в схемах терапии;
• беременность и лактация;
• одновременное участие в других клинических исследованиях;
• любые жалобы, в т. ч. основные, требующие экстренных мер, наркотических анальгетиков и т. п.
Дополнительный критерий исключения к началу 2-го этапа: полное купирование клинико-лабораторных маркеров ВНПЖ после проведения 1-го этапа исследования. В исследование не включали/исключали пациентов, имеющих любой из вышеприведенных критериев.
Всем больным после подписания информативного согласия на 1-м (стационарном) этапе исследования проведен диагностический скрининг в следующем объеме:
• стандартное физикальное и лабораторное обследование;
• эзофагогастродуоденоскопия;
• ультразвуковое исследование (УЗИ) органов брюшной полости;
• качественное копрологическое исследование для оценки наличия нейтрального жира в кале (стеаторея);
• эластазный тест для адекватного подбора дозы ферментного препарата;
• суточная рН-метрия с низведением дистального датчика в ДПК для выявления ацидификации ДПК;
• водородный дыхательный тест и дуоденальное зондирование с посевом порции А для диагностики синдрома избыточного бактериального роста.
Таблица 1. Балльная система расчета выраженности симптомов ВНПЖ.
Больные, включенные в исследование, заполняли анкеты оценки боли, метеоризма, частоты стула. Для объективной оценки проявлений заболевания использовали условную 4-балльную шкалу количественной оценки основных симптомов, а выраженность и их динамику больные оценивали при
помощи визуально-аналоговой шкалы (ВАШ); по этим результатам рассчитывали средний показатель выраженности симптомов (табл. 1). Стандартное копрологическое исследование проводилось для оценки наличия нейтрального жира в кале как основного признака стеатореи. Уровень качества жизни пациентов оценивался с помощью специализированного гастроэнтерологического опросника GIQLI (Gastrointestinal Quality of Life Index) [21, 22]. Анкетирование проведено в начале и в конце 1-го и 2-го этапов исследования. Больные ответили на 36 вопросов, разделенных по категориям: общее субъективное восприятие своего здоровья, психическое, физическое состояние, социальное функционирование, ролевое функционирование. Ответ на каждый вопрос оценивался по шкале от 0 до 4 баллов. Сумма баллов по всем вопросам являлась индексом GIQLI для данного пациента, максимально возможное значение которого составило 144 балла.
После проведения полного обследования больных им, согласно полученным результатам, назначалась дифференцированная терапия сроком на 2 недели. Итак, все исходно включенные в исследование больные получали ЗФТ современным препаратом панкреатина Креоном (в виде мини-микросфер панкреатина – ММСП). В индивидуальном режиме дополнительно назначали ингибитор протонной помпы (омепразол 40 мг/сут) и/или неабсорбируемый антибактериальный препарат широкого спектра действия (рифаксимин по 400 мг 3 раза в сутки в течение 7 дней). Дозу ММСП рассчитывали исходя из полученных данных эластазного теста, разработанного на нашей кафедре [1]. К окончанию стационарного этапа проводилась оценка динамики клинико-лабораторных данных, нарастания массы тела, качества жизни по опросника GIQLI.
К окончанию 1-го этапа исследования у 56 (40 %) из 140 больных было достигнуто купирование клинико-лабораторных маркеров ВНПЖ, эти пациенты выбыли из дальнейшего исследования. Остальным 84 пациентам была рекомендована дифференцированная терапия современными препаратами панкреатина в виде мини-микросфер или микротаблеток в энтеросолюбильной оболочке в индивидуально подобранной дозе, а также омепразол в дозе 20 мг/сут (не у всех больных) в течение 6 месяцев – 2-й этап наблюдения (амбулаторный).
На контрольное обследование через 6 месяцев явились 74 пациента из 84. Из них 41 (55,4 %) больной продолжал четко соблюдать схемы рекомендованного лечения (мини-микросферы и/или миротаблетки ± омепразол), а 33 (44,6 %) – нет.
Среди причин низкой приверженности лечению можно отметить: нерегулярный и/или недостаточный (например, 1 или 2 раза в сутки) прием рекомендованных препаратов;
• несоблюдение доз указанных препаратов;
• произвольную или рекомендованную врачом по месту жительства или фармацевтом в аптеке замену рекомендованного современного препарата панкреатина на препараты со значительно более низкой
активностью липазы (таблетированный панкреатин различных производителей);
• полную отмену лечения через 1–3 месяца от начала терапии.
Десять больных не явились на контрольное обследование и были исключены из дальнейшего анализа. Явившихся на контрольное обследование пациентов разделили на 2 группы: группа А (n = 41) – пациенты, приверженные лечению (выполнявшие данные рекомендации), группа Б (n = 33) – пациенты, не выполнявшие рекомендаций.
В группе А из 41 пациента 31 (75,6 %) принимал Креон, 6 (14,6 %) – Эрмиталь и 4 (9,8 %) – различные галенические препараты панкреатина (Креон, Эрмиталь, Панцитрат) в рекомендуемых и эквивалентных дозах по липазе. Все эти пациенты были объединены в группу А, поскольку принимаемые ими ферментные препараты отвечают всем основным требованиям, предъявляемым к современным ферментным средствам.
Динамическое обследование через 6 месяцев от начала индивидуальной терапии включало клиническое, лабораторное и инструментальное обследование, оценку трофологического статуса, качества жизни по опроснику GIQLI.
Результаты и обсуждение
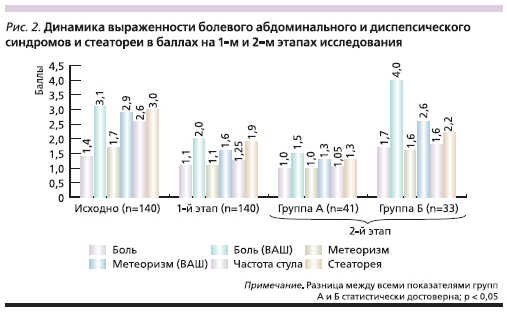
Болевой абдоминальный синдром разной степени выраженности и локализации отмечен у 134 (95,7 %) пациентов. Выраженность болевого абдоминального синдрома была умеренной, в среднем она составляла 1,4 ± 0,06, по ВАШ – 3,1 ± 0,2 балла. Метеоризм был диагностирован у 128 (91,4 %) пациентов с выраженностью в среднем 1,7 ± 0,07, по шкале ВАШ – 2,9 ± 0,16 балла. Диарейный синдром имел место у 114 (81,4 %) больных. Частота стула в среднем составила 2,6 ± 0,11 балла. Стеаторея по нейтральному жиру, по данным копрограммы, была выявлена у 98 (70 %) человек со средней выраженностью 3,0 ± 0,13 балла.
Средний индекс массы тела (ИМТ) у обследованных больных составил 23,4 ± 1,2 кг/м2. Среди всех больных ХП дефицит массы тела был выявлен у 16 (11,4 %) из 140 пациентов, нормальная масса тела – у 94 (67,1 %), избыточная – у 20 (14,3 %), у 10 (7,1 %) из 140 пациентов отмечено ожирение первой степени. Снижение массы тела (от 1 до 10 кг) отмечено у 73 (52,1 %) больных ХП; в среднем потеря массы составила 4,2 ± 1,6 кг.
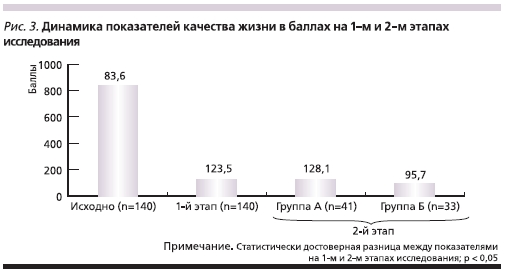
Анализ качества жизни показал низкий уровень по GIQLI у всех больных, включенных в исследование, составивший в среднем 83,6 ± 10,2 балла.
По данным УЗИ органов брюшной полости выявлены следующие изменения: неравномерная эхогенность паренхимы ПЖ была характерной для всех обследуемых больных и встречалась в 100 % случаев, неровность контуров ПЖ – в 80 %, увеличение части или всей ПЖ – в 37,1 %, “сморщива-
ние” ПЖ – в 17,1 %, кальцификация ПЖ – в 12,1 %.
При анализе средних значений показателей общего и биохимического анализов крови отмечены следующие тенденции: снижение уровней общего белка, альбумина крови и абсолютного числа лимфоцитов, умеренное увеличение активности гамма-глутамилтранспептидазы (ГГТ), щелочной фосфатазы (ЩФ), панкреатических ферментов.
По данным эластазного теста, снижение показателя в интервале от 100–199 мкг/г со средними значениями 169,5 ± 2,3 мкг/г выявлено у 60 (42,9 %) больных, что соответствовало умеренно выраженной экзокринной недостаточности. Этим больным назначили ММСП в суточной дозе 100000 ЕД липазы (по 2 капсулы ММСП 10000 5 раз в сутки во время еды). У 24 (17,1 %) больных было выявлено снижение показателей эластазы-1 кала ниже 100 мкг/г со средним показателем 87,5 ± 1,4 мкг/г, что соответствовало выраженной экзокринной недостаточности. Им назначили ММСП в суточной дозе 150000 липазы (по 1 капсуле ММСП 25000 6 раз в сутки во время еды). У 56 (40 %) больных выявлено нормальное значение эластазы-1 кала больше 200 мкг/г со средним показателем 425,2 ± 23,1 мкг/г, что свидетельствовало о сохранной экзокринной функции ПЖ по данным эластазного теста. Эти больные получали ММСП в суточной дозе 50000 ЕД липазы (по 1 капсуле препарата 10000 5 раз в
сутки во время еды).
С учетом наличия признаков бактериальной контаминации тонкой кишки и/или ацидификации ДПК пациенты получали помимо ферментного препарата ингибитор протонной помпы (омепразол по 40 мг/сут – 2 недели) и/или рифаксимин (по 1200 мг/сут – 7 дней).
К окончанию стационарного этапа лечения болевой абдоминальный синдром был купирован у 131 (93,6 %) из 140 пациентов. У 9 (6,4 %) больных отмечены минимальные эпизоды болевого абдоминального синдрома выраженностью в среднем 1,1 ± 0,1 балла, по шкале ВАШ – 2,0 ± 0,3.
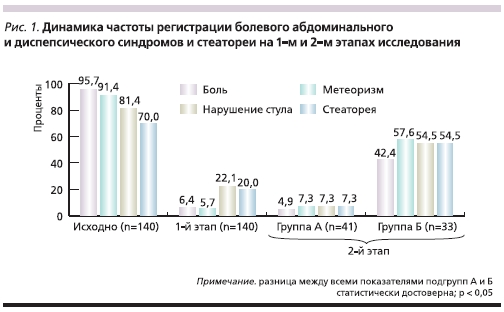
Редукция метеоризма была достигнута у 132 (94,3 %) из 140 пациентов. У 8 (5,7 %) больных сохранялись эпизоды вздутия живота выраженностью в среднем 1,1 ± 0,13, по шкале ВАШ – 1,6 ± 0,26 балла. Стул нормализовался у 109 (77,9 %) из 140 пациентов. У 31 (22,1 %) больных частота стула
по шкале ВАШ составила в среднем 1,25 ± 0,05 балла. Редукция стеатореи, по данным копрограммы, отмечена у 112 (80 %) из 140 пациентов. У 28 (20 %) стеаторея сохранялась с выраженностью в среднем 1,9 ± 0,12 балла (рис. 1 и 2). Среднее значение прибавки массы тела на момент окончания 1-го этапа составило 2,1 ± 0,24 кг. Снижения массы тела зарегистрировано не было.
На фоне проведенного индивидуального лечения отмечена статистически достоверная нормализация следующих показателей крови: общий белка, ГГТ, ЩФ, амилаза, панкреатическая амилаза, липаза, абсолютное число лимфоцитов (р < 0,05). Уровень альбумина оставался незначительно сниженным, но стал статистически достоверно выше после проведенной индивидуальной терапии, чем до начала лечения (р < 0,05).
Средние показатели оценки уровня качества жизни после проведенного дифференцированного лечения стали достоверно выше, составив 123,5 ± 9,4 балла (р < 0,05; рис. 3), увеличение отмечено преимущественно за счет улучшения физического и психического состояния пациентов.
Таким образом, выработанная тактика дифференцированной терапии показала свою хорошую эффективность в редукции симптомов ВНПЖ (метеоризма, диареи, стеатореи), а также в купировании болевого абдоминального синдрома, улучшении нутритивного статуса больных. Именно индивидуальный подход к лечению синдрома ВНПЖ у больных ХП является залогом успешной терапии, сокращения сроков стационарного лечения до 2 недель и улучшения качества жизни пациентов.
По окончании 1-го этапа исследования, согласно критериям исключения, 56 пациентов с полной редукцией клинико-лабораторных маркеров ВНПЖ выбыли из исследования. Стоит отметить, что у этих 56 больных, по данным эластазного теста, была сохранна экзокринная функции ПЖ. Оставшимся 84 больным в амбулаторном порядке рекомендована следующая терапия: 66 пациентам – ММСП в подобранной дозе и ингибитор протонной помпы (омепразол 20 мг/сут), а 18 пациентам – монотерапия ММСП в подобранной дозировке.
По завершении 2-го этапа исследования (через 6 месяцев после выписки из стационара) в клинику пришли 74 пациента. Из них схему рекомендованного лечения соблюдал 41 (55,4 %) больной, а 33 (44,6 %) человека показали низкую приверженность лечению. Десять пациентов не явились на контрольное обследование и были исключены из дальнейшего анализа. Согласно факту приверженности лечению, пациентов, явившихся на заключительный визит, разделили на 2 группы: группу А (n = 41) выполнявших дизайн исследования и группу Б (n = 33) показавших низкую приверженность лечению.
Спустя 6 месяцев после начала индивидуальной терапии среди больных группы А рецидивирование абдоминальной боли отметили только у 2 (4,9 %) пациентов с интенсивностью в 1 балл и 1,5 ± 0,05 балла по шкале ВАШ. В группе Б частота рецидивов болевого абдоминального синдрома была достоверно выше, чем у больных группы А (р < 0,05). Через 6 месяцев наблюдения повторные приступы болей отмечены у 14 (42,4 %) пациентов с интенсивностью в среднем 1,7 ± 0,12 балла по 4-балльной шкале и 4,0 ± 0,5 балла по шкале ВАШ, что потребовало для некоторых из них дополнительного приема анальгетиков.
Диспепсические жалобы также достоверно чаще встречались у пациентов группы Б относительно группы А (р < 0,05). Жалобы на метеоризм предъявили 19 (57,6 %) пациентов группы Б с интенсивностью в среднем 1,6 ± 0,11 балла по 4-балльной шкале и 2,6 ± 0,26 балла по шкале ВАШ.
В группе А за время наблюдения рецидивирование метеоризма отметили только 3 (7,3 %) пациента с интенсивностью в 1 балл и 1,3 ± 0,33 балла по шкале ВАШ.
Через 6 месяцев наблюдения в группе А нарушения стула были зафиксированы только у 3 (7,3 %) из 41 больного с выраженностью в среднем в 1,05 ± 0,03 балла по шкале ВАШ. У 1 пациента этой группы была диарея с частотой стула 3 раза в сутки, у 2 пациентов стул неоформленный, 1–2 раза в сутки. В группе Б нарушения стула отмечались достоверно чаще – у 18 (54,5 %) из 33 пациентов (р < 0,05) с выраженностью в 1,8 ± 0,14 балла по шкале ВАШ.
По данным копрограммы, в группе А всего лишь у 3 (7,3 %) пациентов диагностированы признаки стеатореи по нейтральному жиру (в среднем – 1,3 ± 0,3 балла). В группе Б зарегистрирована достоверно более частая встречаемость нейтрального жира в кале. У 18 (54,5 %) 33 пациентов стеаторея оценивалась в среднем в 2,2 ± 0,2 балла.
За время наблюдения (6 месяцев) снижение массы тела отмечено у 6 (18,2 %) из 33 пациентов группы Б в среднем на 4,0 ± 2,0 кг. Только у 3 (9,1 %) больных этой группы имелся прирост ИМТ – в среднем на 2,2 ± 1,7 кг. Достоверно чаще регистрировалась прибавка массы тела у больных группы А (р < 0,05). Так, у 22 (53,7 %) пациентов средняя прибавка к массе составила 4,5 ± 0,5 кг.
У больных обеих групп при оценке ИМТ через 6 месяцев его уровень соответствовал нормальной массе тела. У больных группы А значения ИМТ были достоверно выше значений у пациентов группы Б (22,3 ± 0,6 и 20,35 ± 0,6 кг/м2 соответственно; р < 0,05). У 10 (30,3 %) пациентов в группе Б произошло снижение ИМТ в интервале 18,4–16,5 кг/м2, что говорило о выраженном дефиците массы тела и подтверждало значимые изменения нутритивного статуса.
Таблица 2. Данные УЗИ органов брюшной полости у больных ХП.
При динамическом УЗИ по окончании 2-го этапа исследования (табл. 2) отмечено, что у пациентов группы А наметилась тенденция к улучшению ультразвуковой картины ПЖ. Увеличенные размеры ПЖ встречались у пациентов этой группы достоверно реже, чем у больных группы Б (2,4 ± 2,4 и 54,5 ± 8,7 % соответственно; р < 0,05). Структурные изменения, свидетельствовавшие о фиброзе, склерозе и кальцификации паренхимы ПЖ в течение 2-го этапа исследования, не претерпели какихлибо изменений.
Через 6 месяцев наблюдения у больных группы А все анализируемые биохимические показатели были в пределах нормальных значений. У пациентов группы Б выявлен дефицит висцерального пула белков (гипопротеинемия до 62,3 ± 0,26 г/л, гипоальбуминемия до 33,1 ± 0,12 г/л), причем указанные показатели были достоверно ниже, чем в группе А (71,8 ± 0,61 и 42,0 ± 0,15 г/л соответственно; р < 0,05). Достоверное снижение уровня общего белка, альбумина, абсолютного числа лимфоцитов у больных группы Б свидетельствовало о сохраняющейся трофологической недостаточности у этих пациентов, требующей медикаментозной коррекции. Кроме того, у этих больных зафиксировано достоверное увеличение значений ГГТ и ЩФ выше нормы по сравнению с показателями у пациентов группы А (р < 0,05). Уровни панкреатических ферментов крови были в пределах нормы у больных обеих групп. Однако необходимо отметить, что у 2 (6 %) из 33 пациентов группы Б сохранялись повышенные показатели панкреатической ферментемии, а у 8 (24,2 %) эти показатели были ниже нормальных значений. У этих больных, по данным УЗИ, были также зафиксированы выраженные структурные изменения ПЖ (неровность контуров, неравномерная эхогенность паренхимы, “сморщивание” ПЖ), что косвенно свидетельствовало о прогрессировании структурных изменений в ПЖ.
Уровень качества жизни в группе А был достоверно выше, чем в подгруппе Б (128,1 ± 8,2 и 95,7 ± 9,4 соответственно; р < 0,05; рис. 3).
На основании всех этих данных можно с уверенностью сказать, что подобранная терапия оказалась эффективной. У больных, соблюдавших рекомендации (группа А), достоверно реже возникали рецидивы болевого абдоминального и диспепсического синдромов, была отмечена нормализация белкового обмена и нутритивного статуса с устранением дефицита массы тела, не было выявлено прогрессирования структурных изменений в ПЖ по данным УЗИ. В течение 6 месяцев при соблюдении рекомендаций эти больные не испытывали потребности в дополнительном сопутствующем лечении и среди них не было ни одного случая госпитализации по поводу обострения ХП. В группе Б (среди пациентов, не соблюдавших рекомендаций) отмечено более частое рецидивирование болевого абдоминального и диспепсического синдромов на фоне прогрессирующих изменений нутритивного статуса, что потребовало в 30,3 % случаев стационарного лечения. Качество жизни больных, принимавших в виде ЗФТ современные ферментные препараты, было статистически достоверно выше, чем у пациентов, использовавших таблетированный панкреатин (р < 0,05).
Выводы
1. В качестве ЗФТ у больных ХП с синдромом ВНПЖ целесообразно использовать ферментные препараты IV поколения (Креон или аналоги) в дозе, рассчитанной по данным эластазного теста или в стартовой дозе не менее 100000 ЕД FIP липазы в сутки.
2. Длительное использование подобранных доз ферментных препаратов IV поколения в сочетании с подходами к коррекции вторичных механизмов ВНПЖ приводит к достоверному купированию болевого абдоминального и диспепсического синдромов, стеатореи, улучшению трофологического статуса, а также повышению качества жизни, что подтверждает эффективность выработанных схем индивидуальной терапии.



