Лечение злокачественных глиом головного мозга, с одной стороны, является одной из нерешенных задач онкологии, с другой – в последние два десятилетия достигнуты определенные успехи в лечении этих опухолей благодаря появлению и внедрению в клиническую практику современных противоопухолевых препаратов. Исторически для лечения опухолей мозга первыми стали использоваться препараты с хорошей липофильностью, преодолевающие гематоэнцефалический барьер. Так, наиболее распространены производные нитрозомочевины, среди которых наибольшим коэффициентом липофильности (водно-липидным соотношением) обладает фотемустин, зарегистрированный в нашей стране как Мюстофоран. Наилучшие результаты применения нитрозопроизводных, в частности Мюстофорана, достигнуты у больных глиомами III степени злокачественности (Grade III), по морфологической классификации ВОЗ – анапластической астроцитомой, анапластической олигодендроглиомой и анапластической олигоастроцитомой. Степень злокачественности глиом имеет решающее прогностическое значение, что видно из анализа базы данных пациентов, получавших комплексное лечение по поводу злокачественных глиом, собранной в НИИ нейрохирургии (ИНХ).
На рис. 1 представлены показатели выживаемости больных злокачественными глиомами, получивших лечение в ИНХ в 1998–2002 гг. в режиме операция + лучевая терапия (ЛТ) + химиотерапия (ХТ) на основе нитрозопроизводных.
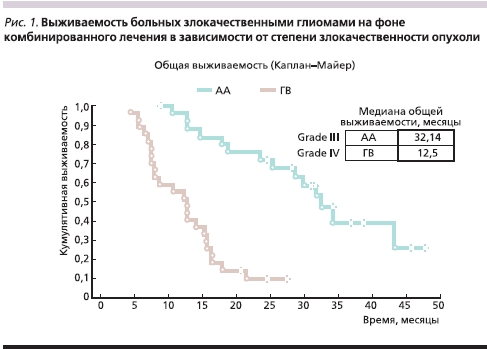
При анализе кривых Каплан–Майера видно, что медиана выживаемости у больных глиобластомой составила 12,5, а у больных AA – 32 месяца. Эти показатели соответствуют данным, опубликованным в мировой научной литературе. Однако если для больных анапластической астроцитомой достигнутые показатели выживаемости следует признать вполне приемлемыми, то для больных глиобластомой они не превышают показателей, достигнутых при использовании только ЛТ в качестве единственного адъювантного метода лечения после операции. Таким образом, эти две нозологические формы требуют различного подхода к выбору режима лечения, что мы учли при планировании дизайна настоящего исследования. Мы также учли опыт предшествовавшего настоящему проекту исследования Must Study I, в рамках которого в 2003–2005 гг. в лечении больных с неоперабельными злокачественными глиомами использовали Мюстофоран в виде монотерапии. Тогда были получены схожие с представленными выше данные: у больных глиобластомой медиана выживаемости составила чуть более 11,0, у больных анапластическими глиомами – 29,5 месяца.
В настоящем исследовании было решено использовать Мюстофоран в виде монотерапии у больных анапластическими глиомами (Grade III ВОЗ) и в комбинации с карбоплатином и этопозидом у больных глиобластомами (Grade IV ВОЗ). Первичной целью исследования была оценка безрецидивной выживаемости больных указанных групп. Вторичные цели заключались в оценке общей выживаемости больных, непосредственной эффективности ХТ Мюстофораном в виде монотерапии у больных анапластическими глиомами (Grade III ВОЗ) и в комбинации с карбоплатином и этопозидом у больных глиобластомами (Grade IV ВОЗ), гематологической и иной токсичности исследуемых режимов ХТ.
Материал и методы
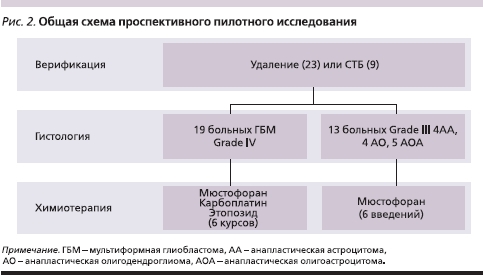
Данная работа проводилась в формате пилотного проспективного исследования с включением параллельно двух групп пациентов с впервые диагностированными злокачественными глиомами – глиобластомами (Grade IV ВОЗ), а также анапластическими астроцитомами и олигоастроцитомами (Grade III ВОЗ). Набор больных осуществлялся с марта по сентябрь 2008 г. Всего были включены 32 пациента: 19 – с мультиформной глиобластомой (ГБМ) и 13 – с анапластическими глиомами, их них 23 пациента были после удаления опухоли и 9 – после верификации диагноза путем стереотаксической биопсии – СТБ (рис. 2).
Критерии включения:
• наличие супратенториальной злокачественной глиомы;
• возраст – 15–70 лет;
• коэффициент Карновского > 50;
• гистологическая верификация диагноза в результате удаления опухоли или СТБ;
• удовлетворительные исходные показатели общего и биохимического анализов крови;
• отсутствие какого-либо иного противоопухолевого лечения;
• иммунокомпетентные состояния;
• отсутствие тяжелых соматических заболеваний;
• подписание пациентом информированного согласия на участие в исследовании.
В группу больных ГБМ вошли 19 пациентов в возрасте от 19 до 68 лет (медиана возраста – 44 года); 13 больным опухоль была удалена, в 6 случаях от удаления опухоли было решено воздержаться; с целью верификации диагноза выполнена только СТБ. Всем больным до поступления в ИНХ проведена магнитно-резонансная томография (МРТ) с контрастированием, а после операции – контрольная компьютерная томография (КТ) с контрастированием и МРТ с контрастированием.
После верификации диагноза в течение двух недель был проведен первый курс ХТ в режиме:
• карбоплатин 5 AUC – день 1-й
• этопозид – 80 мг/м² – дни 1–3-й
• Мюстофоран (фотемустин) – 100 мг/м² – день 3-й;
Противорвотное прикрытие осуществляли с помощью ондансетрона в дозе 8 мг, который вводили внутривенно во все дни лечения перед введением химиотерапевтических препаратов. Курсы ХТ повторяли каждые 4–6 недель в зависимости от картины крови, 9 пациентов параллельно получали курс стандартной ЛТ – по 2 Гр на фракцию, 5 фракций в неделю, суммарная очаговая доза (СОД) – 60 Гр по 80 %-ной изодозе с включением в зону облучения контрастируемой части опухоли и 3 см вокруг очага поражения. Остальным 10 пациентам ЛТ не проводили из-за выраженной внутричерепной гипертензии, обусловленной распространенностью опухоли. Три пациента получили курс ЛТ после 6 курсов ХТ с частичным ответом на лечение, в результате которого наблюдалось разрешение внутричерепной гипертензии.
Группу больных анапластическими глиомами составили 13 пациентов в возрасте от 18 до 51 года (медиана возраста – 36 лет). Из них у 10 опухоль была удалена, а у 3 проведена СТБ. В этой группе с учетом нашего опыта и данных исследования Must Study I, свидетельствующих о высокой эффективности Мюстофорана у больных анапластическими глиомами, ХТ в режиме монотерапии Мюстофораном проводили в качестве первой линии лечения после верификации диагноза путем удаления опухоли или СТБ. Режим химиотерапии Мюстофораном был стандартным и состоял из индукционного курса – трех еженедельных инфузий в дозе 100 мг/м², а затем трех поддерживающих инфузий в той же дозе с интервалом 3–5 недель между инфузиями. Противорвотная терапия была такой же, как и у больных ГБМ (8 мг ондансетрона внутривенно перед каждым введением Мюстофорана).
По окончании химиотерапии Мюстофораном (или при прогрессировании заболевания на фоне лечения) выполняли контрольную МРТ с контрастированием с целью оценки эффективности лечения и принятия решения (совместного с врачами-радиологами) о проведении ЛТ.
Всем больным обеих групп на фоне ХТ не реже одного раза в неделю делали клинический анализ крови и не реже одного раза в месяц – биохимический анализ крови, а также общий анализ мочи; проводили регулярное клиническое обследование с неврологическим осмотром (перед каждым курсом ХТ). Не реже одного раза в 3 месяца или при возникновении клинических признаков прогрессирования болезни выполнялась контрольная МРТ с контрастированием.
В качестве критериев оценки эффективности использовали следующие показатели:
• время до прогрессирования (от момента гистологической верификации диагноза до прогрессирования, подтвержденного на МРТ с контрастированием);
• общая выживаемость (время от момента гистологической верификации диагноза до смерти пациента);
• непосредственная эффективность лечения оценивалась на основе критериев Макдональда.
Результаты
Медиана выживаемости без прогрессирования у больных ГБМ, получавших в качестве адъювантного лечения ХТ в режиме Мюстофоран + карбоплатин + этопозид, составила 8,7 месяца (минимум – 1,5, максимум – 18,4), а медиана общей выживаемости в этой группе составила 16,3 месяца (минимум – 1,0, максимум – 20,1). Только 9 из 19 больных ГБМ параллельно с ХТ проводили стандартный курс ЛТ (60 Гр в течение 6 недель). Эти данные представлены на рис. 3, 4.
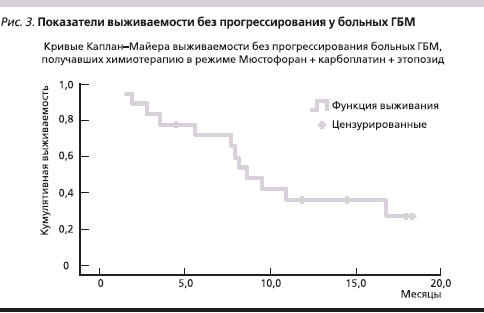
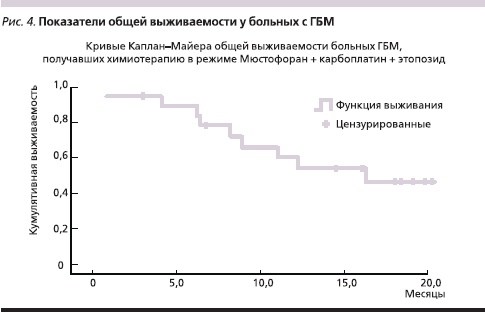
Гематологическая токсичность на фоне этой схемы лечения оказалась достаточно высокой. Всего проведено 86 курсов ХТ, оценено в плане токсичности – 60. Нейтропения III–IV ст. отмечена после 31-го курса (51,6 %), по поводу чего в 18 случаях использовались препараты Г-КСФ (гранулоцитарного колониестимулирующего фактора), у 1 больного на фоне нейтропении развилась пневмония, что послужило причиной задержки нового курса более чем на 3 недели, далее было выявлено прогрессирование болезни. Тромбоцитопения III–IV ст. была выявлена у 6 больных (10 %). Коррекция доз химиопрепаратов проведена в 6 случаях.
Негематологическая токсичность проявлялась в основном гастроинтестинальными нарушениями: тошнотой и рвотой III–IV ст. – 7 (11 %) циклов из 60, несмотря на стандартную противорвотную терапию ондансетроном внутривенно во все дни введения химиопрепаратов. Печеночная токсичность Grade III–IV (в виде повышения уровня трансаминаз в биохимическом анализе крови) выявлена у 3 из 15 оцененных больных. У 1 пациента развился асептический флебит кубитальной вены, в которую вводили Мюстофоран.
Таким образом, достигнуты достаточно убедительные показатели выживаемости, особенно с учетом достаточно большого числа пациентов с неоперабельными ГБМ, включенных в настоящее исследование (подробнее остановимся на этом в обсуждении).
Медиана выживаемости без прогрессирования у больных анапластическими глиомами (Grade III ВОЗ), получавших в качестве адъювантного лечения ХТ в режиме монотерапии Мюстофораном, к моменту анализа данных не достигнута и составляет более 25 месяцев (минимум – 3 месяца; рис. 5), соответственно, в этой группе больных не достигнута и медиана общей выживаемости.
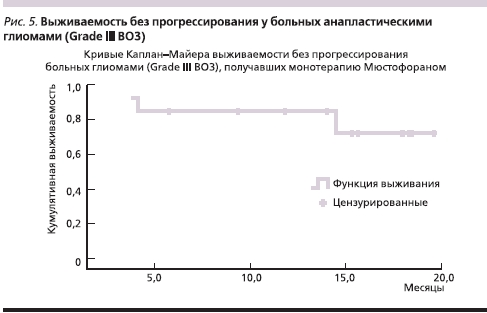
Гематологическая токсичность (III–IV ст.) установлена у 10 больных. Индукционный курс проведен всем 13 больным. Задержка консолидирующего курса была в 5 (50 %) случаях: 1 – из-за гематологической токсичности III–IV ст., 4 – из-за гематологической токсичности II ст. В трех случаях проведена коррекция доз. Нейтропения III–IV ст. выявлена у 3 (30 %) из 10 пациентов, тромбоцитопения III–IV ст. – у 1 (10 %) из 10 и анемия III–IV ст. – также у 1 (10 %) больного.
Негематологическая токсичность III–IV ст. отмечена в единичных случаях: Тошнота и рвота – у 1 больного; печеночной или почечной выявлено не было; флебиты кубитальных вен развились у 2 из 13 пациентов
Таким образом, режим монотерапии Мюстофораном подтверждает свою высокую эффективность в лечении больных с анапластическими глиомами Grade III ВОЗ, что дает основания рекомендовать его в качестве одного из приоритетных для адъювантной терапии этой категории больных глиомами.
Обсуждение
В настоящее время применение ХТ в сочетании с ЛТ у больных глиобластомами, по данным большинства крупных исследований, позволяет достичь медианы выживаемости, составляющей примерно 14,5 месяцев. Наш опыт использования этого режима также достаточно положительный: медиана выживаемости 48 больных ГБ, после операции получавших химиолучевую терапию с темозоломидом, составила 17,7 месяца. Чтобы оценить эффективность режима данного пилотного исследования (химиотерапии Мюстофораном + карбоплатин + этопозид), мы решили сравнить показатели выживаемости больных глиобластомами из исследования Must Study-2 с режимом химиолучевая терапия + темозоломид с помощью кривых выживаемости без прогрессирования больных этих групп (рис. 6).
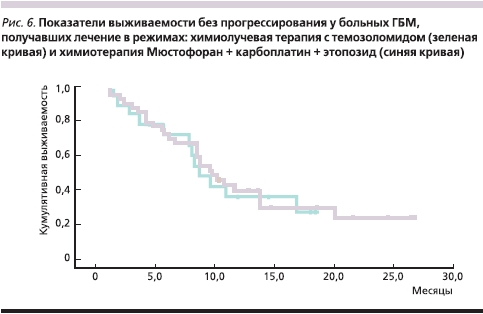
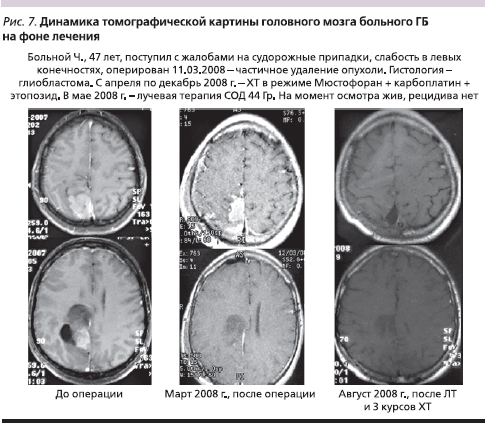
Из представленных графиков видно, что наш режим лечения оказался таким же эффективным, как и режим химиолучевой терапии с темозоломидом. Идеологически мы использовали этот режим ХТ в тех случаях, когда ЛТ представлялась опасной для больных в раннем послеоперационном периоде из-за большого объема остаточной опухоли, ее распространенности, сохраняющейся внутричерепной гипертензии. Мы рассчитывали, что комбинация Мюстофорана с производными платины позволит уменьшить объем остаточной опухоли хотя бы в части случаев, и это позже было подтверждено в ряде клинических наблюдений. Примером эффективного применения данного режима является клинический случай, представленный на рис. 7. Следует, правда, отметить, что указанная комбинация более токсична, чем режим химиолучевой терапии с темозоломидом, но использование ее представляется более целесообразным в случаях большой остаточной опухоли после удаления или ее распространенности на мозолистое тело и первичной множественности, т. к. непосредственная эффективность монотерапии темозоломидом невысока.
Для больных анапластическими глиомами стандартом является использование ЛТ после операции, а стандартного режима ХТ нет. Одним из наиболее распространенных является режим PCV (ломустин, Натулан, винкристин). Но этот режим достаточно токсичен, во многих случаях приходится увеличивать интервалы между курсами, а части больных не удается выполнить полную программу лечения (6–8 курсов); некоторые отмечают выраженную астению.
В то же время монотерапия Мюстофораном весьма эффективна у данной категории больных, хорошо переносится. Токсичность Мюстофорана в монотерапии умеренная. Нам представляется, что режим монотерапии Мюстофораном может быть рекомендован в качестве одного из приоритетных в адъювантном лечении больных анапластическими глиомами (Grade III по ВОЗ).


