Широко известно, что среди всех онкологических заболеваний у детей опухоли центральной нервной системы (ЦНС) по частоте встречаемости стойко занимают второе место после гемобластозов. В свою очередь более 50 % из них представлены новообразованиями глиальной природы, т. е. глиомами, среди которых около 25 % составляют низкодифференцированные, т. е. злокачественные, нозологические формы, преимущественно анапластическая астроцитома и мультиформная глиобластома.
Лечение злокачественных (низкодифференцированных) глиальных опухолей головного мозга у детей является на сегодняшний день наиболее трудной задачей в детской нейроонкологии. В силу диффузного характера роста подавляющее большинство опухолей невозможно удалить тотально. Лучевая терапия в послеоперационном периоде позволяет достичь не более чем 6–8-месячного периода относительной ремиссии заболевания. Схемы эффективной лекарственной терапии практически отсутствуют. Чувствительность же низкодифференцированных глиом к используемым в настоящее время цитостатическим препаратам (темозоломиду, прокарбазину, препаратам платины, винка-алкалоидам, производным нитрозометилмочевины и другим алкилирующим лекарственным средствам), не превышает 30–40 %. При этом стойкого или минимального длительного (> 6 месяцев) лечебного эффекта (относительной ремиссии) добиться, как правило, не удается.
В течение последних 3 лет в зарубежной литературе появились сведения об успешном применении в лечении низкодифференцированных глиом препарата т. н. таргетной терапии Авастина (бевацизумаба), традиционно используемого в комплексном лечении некоторых видов рака (колоректальный рак, немелкоклеточный рак легкого, рак молочной железы, почечно-клеточный рак). Эффективность комбинаций Авастина, например, с иринотеканом и темозоломидом (Темодалом) при глиобластоме и анапластической астроцитоме, в т. ч. рецидивного характера, уже в первой фазе проводимых исследований оказалась выше 70 %, а средняя общая продолжительность жизни больных увеличилась до 18–20 месяцев (“стандартной” на сегодня считается продолжительность жизни 10–12 месяцев). Семейство фактора роста эндотелия сосудов (VEGF – vascular endothelial growth factor) и его рецепторов является наиболее важной медиаторной системой в ангиогенезе глиом [1]. VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PlGF – placenta growth factor), связываясь с тирозинкиназными рецепторами VEGFR-1, VEGFR-2 и VEGFR-3, активируют их аутофосфорилирование, запуская многочисленные внутриклеточные сигнальные пути, которые в итоге приводят к пролиферации и миграции эндотелиальных клеток, выживанию незрелых эндотелиальных клеток посредством предотвращения апоптоза, повышению сосудистой проницаемости. Основным пусковым механизмом ангиогенеза опухоли считают тканевую гипоксию, вследствие которой происходит выброс фактора, индуцируемого гипоксией (HIF-1 – hypoxia inducible factor-1). HIF-1 в глиомах участвует в ап-регуляции не только VEGF, но и β-трансформирующего факторов роста (TGF-β – transforming growth factor beta) [2], эпидермального фактора роста (EGF – epidermal growth factor), тромбоцитарного фактора роста (PDGF – platelet-derived growth factor) [3], основного фактора роста фибробластов (FGF – fibroblast growth factor) [4]. В глиомах также находят фактор некроза опухоли α (TNF-α – tumor necrosis factor), который действует на ангиогенез опосредованно – через повышение экспрессии VEGF. Действие TGF-β и VEGF в свою очередь приводит к повышению экспрессии матриксных металлопротеиназ ММР-2 и ММР-9, которые протеолитически расщепляют экстрацеллюлярный матрикс, способствуя более легкому продвижению эндотелиальных клеток и инвазии опухолевой ткани [5, 6].
Применение совместно с химиотерапией моноклональных антител к VEGF (бевацизумаба), селективно связывающих VEGF и препятствующих его взаимодействию с рецепторами, привело к пересмотру тактики лечения колоректального рака на поздних стадиях [7, 8], рака молочной железы [9, 10], немелкоклеточного рака легкого [11, 12] и почечно-клеточного рака [13]. Накопленные данные о течении процессов ангиогенеза в злокачественных глиомах, успешный опыт применения бевацизумаба для лечения указанных выше опухолей позволили думать об эффективности терапии бевацизумабом низкодифференцированных (злокачественных) глиом.
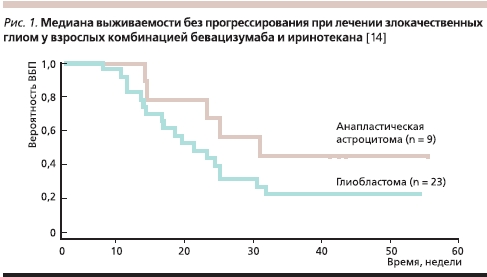
Клиническое исследование комбинации бевацизумаба в дозе 10 мг/кг одновременно с иринотеканом в дозе 125 мг/м² или 340 мг/м² каждые 2 недели для лечения рецидива злокачественных глиом у взрослых показало, что рентгенологический ответ был получен у 20 (63 %) из 32 пациентов, включенных в исследование. В одном случае ответ был полным (ПО), в 19 был достигнут частичный ответ (ЧО), определяемый как уменьшение объема опухоли на 50 % и более. Среди 9 пациентов с анапластической астроцитомой было достигнуто 6 частичных рентгенологических ответов и в 3 случаях – стабилизация заболевания (СЗ). Среди 23 пациентов с глиобластомой у одного достигнут ПО, в 13 случаях наблюдался ЧО, в 8 – СЗ и в 1 – прогрессирование заболевания (ПЗ). Для всех глиом 6-месячная выживаемость без прогрессирования заболевания (6-ВБП) составила 38 %, а медиана ВБП – 23 недели (рис. 1). У пациентов с анапластической астроцитомой показатель 6-ВБП был выше по сравнению с пациентами, имевшими глиобластому, и равнялся 56 против 30 % соответственно; 6-месячная общая выживаемость (6-OВ) для всех больных составила 72 % [14].
В регистрационном исследовании II фазы (BRAIN) сравнивали две схемы ведения пациентов с рецидивом глиобластомы: 1) монотерапию бевацизумабом в дозе 10 мг/кг 1 раз в 2 недели и 2) бевацизумаб в дозе 10 мг/кг каждые 2 недели в комбинации с иринотеканом в дозе 125 мг/м² или 340 мг/м² 1 раз в неделю. Для пациентов, получавших только бевацизумаб (n = 85), 6-ВБП составила 42,6 %, а в группе бевацизумаб + иринотекан (n = 82) – 50,3 %. Медиана ВБП достигла 4,2 и 5,6 месяца соответственно.
Медиана OВ у пациентов, получавших только бевацизумаб, составила 9,6 месяца, а в группе бевацизумаб + иринотекан – 8,7 [15].
В исследование Narayana A. и соавт. (2009) был включен 61 пациент с рецидивом высокозлокачественных глиом, 54 из которых получали бевацизумаб в дозе 10 мг/кг одновременно с иринотеканом в дозе 125 мг/м² каждые 2 недели, 7 пациентов получали комбинацию бевацизумаб + карбоплатин. Медиана OВ для всех пациентов составила 9,00 ± 0,92, медиана ВБП – 5,00 ± 0,77 месяца. Оценка ответа опухоли на терапию, подтвержденного нейровизуализацией, была проведена у 53 больных. Полный ответ наблюдался у 7 (13,2 %) пациентов, ЧО – у 32 (60,4 %), СЗ – у 11 (20,7 %), ПЗ – у 3 (5 %) пациентов [16].
Ретроспективное исследование Narayana А. и соавт. (2010), в которое были включены 12 пациентов в возрасте от 4 до 22 лет с диагнозом рецидив высокозлокачественной глиомы, показало, что при использовании бевацизумаба в дозе 10 мг/кг в комбинации с иринотеканом в дозе 125 мг/м² каждые 2 недели медиана ВБП и ОВ равны 2,25 и 6,25 месяца соответственно. Частичный радиологический ответ наблюдался только у 2 (16,7 %) пациентов, СЗ –у 4 (33,3 %), ПЗ –у 6 (50 %) пациентов. Полученные результаты были хуже по сравнению с результатами лечения по той же схеме у взрослых и не лучше по сравнению с историческим контролем [17].
Опыт применения бевацизумаба (Авастина) у детей очень ограничен. В исследовании Packer R.J. и соавт. (2009) изучалась эффективность применения комбинации бевацизумаба и иринотекана у детей с множественными рецидивами низкозлокачественных глиом. В исследование вошли 10 пациентов, медиана возраста которых составила 5,2 года. Использовалась комбинация бевацизумаба в дозе 10 мг/кг с иринотеканом в дозе 125 мг/м² каждые 2 недели. После 2 циклов терапии у 7 пациентов зафиксированы объективные ответы в виде ПО у 1 пациента, ЧО – у 3 и минимального ответа – у 3 оставшихся. При этом у одного пациента с минимальным ответом опухоли был зафиксирован ЧО после проведения еще 2 циклов терапии. У 2 пациентов наблюдалась СЗ. У 1 больного терапия была отменена ранее чем через 2 месяца из-за ее возможной непереносимости. В связи с этим у данного пациента эффект не оценивали, несмотря на то что по данным магнитно-резонансной томографии был зафиксирован минимальный ответ [18].
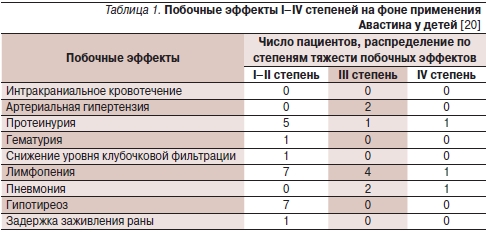
Среди наиболее вероятных побочных эффектов Авастина у взрослых описываются колебания артериального давления, редко – кровоточивость слизистых оболочек, тромбозы и тромбоэмболии. У детей побочные эффекты бевацизумаба изучены недостаточно. По данным исследования I фазы, дети с солидными опухолями переносили бевацизумаб хорошо. Из 20 включенных в исследование пациентов только у одного наблюдалась III степень токсичности в виде лимфопении. Общими, не зависимыми от дозы стали нежелательные эффекты I–II степени в виде инфузионной реакции (n = 3), сыпи (n = 3), мукозита (n = 2) и протеинурии (n = 3). Кровотечений и тромбозов зарегистрировано не было. У 11 из 16 пациентов повышалось артериальное давление с медианой подъема 6 мм рт. ст. для систолического и 9 мм рт. ст. для диастолического давления [19].
По данным Reismuller B. (2010), ни у одного из 30 детей с опухолями ЦНС, получавших бевацизумаб, интракраниальных кровотечений не наблюдалось [20]. У одного пациента с диагнозом: примитивная нейроэктодермальная опухоль произошло кровоизлияние в опухоль на фоне прогрессирования заболевания спустя 6 недель после окончания введения бевацизумаба. Повышение артериального давления до III степени, потребовавшее антигипертензивной терапии, наблюдалось у двух пациентов. У одного из них развилась протеинурия IV степени с нефротическим синдромом, который впоследствии купировался.
Все же в последующем лечение бевацизумабом у этих двух больных было прекращено. У 7 из 30 (23 %) детей наблюдалась протеинурия (IV степени – 1; III степени – 1; I степени – 5 случаев). Лимфопения была зарегистрирована у 12 из 30 детей (IV степени – 1; III степени – 4; II степени – 4; I степени – 3 случая). Вновь диагностируемый гипотиреоз, потребовавший заместительной терапии, зафиксирован у 7 (23 %) из 30 пациентов с медианой 8,2 месяца от начала терапии бевацизумабом. За исключением одного пациента, у шести других ранее проводилось краниальное облучение. Шестеро из 30 пациентов получали заместительную терапию до получения бевацизумаба. Побочные эффекты, возникшие на фоне применения Авастина, представлены в табл. 1.
Мы располагаем опытом применения Авастина у 17 детей в возрасте от 2 до 17 лет (12 мальчиков, 5 девочек) с диагнозами: глиобластома (морфологически верифицированная) – 13 больных, анапластическая астроцитома головного – 3 случая и спинного мозга – 1 случай. Все пациенты получали комбинированную противоопухолевую терапию, включавшую цитостатический препарат и бевацизумаб (Авастин) в дозе 5 мг/кг, назначаемый дважды в месяц, в 1-й и 15-й (7 пациентов) или 1-й и 21-й дни (10 пациентов).
Пациентов, получавших лечение с использованием Авастина, распределили в две исследовательские группы:
• В 1-ю группу вошли 9 пациентов с продолжавшимся ростом опухоли после проведения комплексного лечения с использованием стандартных цитостатических препаратов в составе химиотерапии; в этой группе комбинация Авастин + цитостатический препарат использовалась в качестве противоопухолевой терапии 2-й или 3-й линии.
• Во 2-ю группу вошли 8 пациентов с впервые выявленным заболеванием, у которых Авастин применялся в 1-й линии в комбинации с темозоломидом как третий этап после оперативного и лучевого лечения.
На момент начала терапии у 14 больных имелся визуализируемый при магнитно-резонансной томографии опухолевый субстрат. В качестве цитостатического агента в 1-й группе мы использовали иринотекан (Кампто) у 7 детей, цисплатин с иринотеканом (последовательно) – у 1 ребенка и иринотекан с темозоломидом также у 1 больного.
Пациентам 2-й группы Авастин 5 мг/кг в 1-й и 15-й дни внутривенно капельно в течение одного часа назначали в комбинации с темозоломидом, применяемым в стандартном цикловом режиме (150 мг/м² внутрь в 1–5-й дни).
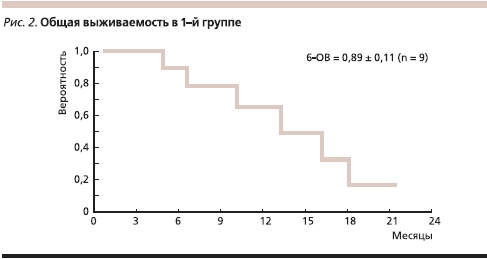
Результаты лечения оценены у всех больных (табл. 2). В 1-й группе из 7 пациентов, имевших визуализируемый опухолевый субстрат, у 4 отмечен ЧО, у 3 – СЗ; 2 ребенка не имели остаточной опухоли перед началом терапии. На сегодняшний день в 1-й группе живы три пациента. Один ребенок находится в длительной ремиссии, завершив лечение; двое продолжают получать терапию со сроками ремиссии 7 и 10 месяцев. Длительность сохранения лечебного эффекта, характеризующая увеличение срока общей выживаемости больных, составила от 4 до 21 месяца (с медианой наблюдения 10,5 месяца). Таким образом, медиана ВБП на сегодняшний день составила 8,5, а медиана ОВ – 13,3 месяца; 6-ВБП равна 67 % (рис. 2, 3).
Примечание. М – мужской, Ж – женский. Гб – глиобластома, АА – анапластическая астроцитома. Объем резекции [21]. О – операция, ЛТ – лучевая терапия, TMЗ – темозоломид, ЦП + ЭТ – цисплатин + этопозид.

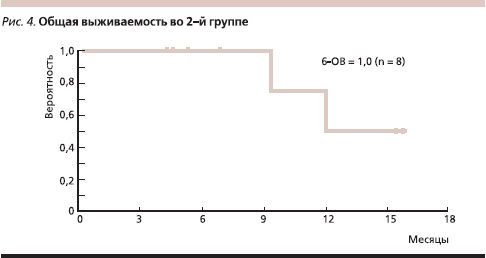
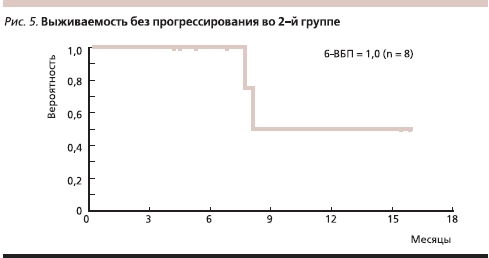
Во 2-й группе у всех больных диагностирована стабилизация опухолевого процесса или ЧО продолжительностью от 4 до 16 месяцев, 6 пациентов продолжают терапию без прогрессирования болезни в течение 4–16 месяцев, умерли два больных. Медиана наблюдения составила 8,7 месяца. Медианы ВБП и ОВ еще не достигнуты; 6-ВБП равна 100 % (рис. 4, 5).
Переносимость лечения была удовлетворительной (токсичность оценивали в соответствии с Common Terminology Criteria for Adverse Events Version 3.0), у двух пациентов 1-й группы отмечены схваткообразные боли в животе и кратковременная диарея, ассоциированные с применением иринотекана, и обратимая неосложненная тромбоцитопения III степени (ВОЗ) на фоне применения темозоломида у трех больных 2-й группы. Других клинически значимых побочных эффектов и осложнений проводимой терапии не наблюдалось.
Таким образом, по нашим наблюдениям, Авастин, используемый в комбинации с цитостатическими препаратами, показал хорошую переносимость и достаточно высокую эффективность, которая выражалась в увеличении ОВ у детей с низкодифференцированными глиомами головного и спинного мозга по сравнению с литературными данными исторического контроля. Это несомненно требует продолжения исследований, в т. ч. по использованию комбинированной (цитостатической + таргетной) терапии у детей с низкодифференцированными глиальными опухолями головного и спинного мозга в 1-й линии комплексного лечения.



